黄芪三七合剂通过调控Arid2-IR/NF-κB 信号轴改善糖尿病肾病小鼠肾炎症反应
2020-07-08林晓李健春谭睿陟文丹谢席胜王丽
林晓,李健春,谭睿陟,文丹,谢席胜,王丽*
(1. 西南医科大学附属中医医院中西医结合研究中心,四川 泸州 646000; 2. 西南医科大学附属医院肾病内科,四川 泸州 646000; 3. 南充市中心医院肾病科,四川 南充 637000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最严重的微血管并发症之一,发病率呈逐年上升趋势,已超过肾小球肾炎成为终末期肾病的主要病因[1-2]。 目前尚无较理想的治疗药物,积极寻找新的分子靶点尤为重要[2]。 长链非编码RNA(Long non-coding RNA,lncRNA)作为在多种疾病中出现的新的基因调控因子和治疗靶点备受关注。 最新研究结果显示,肾炎症反应是糖尿病肾病发生和发展过程中的关键环节,lncRNA 与糖尿病肾病炎症反应存在密切联系[3]。 一些糖尿病肾病中高表达的lncRNA 能够促进肾的炎症反应和纤维化,加快疾病的发展进程[4-6]。 lncRNA Arid2-IR 是一种最先发现于UUO 小鼠肾中高表达的lncRNA,其主要功能为促进NF-κB 依赖性肾炎症,故在治疗肾炎症和纤维化方面具有一定潜力[7]。 目前已有报道,lncRNA Arid2-IR 在糖尿病肾病中存在高表达,但关于Arid2-IR 在糖尿病肾病尤其是糖尿病肾病炎症方面的研究甚少,其生物学功能尚未明确[8]。
中医药在肾疾病方面应用历史悠久,黄芪三七合剂为本课题组在临床上长期用于治疗慢性肾病的复方制剂,对肾功能受损有明显改善作用[9-10]。该方主要由黄芪、三七、昆布、怀牛膝等组成,对糖尿病肾病也有一定改善作用,但确切机制有待进一步研究。 本文旨在通过动物实验研究,观察黄芪三七合剂对糖尿病小鼠肾炎症的作用,并通过检测黄芪三七合剂对Arid2-IR/NF-κB 信号轴的影响,阐明其可能存在的作用机制,从而为指导临床用药提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
50 只SPF 级C57BL/6 小鼠,雄性,6 ~8 周龄,体重约为18 ~20 g,购于成都达硕实验动物有限公司【SCXK(川)2015-030】,饲养于西南医科大学实验动物中心【SYXK(川)2018-065】,室温20 ~22℃,相对湿度50% ~60%,光照12 h 明暗交替。所有实验操作均由西南医科大学伦理委员会批准(审批号:2019DW017)。
1.1.2 药物及给药
黄芪三七合剂主要试剂为黄芪30 g,三七10 g,怀牛膝30 g,当归30 g,昆布30 g 组成,本实验采用中药免煎剂,采购和制备均由西南医科大学附属中医医院中药房完成。 用蒸馏水混匀药物,最终每毫升药液含生药量0.26 g,小鼠每20 g 取0.14 mL 的灌胃量,按1 倍、4 倍剂量等体积每日给低、高剂量组小鼠灌胃。 厄贝沙坦购自赛诺菲(杭州)制药有限公司,配置成等体积混悬液给小鼠灌胃。
1.1.3 试剂与仪器
STZ ( Sigma,S0130 ),Go ScriptTMReverse Transcription System(Promega,A5001),总RNA 提取试剂盒(北京天根生化科技,DP419),肌酐测定试剂盒、尿素氮测定试剂盒和尿蛋白测定试剂盒(南京建成生物工程研究所,C011-2-1,C013-2-1,C035-2-1),PAS 染色试剂盒(Solarbio,G 1285)HE染色试剂盒(碧云天试剂有限公司,C0105),p-NFκB 抗体(Cell Signaling Technology,#3033),NF-κB抗 体(Cell Signaling Technology,# 8242),COX2(SantaCruz,sC-376861),IL-6(Abcam,ab9324)。
LightCycler®480 II 实 时荧 光定 量PCR 仪(Thermo Fisher,美国),光学显微镜(Olympus,日本),凝胶成像仪(Bio-rad,美国),Nano-Drop2000 Spectrophotometer(Thermo Fisher,美国)。
1.2 方法
1.2.1 动物分组及造模
C57BL/6 雄性小鼠适应性喂养1 周后,随机分成5 组,每组10 只。 正常组(NC)给予普通饲料;模型组(DN),黄芪三七合剂低剂量组(L-A&P)、高剂量组(H-A&P),厄贝沙坦(IRB)给予高脂高糖饲料喂养两个月后,禁食不禁水12 h 后,连续5 d 单次腹腔注射剂量为50 mg/kg 体重的STZ(柠檬酸缓冲液配置,pH 4.2 ~4.5),正常组注射等体积的柠檬酸缓冲液。 1 周后采尾静脉血测空腹血糖值,空腹血糖水平高于11.1 mmol/L,则视为糖尿病小鼠造模成功,3 周后收集24 h 尿液,24 h 尿蛋白含量大于30 mg,则视为糖尿病肾病造模成功[11-12]。 黄芪三七合剂低、高剂量组分别给予黄芪三七剂1820 mg/(kg·d)、7280 mg/(kg·d)灌胃,厄贝沙坦组给予厄贝沙坦20 mg/(kg·d)灌胃,正常组给予等体积生理盐水,持续1 个月。
1.2.2 观察指标及标本制备
给药期间每两周测定各组小鼠体重,计算出平均体重;将各组小鼠禁食不禁水12 h,尾静脉采血测定空腹血糖值。 治疗4 周后,处死小鼠,处死之前收集小鼠24 h 尿液。 1%戊巴比妥钠麻醉小鼠后心脏取血,快速剖取小鼠肾,去包膜,一半冻存于液氮,一半放于4%多聚甲醛固定用于石蜡包埋。
1.2.3 生化指标检测
各组小鼠心脏取血后,将收集的血液4℃过夜,3000 r/min 离心15 min 取上清,按照试剂盒说明书步骤测定血肌酐,血尿素氮。 收集各组小鼠24 h 尿标本,计算尿量,测定尿蛋白。
1.2.4 病理染色
按照常方法制备石蜡切片,65℃烤片1.5 h 后梯度脱蜡复水,HE、PAS 染色严格按照试剂盒说明操作;免疫组化检测IL-6、TNF-α 的表达:石蜡切片脱蜡复水后,抗原修复,封闭,一抗4℃过夜,酶标二抗37℃孵育1.5 h,上述步骤后均用PBS 洗3 × 5 min 次,DAB 显色20 s,苏木素复染20 s,自来水冲洗,100%乙醇脱水、透明、封片。
1.2.5 Western Blot
采用Western Blot 法检测NF-κB 通路相关指标(p-NF-κB/NF-κB,IL-6 和COX2)。 取小鼠肾组织0.025 g 加入裂解液碾碎冰上裂解30 min,离心后取上清用考马斯亮蓝法测定蛋白含量,将各组蛋白浓度总量调整为40 μg 后加入到10% SDS 聚丙烯酰胺凝胶中进行电泳,转膜至PVDF 膜后按1 ∶500 的稀释比例加入多克隆抗体p-NF-κB、NF-κB、IL-6 和COX2 于4℃孵育过夜,后加入HRP 偶联二抗常温孵育1 h。 加入ECL 显色,凝胶成像分析仪成像,结果以目标蛋白/内参相对灰度值表示。
1.2.6 Real-time PCR
取小鼠肾组织0.05 g,用总RNA 提取试剂盒提取RNA,Thermo Fisher NANODROP 2000 分光分度计上检测RNA 浓度,按照Go ScriptTMReverse Transcription System(A5001)说明书进行逆转录操作。 cDNA 合成反应体系为:RNA 2.5 μg,Primer Oligo(dT) 1 μL,Random Primer 1 μL,Nuclease-Free Water 定容到5 μL,混匀离心,70℃5 min,冰浴5 min,离心10 s;之后按照说明书制备逆转录反应体系:5 × Reaction Buffer 4 μL,PCR Nucleotide Mix 1 μL,Go ScriptTMReverse Transcriptase 1 μL,MgCl2(Final concentration 2.5 mM) 1 μL,Nuclease-Free Water 8 μL,轻打混匀。 将cDNA 5 μL 和逆转录体系15 μL 混合,离心后25℃5 min,4℃1 h,70℃15 min,反应完毕加入80 μL Nuclease-Free Water 稀释样品,-20℃保存备用。 LightCycler®480 II 上检测Arid2-IR、TNF-α、MCP-1 和IL-1β 的表达量,引物信息如表1,检测到的基因相对水平用β-actin 正常化。
1.3 统计学分析
采用SPSS 21.0 对数据进行统计分析,计量资料用平均值±标准差(±s) 表示,两组间比较用t检验,多组间用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05 为差异具有统计学意义。
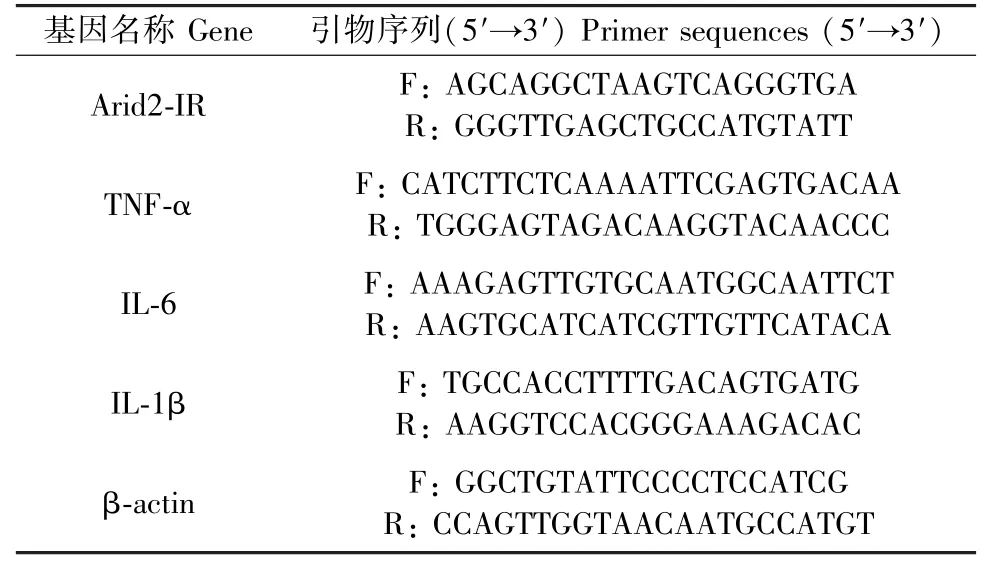
表1 实时荧光定量PCR 的引物序列Table 1 Primer sequences of Real-time PCR
2 结果
2.1 黄芪三七合剂对DN 小鼠体重和空腹血糖的影响
给药期间,每两周测定各组小鼠体重和空腹血糖值。 4 周后,与NC 组相比,DN 组的体重和空腹血糖值明显升高,差异具有显著性(P<0.01),黄芪三七合剂治疗后,可显著改善DN 各组小鼠的体重和空腹血糖值,其中尤以A&P 高剂量组和厄贝沙坦组效果最为明显,差有显著性(P<0.01)(图1)。
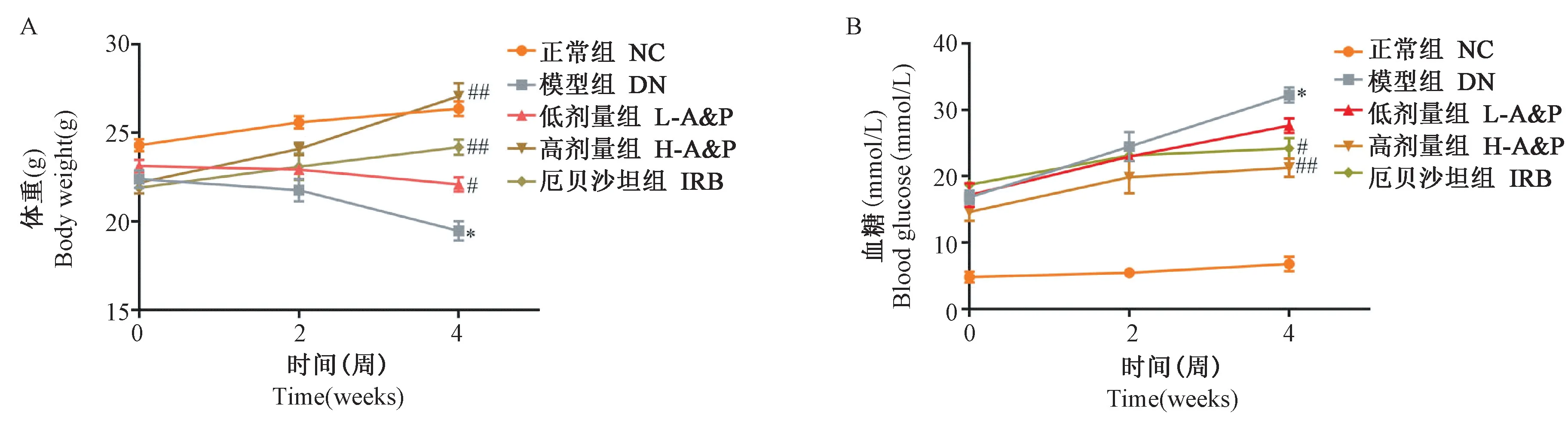
图1 黄芪三七合剂对DN 小鼠体重(A)和空腹血糖(B)的影响Note. Compared with NC group,*P<0.01. Compared with DN group,#P<0.05,##P<0.05.(the same in the following Figures)Figure 1 Effect of Astragalus propinquus Schischkin and Panax notoginseng (A&P)compound on body weight (A) and fasting blood glucose (B) in DN mice
2.2 黄芪三七合剂对DN 小鼠生化指标的影响
生化指标检测结果显示,与NC 组相比,DN 组能显著增加24 h 尿蛋白、血清肌酐和血尿素氮水平(P<0.01),A&P 治疗后低剂量组仅表现为24 h 尿蛋白的差异具有显著性(P<0.05),A&P 高剂量和厄贝沙坦组则可显著下调24 h 尿蛋白、血清肌酐和血尿素氮表达,差异具有显著性(P<0.01),表明黄芪三七合剂可有效改善DN 小鼠的肾功能(图2)。
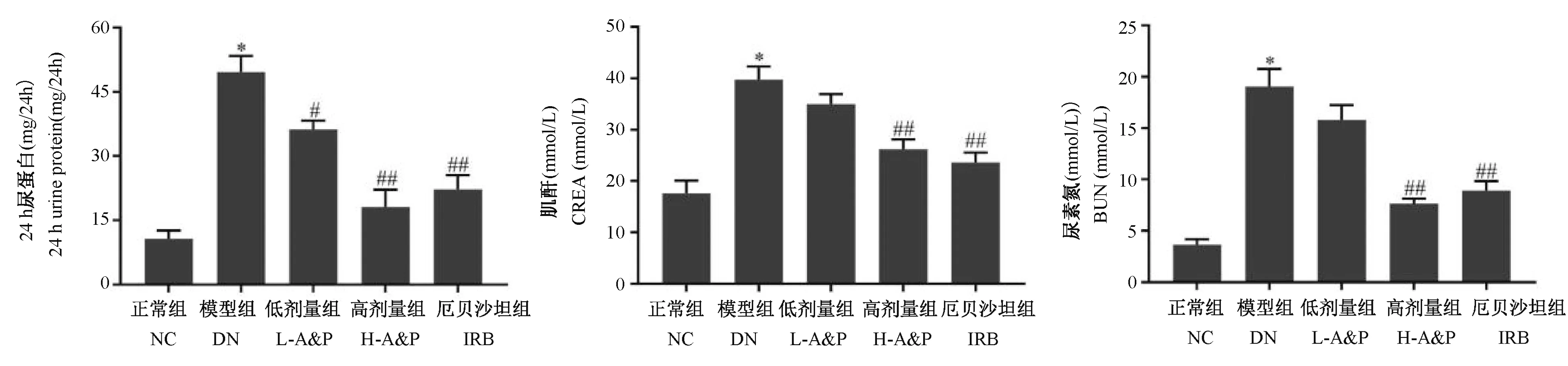
图2 黄芪三七合剂对DN 小鼠生化指标的影响Figure 2 Effect of Astragalus propinquus Schischkin and Panax notoginseng (A&P)compound on biochemical Indicators in DN mice
2.3 黄芪三七合剂改善DN 小鼠肾病理结构
如图3 所示,DN 模型组的HE 染色结果显示,肾小球肥大,系膜区基质增生明显,基底膜增厚,肾小管上皮细胞水肿,破裂;PAS 染色结果显示,肾小球基质明显增多,糖原空泡和粘液增加。 治疗后,肾病理结构明显好转,并呈现一定剂量依赖性。
2.4 黄芪三七合剂对DN 小鼠炎症指标的影响
与正常组相比,DN 模型组IL-1β 和TNF-α mRNA 表达量明显升高,差异具有显著性(P<0.01),经A&P 治疗后,低剂量组对IL-1β 的影响变化不明显,差异不具有显著性(P>0.05),A&P 高剂量和厄贝沙坦组均可显著下调IL-1β、TNF-α 等炎症指标,差异具有显著性(P<0.01),免疫组化结果与基因水平的表达变化一致。 (图4)
2.5 黄芪三七合剂对DN 小鼠Arid2-IR 和p-NFκB 及相关蛋白表达的影响
Real-time PCR 结果显示,DN 组肾组织Arid2-IR 表达较NC 组显著升高(P<0.01),治疗之后在各组的表达均明显下调,差异具有显著性(P<0.05)。 而p-NF-κB、IL-6 及COX2 在DN 肾组织中出现明显升高,差异具有显著性(P<0.01),治疗后的上述蛋白表达呈剂量依赖性降低,其中尤以A&P 高剂量治疗组变化最为显著(P<0.01)。
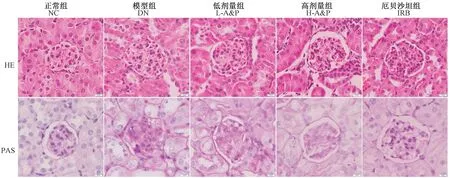
图3 图3 黄芪三七合剂改善DN 小鼠肾病理结构(×200)Figure 3 Effect of Astragalus propinquus Schischkin and Panax notoginseng (A&P)compound on renal morphology in DN mice(×200)

图4 黄芪三七合剂对DN 小鼠炎症指标的影响Note. A,PCR results. B,Immunohistochemical results(× 200).Figure 4 Effect of Astragalus propinquus Schischkin and Panax notoginseng (A&P)compound on inflammatory indicators in DN mice
3 讨论
现代医学研究认为糖尿病发病主要与糖脂代谢异常、氧化应激、炎症反应、血液微循环障碍等多种因素有关。 近年来随着研究技术的不断进步,长链非编码RNA(lncRNA)的生物学功能逐渐被发现,因其在人类各种疾病中的普遍存在而受到广泛关注。 LncRNA 是一种转录本大于200 核苷酸、缺乏蛋白编码能力并在基因组中广泛转录的新型非编码RNA,在遗传表观、细胞分化和细胞周期调控等生命活动中发挥重要作用[13-14]。 最近有研究报道,高表达的lncRNA 参与了心血管疾病、癌症和内分泌疾病等的发生发展。 尤为重要的是,lncRNA 在糖尿病肾病的炎症反应中发挥了关键作用,可能提高了糖尿病肾病进展为终末期肾病的几率[4,15]。Yi 等[4]发现lncRNA Gm4419 敲低改善了糖尿病肾病中NF-κB/NLRP3 炎性体介导的炎症;Zha 等[6]发现lncRNA MEG3 通过miR-181a/EgR-1/TLR4 轴促进糖尿病肾病纤维化和炎症反应;此外,Zhang 等[5]研究报道lncRNA Rpph1 通过与GaL-3 的相互作用促进糖尿病肾病系膜细胞的炎症和增殖。 这些lncRNA 的发现为糖尿病肾病的发病机制和干预研究提供了新的思路。

图5 黄芪三七合剂对DN 小鼠Arid2-IR 和p-NF-κB 及相关蛋白表达的影响Notes. A. PCR results of Arid2-IR. B. Western Blot results of p-NF-κB,IL-6 and COX2. C,D,E. Relative content of p-NF-κB,IL-6 and COX2.Figure 5 Effect of Astragalus propinquus Schischkin and Panax notoginseng (A&P)compound on the expression of Arid2-IR,p-NF-κB and related protein in DN mice
lncRNA Arid2-IR 是2015 年首次发现于UUO小鼠肾进展性肾纤维化和炎症反应中高表达的一种lncRNA。 研究显示,Smad3 可能通过激活Arid2-IR-NF-κB 依赖性机制来调节肾的炎症反应[7];下调Arid2-IR 表达可抑制NF-κB 信号传导,减缓肾炎症反应[7]提示Arid2-IR 对NF-κB 信号通路可能具有正向调控作用。 我们在糖尿病小鼠模型中发现,肾组织中Arid2-IR 表达显著上调,与Yang 等[8]的研究结果相似。 而在糖尿病肾病发病进程中,由于糖代谢紊乱等多种因素激活NF-κB 信号通路,激活的NF-κB 易位发生核转位,调控多种因子转录,进而产生多种趋化因子和炎性因子,促进炎症反应的发生,致使通路下游相关蛋白上调,IL-1β,IL-6 和TNF-α 等炎症指标表达升高。 核因子NF-κB 在糖尿病肾病的炎症机制中起着至关重要的作用[16-18]。那么,在糖尿病肾病中lncRNA Arid2-IR 是否通过调控NF-κB 介导了肾的炎症反应? 为了验证这个假设,随后我们检测了p-NF-κB 及其下游调控蛋白IL-6 和COX2 和炎症指标IL-1β,IL-6 和TNF-α 的表达,在实验中观察到糖尿病肾病小鼠“三多一少”症状明显,结果显示NF-κB 信号通路被激活,炎症反应明显,表明lncRNA Arid2-IR 可能通过激活NF-κB介导了糖尿病肾病的炎症反应。 提示:Arid2-IR 在肾炎症中发挥重要的功能作用,可能作为炎性肾疾病的一个新的治疗靶点。
中医认为糖尿病属于“消渴”,“水肿”,“尿浊”的范畴,“血瘀”“痰湿”为其主要的病理产物。 其发病机制为初期燥热下消,气阴两虚,久而累及肾,致肾体劳衰,精微下泄[19-20]。 中药治疗糖尿病肾病宜标本兼顾,滋阴补肾以治本,活血利水以治标。 黄芪三七合剂,以益气补肾、健脾活血的黄芪、三七为君药,活血化瘀、软坚散结的当归、昆布为臣药,加上怀牛膝作为使药,引经报使,引血下行,引药入肾[21-22]。 该复方在临床上用于治疗CKD 等效果显著,且有一定的研究基础,其机制可能与改善结肠机械屏障功能紊乱和炎症反应,恢复受损的肾功能,延缓疾病进程有关[9,23]。 那么黄芪三七合剂对糖尿病肾病的改善作用是否与影响Arid2-IR 有关?为此我们将黄芪三七合剂进一步用于糖尿病肾病小鼠模型,值得注意的是,经治疗四周后,可观察到DN 小鼠的体重、空腹血糖值、生化指标、炎症因子的表达和病理损伤都得到了明显改善,同时lncRNA Arid2-IR 表达下调,NF-κB 活性受到抑制,其下游调控蛋白IL-6 和COX2 均出现下调,表明黄芪三七合剂可通过下调lncRNA Arid2-IR 表达、抑制了Arid2-IR/NF-κB 介导的炎症反应。
综上所述,黄芪三七合剂可通过调节Arid2-IR/NF-κB 信号轴减轻糖尿病肾病的炎症反应,从而使糖尿病肾病受损的肾功能得到改善,延缓了疾病病理生理进程,这可能是黄芪三七合剂保护DN 的一个新机制。 但黄芪三七合剂通过Arid2-IR/NF-κB信号轴调控肾炎症的具体机制还需在细胞水平上进一步验证。 我们的结果为Arid2-IR 作为治疗糖尿病肾病的一个新靶点提供了研究思路,并为指导黄芪三七合剂的临床应用提供了新见解。
