盐酸洛哌丁胺诱导的小鼠慢传输型便秘模型的实验研究
2020-07-08姚一博王迪王钱陶肖长芳梁宏涛曹永清陆金根王琛
姚一博,王迪,王钱陶,肖长芳,梁宏涛,曹永清,陆金根,王琛
(上海中医药大学附属龙华医院肛肠科,上海 200032)
慢性传输型便秘是一种以肠道内粪便的传输过程缓慢为主要特点的功能性疾病,常常表现为大便干结、排便次数减少、排便敏感性下降并伴随有腹痛、腹胀等症状[1]。 据最新流行病学数据显示,全球的发病率为14%,其中成年人慢性便秘的患病率在2.5% ~79%之间[1-2]。 在美国,每年有310 万便秘患者就诊,造成了沉重的社会、经济负担[3-4];而在中国,慢性传输型便秘也是一个常见疾病,并可严重影响成年人生活质量[5]。 近年来,慢传输型便秘的发病率逐渐增高,严重的威胁人类的健康和生活质量[6-7]。 因此,慢传输型便秘临床治疗和机制的研究刻不容缓。
动物模型在慢传输型便秘机制研究中扮演重要的角色,不同的研究目的对于造模动物的选择、造模方法都各不相同。 因此,建立与人便秘有共同的病理生理变化的动物实验模型对于探索便秘的发病机制、新的治疗途径都有着重要意义[8]。 药物造模是慢传输型便秘造模的主要方式,常用的药物有盐酸洛哌丁胺(Loperamide hydrochloride)[9]。 盐酸洛哌丁胺是一种外周性阿片受体激动剂[10],机制是抑制肠道水分泌和结肠蠕动,延迟粪便疏散时间和肠腔运输,通过减少动物的粪便颗粒数量,重量和含水量而出现便秘症状[9-11]。 然而,造模药物的剂量、造模时间的差别会直接影响模型成功率[12]。因此,本研究重点探讨造模药物盐酸洛哌丁胺不同剂量、不同给药时间对于慢传输型便秘小鼠动物模型的影响,探索建立稳定的洛哌丁胺诱导的慢传输小鼠便秘模型各项实验参数。
1 材料与方法
1.1 材料
1.1.1 实验动物
6 ~8 周SPF 级健康雄性C57BL/6 小鼠72 只,体重(25 ± 5)g,购自上海斯莱克实验动物有限责任公司【SCXK(沪)2018-0003】。 动物饲养于上海中医药大学动物实验室【SYXK(沪)2014-0008】。 饲养期间各组小鼠自由饮水,饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22 ~25℃。 所有操作均符合上海中医药大学实验伦理学要求(审批号:IACUC PZSHUTCM200104005)。
1.1.2 实验试剂
盐酸洛哌丁胺 (Loperamide HCl) 50 mg(SELLECK,S2480);印度墨水(源叶生物科技科技有限公司,S30881)。
1.2 方法
1.2.1 药物制备
盐酸洛哌丁胺选取0.5 mg/kg、5 mg/kg 和50 mg/kg 三个剂量,使用无菌性生理盐水配制药物浓度分别0.025 mg/mL、0.25 mg/mL 和2.5 mg/mL 的盐酸洛哌丁胺混悬液。
1.2.2 造模方法
配制盐酸洛哌丁胺溶液对小鼠进行灌胃,给药时间为每日上午9 时和下午3 时分两次给药,给药体积为每10 g 小鼠体重0.2 mL。
1.2.3 肠道推进率检测
造模完成后,小鼠禁食过夜以排空肠内容物。至第2 天上午开始进行小鼠肠道推进率检测。 具体方法为:每只小鼠经口灌0.2 mL 印度墨水,20 min后脱颈椎处死。 迅速打开小鼠腹腔,取出自幽门至肛门的全肠道,无张力拉直后测量肠道全长L1;然后再测量墨汁在肠道内的行进长度L2,计算小鼠肠道推进率D=L2/L1×100%。
1.2.4 排便量检测
每日上午给药后,更换新笼盒,至下午给药之前,收集小鼠两次给药间期的粪便,并称重、记录粪便湿重W1,以比较组间排便量差异;然后将各组小鼠的粪便放入鼓风机内进行高温烘干、脱水。 鼓风机设置为100℃,连续烘干2 h,再次进行称重,记录干重W2;计算小鼠的粪便含水率R=(W1-W2)/W1×100%。
1.3 统计学分析
计量资料数据均以平均值±标准差(±s)表示。 研究数据采用SPSS 22.0 统计软件进行处理与分析,多组间比较采用单因素方差分析(One-way ANOVA),两组间样本均数多重比较,若方差齐采用LSD,若方差不齐采用Games-Howell 检验。 以P<0.05 表示差异具有显著性。
2 结果
2.1 造模动物的一般情况
造模大鼠出现活动减少和毛发光泽减退现象,体质量增长慢于对照组,饮水量正常,部分出现进食和尿量减少。
2.2 不同盐酸洛哌丁胺给药剂量对于小鼠便秘慢传输型便秘模型的影响
每组8 只小鼠,按照盐酸洛哌丁胺的不同给药剂量及浓度梯度,分为四组空白组、低剂量组0.5 mg/kg、中剂量组5 mg/kg、高剂量组50 mg/kg;为避免灌胃剂量过大,按照给药体积为每10 g 小鼠体重灌胃0.2 mL 进行给药,每日上午9 时和下午3 时进行给药,给药时间15 d。 通过比较组间肠道推进率的方法验证造模结果,结果表明50 mg/kg 组小鼠肠道推进率与空白组相比显著降低,差异具有显著性(P<0.05)。 (图1)
2.3 不同造模天数对小鼠肠道推进率以及排便量变化
每组8 只小鼠,采用前期试验中验证的最有效剂量是50 mg/kg,药物配制方法同上;给药体积0.2 mL/10 g,给药时间为上午9 时,下午3 时;将造模天数分为3 d 组、7 d 组、10 d 组和14 d 组。 如图2 所示,小鼠肠道推进率检测,造模第7 天时,小鼠的肠道推进率与空白组相比明显降低(P<0.05);而造模3、10、14 d 肠道推进率与空白组相比,差异均无显著性(P>0.05)。
如图3 所示,观察收集小鼠的粪便称重,监测小鼠每天的排便量变化,各模型组小鼠随着给药天数的不断增加,排便量呈现先减少而后再增加的趋势。 造模3、7、10、14 d 后,小鼠排便量与空白组相比,差异均具有显著性(P<0.05)。
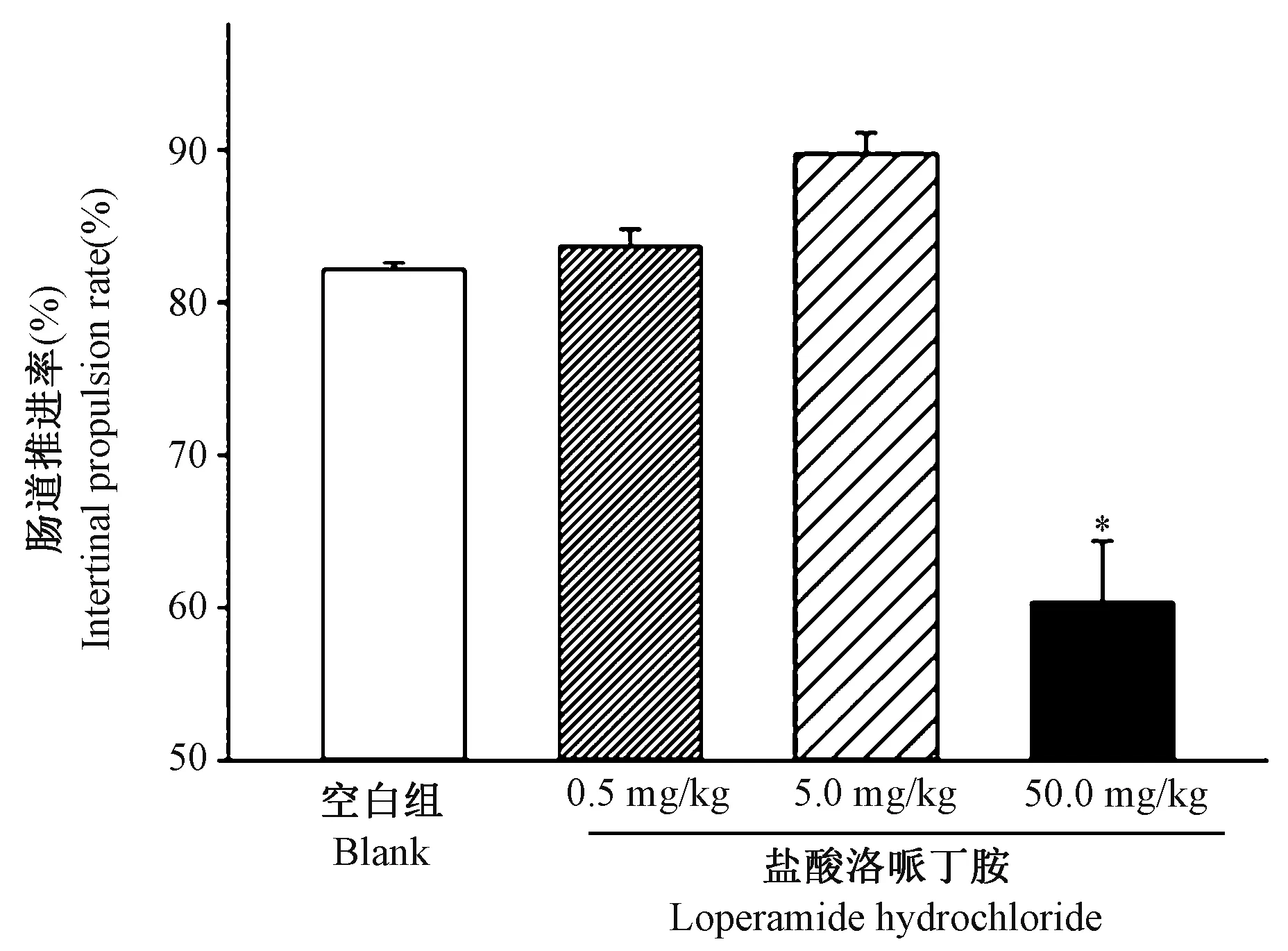
图1 不同剂量盐酸洛哌丁胺对小鼠肠道推进率的影响Note. There was significant difference in intestinal propulsion rate between 50 mg/kg group and blank group,*P<0.05.Figure 1 Effects of different doses of loperamide hydrochloride on intestinal propulsive rate in mice
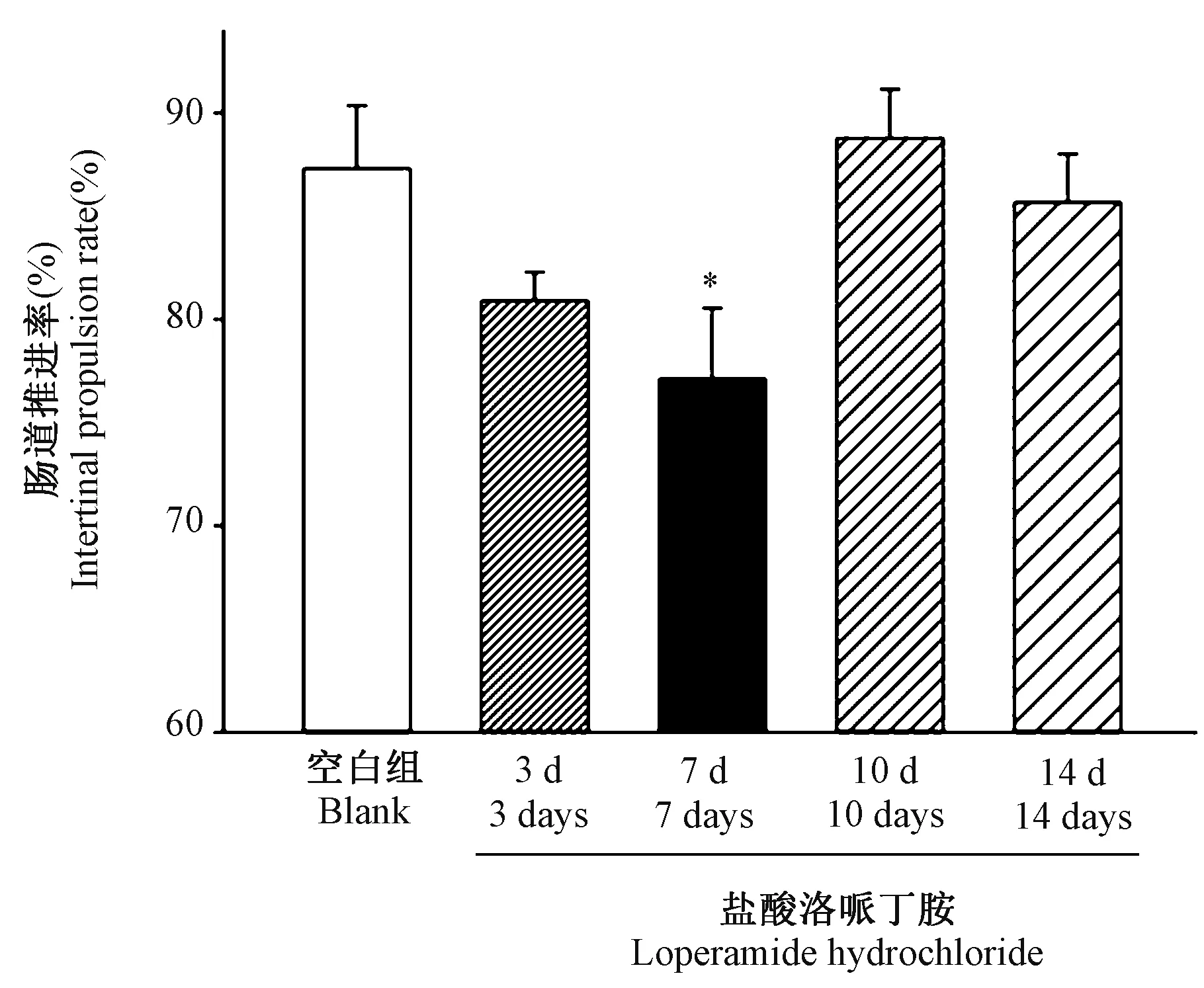
图2 盐酸洛哌丁胺不同造模时间对小鼠肠道推进率影响Note. The effect of loperamide hydrochloride on intestinal propulsive rate was significantly different from that of the blank group,*P<0.05.Figure 2 Effects of loperamide hydrochloride on intestinal propulsive rate in mice with different modeling time
3 讨论
本文通过盐酸洛哌丁胺诱导小鼠慢传输型便秘模型,观察不同剂量、不同给药时间对于小鼠便秘模型的影响。 盐酸洛哌丁胺是一种外周性阿片受体激动剂,已广泛用于建立便秘动物模型[13-17]。主要通过作用于肠道纵行肌层的肌间神经丛来降低肠道的推动作用[18-19],或者通过刺激吸收和钙调素拮抗介导的抗分泌作用来调节水和电解质的肠道运输[20-22],也可在肌间神经丛水平作用于阿片受体,从而降低肠蠕动[23]。 盐酸洛哌丁胺减少了便秘动物的摄水量,减少粪粒含水量,但不会影响动物的摄食,符合人类便秘的临床表现[18,24]。 其药理学机制提示,在肠道中它具有通过阿片受体和非阿片受体机制介导的抗分泌作用和影响肠动力的作用。在较高剂量下,通过肠肌间神经丛中的阿片受体介导而降低肠动力。 说明可能存在两种机制:低剂量可发挥抗分泌作用,高剂量可发挥影响肠动力的作用[19]。 总之,盐酸洛哌丁胺复杂的剂量差异性药理学机制,提示小鼠便秘模型的建立,更加需要注意给药剂量和时间。 因此确定盐酸洛哌丁胺的最有效造模剂量,诱导建立稳定、可以重复的慢传输型便秘模型,已成为实验研究体系不可缺少的一部分。
便秘模型建立中,盐酸洛哌丁胺给药的剂量不尽相同,文献报道药物剂量范围从2.1 mg ~20 mg/kg不等[20-22,25]。 如采用4 mg/kg 连续给药3 d,停药3 d 后,继续不同浓度4 mg/kg 和8 mg/kg 连续给药4 d,建立了稳定的便秘模型,并发现模型动物组织PKC 磷酸化表达存在差异[20];如果造模采用9.38 mg/kg 给药,并且首次给药剂量翻倍,连续给药10 d,模型小鼠出现结肠粘膜层变薄,远端结肠杯状细胞体积变小等细胞形态变化[26-27]。 本研究对比同样的给药模式不同剂量的盐酸洛哌丁胺造模的效果,在0.5 ~50 mg/kg 的剂量浓度范围内,选择0.5 mg/kg、5.0 mg/kg、50 mg/kg 三个不同的给药浓度,检测给药后肠道推进率、排便量及粪便含水率三个指标,观察不同浓度的盐酸洛哌丁胺对于肠道推进率的影响。 研究发现:在0.5 ~50 mg/kg 的给药浓度范围内,通过比较组间肠道推进率,50 mg/kg 组与空白组相比,小鼠肠道推进率显著降低、排便量明显减少,差异具有统计学意义(P<0.05)。 本次研究中粪便的含水率与正常组相比,差异无统计学意义(P>0.05)。 由于小鼠有随时排便的习性,粪便含水量易受多种因素影响[28]。 同时观察不同浓度给药后小鼠状态和耐受性,造模过程中过程中并未发现小鼠出现体重下降、精神不济甚至死亡的现象。 本次研究认为50 mg/kg 的剂量是能够造模成功的最大稳定剂量。
不同的给药时间在小鼠慢传输型便秘模型的造模中也是重要的影响因素之一,文献报道关于造模天数从3 ~42 d 不等[25-27,29-32]。 采用盐酸洛哌丁胺造模后第5 天,发现模型组小鼠粪便含水量下降,小肠推进率降低,结肠组织中SP、5-HT 减少[17]。而连续给药后第10 天,停药后再连续观察7 d,发现模型组小鼠远端结肠HE 染色提示肠粘膜层变薄、肠内细胞形态与空白组相比变得小而细长,口肛传输时间延长等变化[26]。 而在模拟体虚便秘模型造模中采用盐酸洛哌丁胺10 mg/kg 连续给药42 d,发现与正常对照组比较,模型组近端和远端结肠AQP2 的表达水平增加,这一结果可能使结肠水分重吸收增多而黏液分泌减少而导致肠动力下降[32]。上述结果共同提示采用盐酸洛哌丁胺建立小鼠便秘模型,造模时间以及观察时间也是决定模型是否成功的关键因素。
本研究我们在3 ~14 d 的时间范围内,设立了3、7、10 和14 d 四个不同的时间点,对造模时间进行了横向对比。 造模第7 天时,小鼠的肠道推进率与空白组相比明显降低(P<0.05);而3、10、14 d肠道推进率相比无明显变化(P>0.05)。 研究发现随着给药时间的延长,盐酸洛哌丁胺对于小鼠肠道的抑制作用反而减弱甚至消失,盐酸洛哌丁胺给药10 d以上,小鼠的肠道推动功能与空白组相比,无明显统计学差异(P>0.05)。 盐酸洛哌丁胺对小鼠肠道推动功能的抑制也未呈现时间依赖关系。 对比不同给药时间和给药剂量对小鼠的肠道推动力发现,盐酸洛哌丁胺对小鼠肠道的抑制功能与时间和剂量均不成正相关。 盐酸洛哌丁胺作为阿片受体激动剂长时间使用存在耐药可能[33]。 文献报道盐酸洛哌丁胺随着给药剂量的增加(0.1 ~30 mg/kg),小鼠肠道推进率不断下降;给药1 ~2 d 小鼠肠道推进率下降30%,给药第3 天肠道推进率开始恢复到60%,提示连续给药大于3 d,盐酸洛哌丁胺对于肠道传输功能的抑制作用减弱[34-36]。 同样在预初实验中,我们发现小鼠排便量随着给药时间延长7、14、25 d,小鼠的排便量无明显统计学差异(P>0.05)。 实验中采用盐酸洛哌丁胺50 mg/kg 浓度制备小鼠便秘模型,连续给药小于7 d,肠道推进率显著降低82%、77%;继续给药10、14 d)肠道推进率逐渐恢复到88%、86%。 依据文献数据及上述情况,我们推测盐酸洛哌丁胺药物作用可能存在效应平台期,给药时间大于7 d,对肠道推进功能的抑制作用减弱。
综上,本研究采用50 mg/kg 剂量连续灌胃7 d,可使小鼠的肠道推进率显著降低,排便量明显减少,能够制造相对稳定的结肠传输障碍型便秘小鼠模型。 实验中未见小鼠出现体重下降等异常现象,进一步为盐酸洛哌丁胺诱导慢传输型便秘模型的探索提供有价值的实验数据。
