长期稳定的SD 大鼠2 型糖尿病模型制备方法
2020-07-08黎娅范培云马晓雨常秀君何敏韩蕙竹粟尹夏晓晓韦秀萍吴穹
黎娅,范培云,马晓雨,常秀君,何敏,韩蕙竹,粟尹,夏晓晓,韦秀萍,吴穹*
(1. 青海大学附属医院,西宁 810001; 2. 青海省人民医院内分泌2 科,西宁 810007; 3. 青海大学医学院,西宁 810001; 4. 西华师范大学生命科学学院,四川 南充 637002)
糖尿病的流行,已成为世界范围内的严重公共卫生问题。 国际糖尿病联盟(IDF)预测到2045 年全球糖尿病患者将达6.93 亿[1]。 2 型糖尿病作为糖尿病的一个庞大分支,约占糖尿病总数90%[2]。因此,临床相关的实验动物模型建立,对2 型糖尿病研究具有重要意义。 研究表明,高脂饮食(high fat diet,HFD)联合小剂量链脲佐菌素(streptozotocin,STZ)制备的2 型糖尿病大鼠模型能够较好地模拟人类2 型糖尿病发病过程[3-4]。 但这一造模方法尚无统一的标准,各研究中所用的高脂饲料种类、喂养时间、STZ 剂量及注射方式并不完全一致。 本实验通过HFD 联合小剂量STZ 建立2 型糖尿病大鼠模型,并进一步观察模型的稳定性及相关指标变化,旨在构建一种理想的2 型糖尿病动物模型。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF 级雄性Sprague Dawley(SD)大鼠30 只,4周龄,体重80 ~100 g,购于西安交通大学医学部实验动物中心,许可证号【SCXK(陕)2017-003】。 两只每笼喂养,室温(22 ± 2)℃,相对湿度65% ~75%,每天12 h 光照,12 h 黑暗循环,自由饮水、摄食,动物饲养于青海大学医学院实验动物房【SYXK(青)2019-0001】,并由青海大学伦理委员会开具了小动物实验的伦理证明及允许使用证明。
1.1.2 仪器与试剂
STZ(Sigma 公司,美国);柠檬酸钠无菌缓冲液(Solarbio 公司,北京);门冬胰岛素注射液(Novo Nordisk,丹麦)、50%葡萄糖溶液(青海省人民医院,青海);卓越金采血糖仪及试纸(Roche 公司,美国)。 高脂饲料(基础饲料上加10%蔗糖、10%猪油、1%胆固醇、0.3%胆酸钠)。 STZ 溶液配制方法:将STZ 溶解于0.1 mol/L(pH 4.5)柠檬酸钠无菌缓冲液,配制成2%的STZ 溶液。 由于STZ 溶液不稳定,需现配现用,配制好的溶液避光冰浴,30 min 内注射完毕。
1.2 方法
1.2.1 2 型糖尿病动物模型建立
大鼠适应环境72 h 后按体重随机分为2 组:正常对照组(NG)10 只、2 型糖尿病组(DM)20 只。NG 组给予普通饲料喂养,DM 组给予高脂饲料喂养。 喂养12 周后,DM 组给予新鲜配制2%STZ 溶液尾静脉注射25 mg/kg,正常对照组给予等剂量柠檬酸钠无菌缓冲液尾静脉注射,注射后3 d、7 d 取尾静脉血测血糖,以7 d 血糖水平≥16.7 mmol/L 为成模标准。
1.2.2 大鼠的一般情况
每天观察大鼠的精神状况、毛发光泽、垫料潮湿程度,记录大鼠的进食量、饮水量。 每周称取大鼠体重,于实验开始、高脂第12 周、以及造模成功后每周测量血糖。
1.2.3 口服糖耐量(OGTT)及胰岛素耐量试验(IPITT)
各组大鼠喂养第12 周,进行OGTT 及IPITT 试验。 在OGTT 试验中,大鼠禁食12 h 后,灌胃给予50%的葡萄糖溶液2 g/kg,尾静脉检测0 min 及葡萄糖灌胃后30、60、90、120 min 的血糖,并计算曲线下面积(AUC)[5]。间隔48 h 后,进行IPITT 试验,大鼠禁食6 h,于腹腔注射0.5 u/kg 的门冬胰岛素溶液,尾静脉检测0 min 及注射后15、30、60、90、120 min的血糖,并计算曲线下面积(AUC)[5]。
1.2.4 果糖胺测定
实验第20 周,所有大鼠隔夜禁食12 h,称取体重后,麻醉大鼠,腹主动脉取血送检,于青海省人民医院检测大鼠血清果糖胺(fructosamine,FRA)水平。
1.3 统计学分析
采用SPSS25.0 和Prism 7 图像分析统计软件进行统计分析。 计量资料以平均值±标准差(±s)表示,两组间两两比较采用独立样本t检验,检验水平α=0.05。
2 结果
2.1 一般情况观察结果
两组大鼠在STZ 干预前摄食、饮水、尿量无统计学差异(P>0.05)。 STZ 干预后,NG 组大鼠精神状况良好,反应灵敏,动作自如,双目有神,毛发平伏有光泽,垫料干燥,进食量、饮水量较前无明显变化。 DM 组大鼠精神萎靡,反应迟钝,毛竖无光泽,倦怠懒动,垫料潮湿,进食量、饮水量显著增加(P<0.05),见表1。
2.2 体重变化
STZ 干预前,两组大鼠体重随周龄增加而增加,DM 组体重增幅略高于NG 组,但差异无统计学意义,在12 周末DM 组显著高于NG 组(P<0.05)(图1A)。 STZ 干预后DM 组体重呈下降趋势,差异具有显著性(P<0.05),但从第6 周开始,下降幅度逐渐减小;而NG 组体重随着周龄仍然逐渐增加,但增幅较之前有所下降(图1B)。
2.3 OGTT 及IPITT
如图2A 所示,OGTT 试验表明,给予葡萄糖负荷后,NG 组30 min 后血糖升至最高,而DM 组血糖高峰延迟至60 min,且葡萄糖清除率总体上出现延迟,在60、90、120 min 血糖明显高于NG 组(P<0.05);DM 组曲线下面积增大,差异具有显著性(P<0.05)。 相应的,IPITT 试验表明(图2B),注射胰岛素两组大鼠血糖在15 min 及30 min 快速下降,于60 min 后血糖达到最低点,但DM 组血糖总体仍高于NG 组(P<0.05);DM 组曲线下面积增大,差异具有显著性(P<0.05),提示DM 组大鼠的胰岛素敏感性下降。 这些结果都反应了DM 大鼠存在胰岛素抵抗。
表1 大鼠24 h 摄食量及饮水量比较(±s)Table 1 Comparison of 24 h food intake and water consumption of rats(±s)
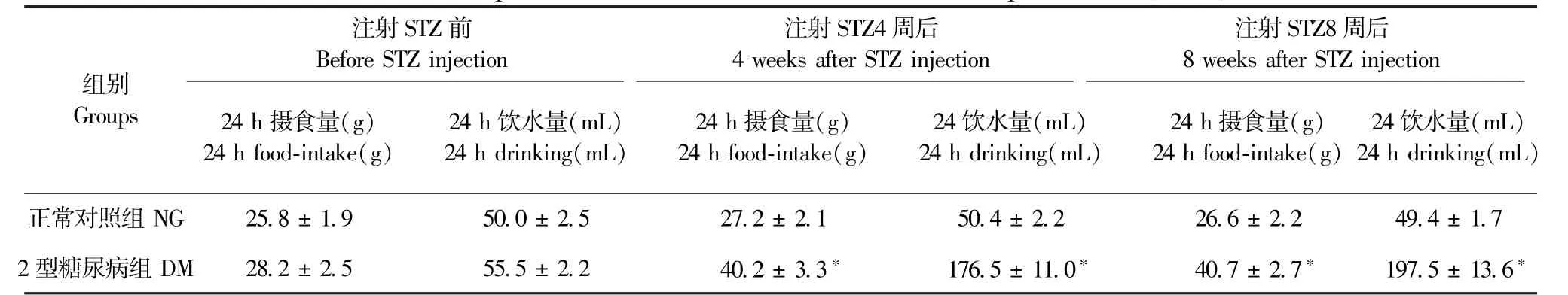
表1 大鼠24 h 摄食量及饮水量比较(±s)Table 1 Comparison of 24 h food intake and water consumption of rats(±s)
注:与NG 组比较,*P<0.05。 (下图同)Note. Compared with NG group,*P<0.05.(The same in the following Figures)
注射STZ 前Before STZ injection注射STZ4 周后4 weeks after STZ injection注射STZ8 周后8 weeks after STZ injection组别Groups 24 h 摄食量(g)24 h food-intake(g)24 h 饮水量(mL)24 h drinking(mL)24 h 摄食量(g)24 h food-intake(g)24 饮水量(mL)24 h drinking(mL)24 h 摄食量(g)24 h food-intake(g)24 饮水量(mL)24 h drinking(mL)正常对照组NG 25.8 ± 1.9 50.0 ± 2.5 27.2 ± 2.1 50.4 ± 2.2 26.6 ± 2.2 49.4 ± 1.7 2 型糖尿病组DM 28.2 ± 2.5 55.5 ± 2.2 40.2 ± 3.3* 176.5 ± 11.0* 40.7 ± 2.7* 197.5 ± 13.6*
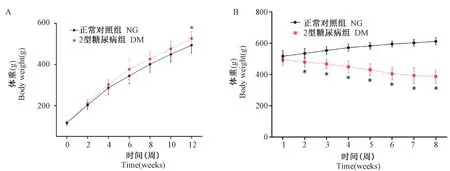
图1 STZ 干预前(A)与STZ 干预后(B)两组体重变化比较(±s)Figure 1 Comparison of changes in body weight between the two groups before STZ intervention (A) and after STZ intervention (B)(±s)
2.4 随机血糖及果糖胺水平
两组大鼠在STZ 干预前随机血糖差异无统计学意义(P>0.05)。 STZ 干预后1~8 周,DM 组血糖明显高于NG 组(P<0.05),并于STZ 注射3 周末逐渐趋于稳定(图3A)。 如图3B 所示,与NG 组比较,DM 组果糖胺含量明显升高(P<0.05)。
2.5 成膜率与死亡率
在给予STZ 第2 周,DM 组均出现明显的“三多一少” 症状,随机血糖≥16.7 mmol/L,成模率100%。 在给予STZ 第8 周,不给于任何降糖治疗情况下,DM 组死亡5 只,死亡率25%。
3 讨论
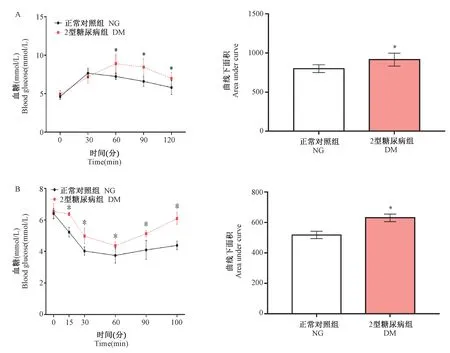
图2 两组糖耐量试验(A)与胰岛素耐量试验(B)比较(±s)Figure 2 Comparison of OGTT (A) and IPITT (B) between the two groups(±s)
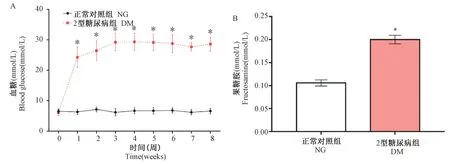
图3 两组随机血糖(A)及果糖胺(B)比较(±s)Figure 3 Comparison of random blood glucose and fructosamine between the two groups(±s)
2 型糖尿病是一种复杂的慢性代谢性疾病,以高血糖、胰岛素抵抗(insulin resistance,IR)和胰岛素缺乏为主要特征。 IR 是2 型糖尿病发生发展的重要病理生理基础,存在IR 的患者往往在患病的初期会经历糖尿病和正常血糖之间的一种特殊代谢状态,包括糖耐量减低和(或)空腹血糖调节受损[6],临床上称为糖尿病前期。 研究表明高脂饮食能够降低实验动物的胰岛素敏感性,诱发胰岛素抵抗[7-8],是建立2 型糖尿病模型的重要依据。 不足的是,在出现明显的高血糖症状前,这种模型需要长期的高脂喂养方案,增加了实验的耗时及经费。使用STZ 很好地克服了这一障碍,在HFD 诱导IR之后,注射小剂量STZ 导致胰岛β 细胞功能障碍,实现了从IR 向2 型糖尿病非常快速和非常自然的过度。 在2 型糖尿病早期患者中,β 细胞功能丧失仅为24%,而在2 型糖尿病晚期,β 细胞质量减少了54%[2]。 STZ 的剂量对大鼠β 细胞残存功能有较大的影响,大剂量STZ 诱导更类似于1 型糖尿病的代谢特征,表现为胰岛素分泌严重不足,低剂量STZ可能又无法充分诱导2 型糖尿病。 较低剂量的STZ能够更好地模拟2 型糖尿病中β 细胞功能的部分丧失[2]。 Mansor 等[9]研究表明高脂喂养2 周联合STZ 15、25 mg/kg 腹腔注射为诱导2 型糖尿病的最佳剂量,30 mg/kg 剂量引起明显和严重的心脏代谢改变,更类似于1 型糖尿病。 但该模型仅维持了一周,血糖的稳定性有待进一步研究。 刘丹丹等[10]以高脂喂养6 周联合STZ 30 mg/kg 腹腔注射,成模率70%,该模型继续维持2 周血糖稳定。 邵俊伟等[11]高脂喂养4 周联合STZ 35 mg/kg 腹腔注射,成膜率85%,维持10 d。 研究表明,随着高脂喂养时间延长,动物肥胖和胰岛素抵抗更加明显,胰岛素的负荷越重,制备2 型糖尿病动物模型使用的STZ 剂量就越少[12]。 在本研究中,HFD 喂养12 周后,DM 组大鼠葡萄糖清除率总体延迟(图2A),胰岛素敏感性下降(图2C),且体重明显增加(图1A),这些结果都表明DM 组大鼠存在胰岛素抵抗。 尾静脉注射STZ 25 mg/kg 后,DM 组出现明显的高血糖(表1)及“三多一少”症状(图2B),且全部成模。 本实验中采用尾静脉注射STZ 表现出比腹腔注射更好的稳定性,且血糖升高持续8 周没有回落(图3A),与Tay 等[13]的研究一致。 与腹腔注射STZ 相比,尾静脉注射更加直观,进针回抽有血再注射药物,避免了腹腔注射时药物进入皮下或肠道,导致死亡率增加或降低糖尿病的原发病作用。 但尾静脉注射药物利用率高,对剂量的准确性要求较高,研究者如能在前期进行预实验将大大提高成模率。 STZ 之前高脂饲料喂养12 周,确保大鼠形成IR,IR 的持续存在不仅符合2 型糖尿病的发生发展,降低了葡萄糖的利用率,且有利于高血糖的维持。 果糖胺是血浆中各种蛋白质与葡萄糖非酶糖化过程中形成的高分子酮胺结构物质,它的浓度与血糖水平成正相关且相对稳定。 由于血浆蛋白的半衰期为17 ~20 d,故果糖胺可反映糖尿病患者2 ~3 周总体血糖情况。本研究中DM 组果糖胺明显升高(图3B),进一步验证了模型的成功。 到实验终点时,模型组死亡5 只,死亡率25%,对照组全部存活。 对死亡大鼠进行解剖发现2 只大鼠存在明显的肺部感染,由于DM 组大鼠多尿垫料潮湿,每天两次更换,系更换垫料时吸入碎屑及粉末所致。 2 只肾脏明显脓肿,推测垫料潮湿导致泌尿系上行感染所致。 另1 只体重下降明显,弓背倦体,精神萎靡,行动迟缓,系营养不良或酮症酸中毒所致。
综上所述,HFD 喂养12 周联合STZ 25 mg/kg尾静脉注射,成功诱导以胰岛素抵抗为特征的2 型糖尿病。 该模型成膜率高、血糖稳定适合2 型糖尿病相关药物及并发症研究。 但本研究在造模成功后,采用普通饲料继续喂养,在实验终点时未能观察到两组血脂差异,且在高脂喂养12 周时,遗憾未能进行血脂检测,如实验者需进行降脂相关研究,本模型还需进一步探讨。 2 型糖尿病大鼠模型在长期的喂养过程中,由于高血糖状态、机体抵抗力差等原因仍存在较高的死亡率。 需要研究者在后续实验中保持实验室环境清洁,定期消毒杀菌,保持垫料相对干燥的同时尽量减少更换垫料时大鼠粉尘吸入。
