DHA 对高脂食物诱导体重增加的保护作用的研究
2020-07-08张欣杨英安晓羽谷艳琪张引麻炎孙利婷林芳武强强王亚娜杨慧娣
张欣,杨英,安晓羽,2,谷艳琪,张引,麻炎,孙利婷,林芳,武强强,2,王亚娜,2,杨慧娣*
肥胖已成为世界范围内一个严重的健康问题[1]。 全球趋势显示,肥胖症在所有年龄组中的流行率都在上升。 肥胖的特点是白色脂肪组织过度积累,并与代谢疾病发生有关。 肥胖会导致脂肪组织发生低度炎症,并且可能导致严重并发症的发生,如,胰岛素抵抗和II 型糖尿病[2]。 大量的研究表明,肥胖时,促炎症细胞因子的分泌增加,如白细胞介素6(IL-6),肿瘤坏死因子(TNF-α),和瘦素(Leptin)。 而抗炎因子的分泌减少,如脂联素(adiponectin)和白介素10(IL-10)[1]。 目前n-3 长链脂肪酸得到广泛的关注,许多研究表明n-3 长链脂肪酸(n-3 LC PUFA),对健康非常有益,特别是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)对肥胖和肥胖相关疾病的发展有预防作用[3]。 此外,越来越多的证据表明n-3 LC PUFA 能够改善肥胖人群的脂肪细胞的代谢和脂肪因子的分泌特征[3]。 脂肪生成是前脂肪细胞向成熟脂肪细胞分化的过程。脂肪分化是一个复杂的过程,主要由两个转录因子家族调控,CCAAT/enhancer-binding proteins (C/EBPs) 和peroxisome proliferator-activated receptorγ(PPARγ),维持终末脂肪细胞分化的两种主转录因子。 它们协同激活可以表达产生脂肪细胞表型的基因。 此外,固醇调节元件结合蛋白-1c(SREBP-1c)的激活对脂肪的积聚也非常重要。 体内研究表明,EPA 和DHA 能减少脂肪积累,增加脂肪基因在大鼠[4]、草鱼[5](Ctenopharyngodon idella)脂肪细胞分化中的表达。 此外,一些研究表明DHA 对脂肪细胞分化和前脂肪细胞凋亡的没有任何作用[1]。 因此,DHA 对脂肪分化因子的作用仍然很矛盾。
脂肪组织主要包含两种形式,白色脂肪组织(white adipose tissue,WAT)和褐色脂肪组织(brown adipose tissue,BAT)[1]。 WAT 是主要的能量储存器官,以甘油三酯(triglycerides,TG)的形式积累过剩的能量。 BAT 的作用主要是有产热功能,BAT 含有丰富的线粒体,线粒体内膜解偶联蛋白 1(uncoupling protein 1,UCP1)含量比较丰富,UCP1能够运输质子跨过线粒体内膜进而破坏氧化磷酸化,这样就造成了原本用于ATP 合成的能量通过热能的形式而散失,所以认为BAT 对于肥胖的防治起着关键的作用[5]。 其中UCP1 是BAT 产热的一个重要的标记蛋白。 PR 锌指区域蛋白16(PR domain containing 16,Prdm16)在细胞命运决定过程中起着重要作用,促进褐色脂肪细胞的发育。 Prdm16 可以诱导白色脂肪组织细胞的褐色化,Prdm16 通过与PPAR γ 辅助激活物1α(PGC1α)和PPARγ 结合,激活其转录功能,促进褐色脂肪的发生[6]。 然而,n-3 LC PUFA 对WAT 和BAT 脂肪分化因子和产热蛋白影响的证据还很少。 本研究旨在于探讨DHA在肥胖小鼠的WAT 和BAT 中脂肪分化因子的作用。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组
32 只雄性SPF 级C57BL/6 小鼠,体重14 ~16 g,购买于北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养在蒙古大学实验动物中心【SYXK(蒙)2014-0002】。 在温度为(23 ±1)℃,光照为12L:12D(Light:Dark,12 h:12 h)的动物房内饲养。 动物进行单笼(30 cm × 15 cm × 20 cm),饲养适应1 周。 分别饲以含10% kal 普通对照食物(100 g 食物中含2 g 猪油和2.5 g 大豆油,20 g 蛋白质,70 g 碳水化合物,5.5 g 微量元素,Research Diets,Inc。 货号D12450K)和45% kcal 食物(100 g 食物中含20.68 g 猪油和2.91 g 大豆油,20 g 蛋白质,50.91 g 碳水化合物,5.5 g 微量元素,Research Diets,Inc。 货号D12451)以及45% kcal 加DHA 食物,自由取食和饮水。 所有实验操作遵循内蒙古大学动物使用相关伦理要求【YKD2019142】。所有实验在内蒙古大学省部共建国家重点实验室内完成。
动物分成4 组:饲喂45% kcl 食物的C57BL/6小鼠(n=8)(C57BL/6H),饲喂10% kcal 食物的C57BL/6 小鼠(n=8)(C57BL/6C),饲喂45% kcal加DHA 食物(食物中加藻油,每260 毫克含50 毫克的DHA)(n=8)(FADC)或加DHA 食物(食物中加藻油,每260 毫克含100 毫克的DHA) (n= 8)(FADH),共饲养20 周,处死动物后取血液、两侧肩胛间全部的褐色脂肪组织和腹腔内所有脂肪。
1.1.2 主要的试剂和仪器
电子天平(赛多利斯公司)离心机(Eppendorf),代谢仪(FOXBOX,Sable Systems International Inc,Las Vegas,NV,USA),微量紫外分光光度计(Thermo Scientific Nano Drop 2000c),PCR 仪(ABI Veriti 96 well Thermal Cycler),实时定量PCR 仪(ABI7500)。
PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(货号RR047 A,TaKaRa公司,Japan)、RNAase free H2O、RNAiso Plus Total kit(货号9109,TaKaRa 公司,Japan)。
1.2 方法
1.2.1 体重和摄食
每天8:00 - 9:00 用电子天平称量动物的体重(精确到0.1 g)。 食物摄入采用食物平衡法测定。实验开始称量动物体重,定时、定量放入足够的饲料块。 3 d 后于相同时间(上午08:00 - 09:00)称量食物重量。 食物用电子天平称重(精确到0.001 g)。 72 h 平均食物摄入=(提供的食物- 剩余食物)/3。
1.2.2 静止代谢率(resting metabolic rate,RMR)的测定
采用开放式代谢仪进行测定。 在第37 周测定RMR。 小鼠RMR 测定温度为(30 ± 0.5)℃[热中性温度区(27.5 ~32.5)℃],动物在测定代谢率前并不禁食,在呼吸室内进行代谢率测定期间(约2 h)无饮水和食物的供应。 这时测得的代谢率被称为静止代谢率(RMR)。 测定时将动物放入呼吸室(1.4 L)[采用生化培养箱控温在(30 ± 0.5)℃]测定2 h。 测定前后均进行空气Baseline 测定。 采用公式:
(FR=空气流速(mL/min),Fi=进入呼吸室之前的空气含量(%),Fe=从呼吸室流出的空气含量(%)) ( http:/ /warthog. ucr. edu/WartHogPage/respirometry.html) 计算RMR。 取值时,取30 个连续稳定的最低值的平均值(5 min)作为RMR 的值。 测定前后均称量动物的体重(电子天平称量,感量0.1克)。
1.2.3 胰岛素、瘦素(Leptin)和甘油三脂(TG)测定
胰岛素(货号10-1132-01,Mercodia 公司,Sweden)、瘦素(货号ab100718,Abcam,USA)和甘油三脂(TG)(货号226900,Abcam 公司,USA)用小鼠ELISA 试剂盒进行测定,详细的操作步骤参照ELISA 试剂盒中的说明书进行。 采用分光光度计读数,根据标准曲线自动换算成样品血清胰岛素、瘦素和甘油三酯的浓度。
1.2.4 荧光定量PCR
RNAiso Plus Total kit(Takara,Japan)提取白色脂肪和褐色脂肪的总RNA,反转合成cDNA,PCR 使用PrimeScript RT Reagent 试剂盒(Takara)扩增引物(见表1)。 定量PCR 扩增在Stratagene 定量PCR 仪(Stratagene,USA) 上进行。 PCR 的反应体系为:6.25 μL 2 × SYBR® Premix EX TaqTMmaster mix(Cat. NO. DRR041D,TaKaRa,Japan),1 μL cDNA 模板和0.2 μmoL/L 引物。 反应程序为:95 ℃10 s;95℃5 s,60 ℃20 s,72 ℃20 s,共进行40 个循环。2-ΔΔCt法检测RT-PCR 实验中分析各基因表达的相对差异。 ΔΔCt 值由以下公式得到:ΔΔCt=(Ct靶基因-CtGAPDH)处理组-(Ct靶基因-CtGAPDH)对照组。 靶基因表达水平的变化有下面公式求出:靶基因表达水平差异倍数=2-ΔΔCt。
1.3 统计学分析
所有数据应用SPSS22 统计软件进行统计学分析。 所有数据统计分析之前,使用Kolmogorov-Smirnov and Levene tests 检测数据的齐性和正态分布。 所有数据均采用平均值±标准差(±s)表示。体重和摄食和贮存食物量采用重复测量(repeated measurement analysis),显著差异进一步采用双因素方差分析(Two-way ANOVA),组间比较采用Turkey HSD 分析。 RMR、脂肪、甘油三酯、胰岛素、Leptin、PPARγ、PPARα、CEBPα、SREBP1c、Prdm16、UCP1、PGC1α 采用双因素方差分析(Two-way ANOVA),组间比较采用Turkey HSD 分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 体重、食物摄入量和静止代谢率(RMR)以及甘油三脂(TG)和瘦素(Leptin)的测量
经过食物处理后,C57BL/6 H 组的体重比其他3 组小鼠的体重明显增加(P<0.01),而FAD3H 的体重与C57BL/6C 的体重没有差异。 食物摄取在四组间没有差异。 C57BL/6 H 组脂肪组织的重量显著高于其他3 组(P<0.01),FAD3 H 组的脂肪重量显著低于FAD3C 和C57BL/6H,(P<0.05),但是与C57BL/6 C 组没有明显差异。 这些数据表明45%的高脂食物诱导C57BL/6 小鼠体重和体脂增加,DHA降低高脂食物诱导的C57BL/6 小鼠的体重和体脂的增加。 为了检测能量消耗,测定了各组的静止代谢率。 C57BL/6 H 组的静止代谢率显著降低,FAD3 H 组的代谢率最高(P<0.05)(表2)。 这些结果暗示DHA 可以通过增加FAD3 H 组的静止代谢率,增加能量支出,从而降低高脂食物诱导C57BL/6 小鼠的体重和体脂。
肝脏甘油三脂浓度C57BL/6 H 组最高,FAD3H甘油三脂浓度最低(P<0.05)。 与其他组相比,C57BL/6 H 组的瘦素的含量明显增多(P<0.05),其他三组之间无差异。 (表2)
2.2 白 色 组 织 中 UCP1,PGC1α,PRDM16,PPARα,PPARγ,SREBP1c 和CEBPα mRNA 的表达
在白色组织中,C57BL/6 H 组脂肪分化因子PGC1α、PPARγ、SREBP1c 和CEBPα 的mRNA 的表达明显高于其他三组(P<0.05),暗示C57BL/6 H组体脂的增加可能与相关脂肪分化因子的表达增高有关;FAD3 H 组PPARγ、SREBP1c 和CEBPα 的mRNA 的表达明显低于其他三组(P<0.05),说明DHA 可以降低这些脂肪分化因子的mRNA 水平,而线粒体生物合成基因PGC1α 的mRNA 表达显著低于其他三组(P<0.05)。 C57BL/6 H 组UCP1 的mRNA 的表达明显低于其他三组(P<0.05),UCP1是产热的标记蛋白,这一结果暗示其能量支出减少。 FAD3 C 组和FAD3 H 组的UCP1 的mRNA 的表达均明显高于C57BL/6 C 组和C57BL/6 H 组(P<0.05)。 FAD3 H 组的Prdm16 显著高于其他三组(P<0.05)。 PPARα 的表达4 组无差异。 (图1)
2.3 褐 色 组 织 中 UCP1,PGC1α,PRDM16,PPARα,PPARγ,SREBP1c 和CEBPα mRNA 的表达
在褐色脂肪组织中,C57BL/6 H 组脂肪分化因子PPARγ 的mRNA 的表达明显高于其他三组(P<0.05);FAD3C 和FAD3H 的PPARγ 的mRNA 的表达低于C37BL6C(P<0.05)。 再者,FAD3 C 组和FAD3 H 组SREBP1c 的mRNA 表达均明显高于C57BL/6 C组和C57BL/6 H 组(P<0.05);C57BL/6 H 组的SREBP1c 的mRNA 最低。 C57BL/6 H 组的Prdm16的mRNA 显著高于其他三组(P<0.05),FAD3 C 组和FAD3 H 组 的 Prdm16 的 mRNA 明 显 高 于C57BL/6 C 组,但低于C57BL/6 H 组(P<0.05),而FAD3 C 组和FAD3 H 组的Prdm16 的mRNA 没有差异。 FAD3H 组的PGCLα 的mRNA 表达最高,C57BL/6 H 组和FAD3 C 组的PGC1α 的mRNA 表达高于C57BL/6 C 组,但是低于FAD3 H 组(P<0.05)。 此外,FAD3 H 组UCP1mRNA 表达明显高于其他三组(P<0.05)。 (图2)
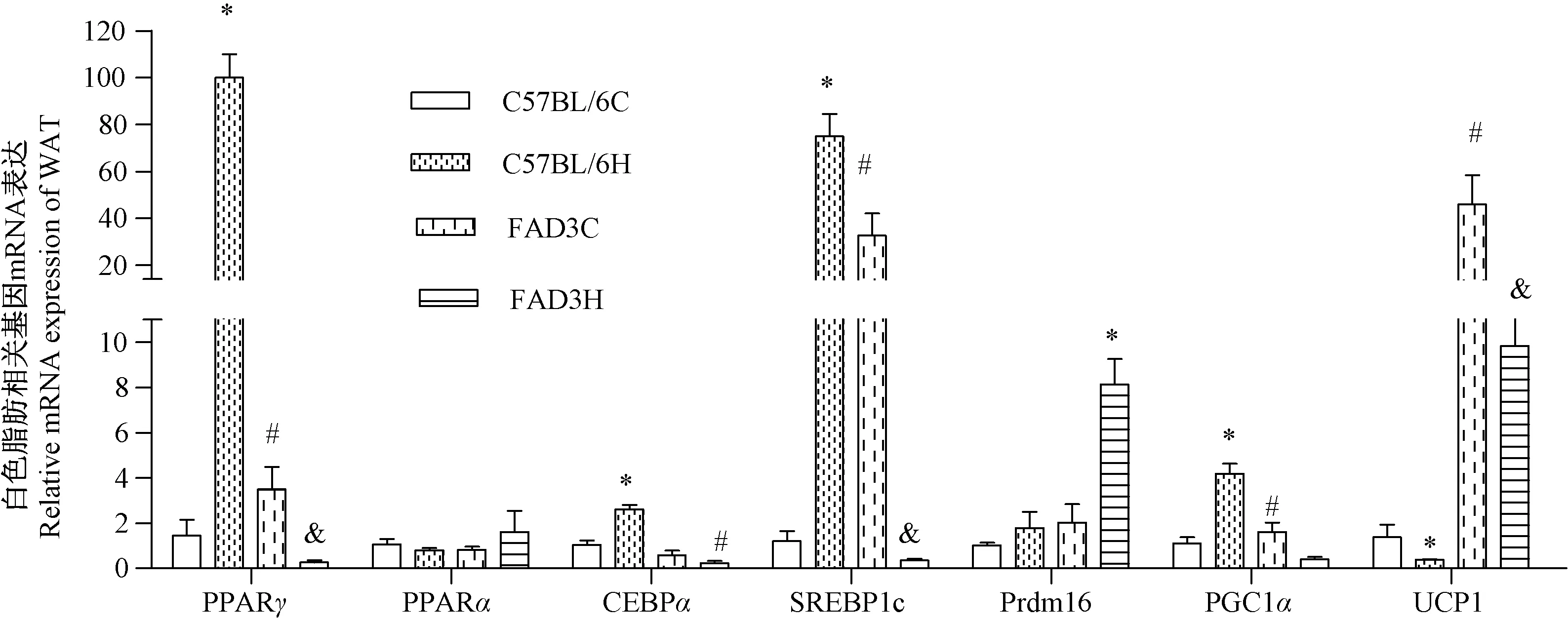
图1 四组白色脂肪组织中脂肪分化因子和线粒体合成基因的mRNA 的表达Figure 1 mRNA expression of adipose differentiation factor and mitochondrial synthetic gene of white adipose tissue in four groups

图2 褐色组织中脂肪分化因子和线粒体合成基因的mRNA 的表达Figure 2 mRNA expression of adipose differentiation factor and mitochondrial synthetic gene of brown adipose tissue in four groups
3 讨论
DHA 作为n-3 LC PUFA 的主要成分之一,是调节细胞信号和基因表达的生物活性化合物的结构成分和前体[1-2]。 许多研究表明,DHA 可能影响脂肪积累。 在本研究发现通过食物干预的方法,即饲喂高脂食物和补充DHA 的方法,可降低C57BL/6小鼠高脂食物诱导的体重增加。 研究结果显示C57BL/6 小鼠饲喂高脂食物后与体内能量积累相关的指标:体重、体脂以及血清甘油三脂和脂肪分泌的瘦素均增加,表明高脂食物诱导了C57BL/6 小鼠的肥胖。 同时,静止代谢率显著降低,说明能量支出减少。 然而,C57BL/6 小鼠饲喂高脂食物和DHA 后静止代谢率明显增高,暗示C57BL/6 小鼠通过增加能量支出降低体重。 DHA 影响脂肪形成的一个重要方法是调节脂肪分化因子的表达。 所以,本实验研究了DHA 是否通过抑制脂肪分化因子的表达来抑制脂肪积累。
脂肪生成是前脂肪细胞向成熟脂肪细胞分化的过程,脂肪分化因子表达增加,导致白色脂肪的积累。 PPARγ 和SREBP1c 在脂肪沉积中起重要作用的转录因子[1-3]。 本研究结果表明在白色组织中,C57BL/6 H 组脂肪分化因子PPARγ、PGC1α、SREBP1c 和CEBPα 的mRNA 的表达显著高于对照组,表明高脂食物诱导脂肪分化因子表达。 与对照组(C57BL/6C)、FAD3 C 组和高脂组(C57BL/6H)相比,FAD3 H 组的PPARγ、PGC1α、SREBP1c 和CEBPα 的mRNA 的表达显著降低,说明DHA 可以降低脂肪分化因子的表达,从而减少脂肪积累,而且DHA 的作用具有剂量依赖性。 这与在金色中仓鼠中的研究一致[3],高脂食物饲喂金色中仓鼠后PPARγ 和SREBP1c 表达显著增加,饲喂高脂食物和n-3 PUFA 后PPARγ 和SREBP1c 表达显著降低。
褐色脂肪组织和白色脂肪组织的褐色化可以增加能量支出和产热。 与褐色脂肪相似,白色脂肪中的褐色细胞具有较高的线粒体水平,并表达褐色组织特异性基因,如UCP1 和PGC1α[6-8]。 本研究中饲喂高脂食物和DHA 后,FAD3 C 组和FAD3 H组白色脂肪和褐色脂肪中UCP1 表达比饲喂高脂食物C57BL/6 H 组显著增加,暗示DHA 可能通过增加白色脂肪组织细胞褐色化和褐色细胞的产热,增加能量支出,从而降低体重和体脂。 然而,尽管白色脂肪组织中,高脂食物导致PPARγ 和PGC1α mRNA 的表达增加,但是Prdm16 mRNA 没有任何变化。 但是DHA 却抑制SREBP1c mRNA 表达,暗示除了PPARγ 和PGC1α 调节UCP1 的表达以外,SREBP1c 也可能参与了UCP1 表达的调节[9]。 再者,褐色脂肪组织中,高脂食物导致PPARγ 和PGC1α mRNA 的表达增加,但是UCP1 mRNA 表达却没有改变,SREBP1c mRNA 表达被降低,进一步证实了本实验白色脂肪组织中的结果,暗示SREBP1c 可能在UCP1 表达的调节中起重要作用。
总之,本研究结果表明DHA 可以降低高脂食物诱导的体重增加,通过降低脂肪生成基因PPARγ,CEBPα 和SREBP1c 的表达,增加白色脂肪褐色化基因PGC1α 和UCP1 表达,增加静止代谢率,从而增加能量支出,降低体重和体脂。
