一种新型弹性仿生人工血管修复大鼠血管缺损的应用研究
2020-07-08张晏源黄鑫吕前欣侯燕靳丹高晔刘富伟蔡卜磊孔亮
张晏源 黄鑫 吕前欣 侯燕 靳丹 高晔 刘富伟 蔡卜磊 孔亮
血管移植常用于口腔颌面部创伤后组织修复重建,自体血管移植是血运重建的“金标准”,但使用自体血管会造成供区损伤,且个体也无法提供足够的血管量来满足临床需求[1-2]。因此人工血管替代自体血管已成为趋势。目前人工血管虽然已被用于临床,但常因动脉瘤、动脉破裂、血管内膜过度增生等情况导致移植失败。其主要原因是人工血管力学性能低和生物学性能差[3]。
本研究利用静电纺丝技术,使用PCL和PU逐层构建弹性仿生人工血管,内层、外层均采用PCL微纳米纺丝提高生物学性能[4],中层采用PCL/PU(W/W, 1/3) 微纳米纺丝增强力学性能,提高血管弹性[5]。随后,构建SD大鼠腹主动脉缺损模型,并使用该PCL/PU血管修复缺损,并检测其在体内的血管重建效果,为PCL/PU血管的临床应用提供实验依据和理论基础。
1 材料与方法
1.1 PCL/PU血管构建
聚己内酯(PCL)、聚氨酯(PU, Sigma-Aldrich, 美国); 二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF)、四氢呋喃(THF)(北京化学试剂有限公司)。 采用静电纺丝,层层组装制备PCL/PU血管,接收纺丝的为直径2 mm的金属滚轴,滚轴匀速转动,使纺丝均匀缠绕并逐渐增厚,内层为PCL微纳米纤维,中层为PCL/PU(W/W,1/3)混合微纳米纤维,外层为PCL微纳米纤维,连续纺丝至形成PCL/PU血管,成通风干燥,备用。
1.2 大鼠腹主动脉与PCL/PU血管微观结构比较
扫描电镜(SEM)(Hitachi, S-4800, 日本)观察,大鼠腹主动脉与PCL/PU血管分别剪裁出长度0.5 cm,戊二醛固定24 h后,梯度乙醇脱水,无水乙醇脱水2次,加入锇酸,干燥,喷金,SEM观察。
1.3 爆破压力测试
将PCL/PU血管(4 cm)固定至爆破压测量仪上,在管腔内注入蒸馏水,一端连接电子气压计,另一端连接气瓶,逐渐增加PCL/PU血管管腔内压力,并记录压力值,直至PCL/PU血管发生渗漏。
1.4 模量测试
获取大鼠腹主动脉和PCL/PU血管,利用万能力学仪(BOSE 3220,美国)测量,设定拉升速度为1 cm/min,重复测量5 次。
1.5 动物模型建立
选取200~230 g, 8 周龄 SD雄性大鼠10 只,第四军医大学实验动物中心提供。采用戊巴比妥钠腹腔注射麻醉(0.167 g/100 g),腹正中切口,用湿棉棒轻柔推开肠道,暴露腹主动脉,夹闭腹主动,剪断并用肝素钠冲洗管腔,使用8-0缝线在显微镜下操作缝合,建立SD大鼠腹主动脉移植PCL/PU血管模型,术前、术后均不使用任何抗凝药物,并在1 个月后进行取材。
1.6 组织学切片制作
取材后,用PBS冲洗组织,OCT包埋,在-20 ℃下冷冻切片厚度为7 μm,然后进行HE染色、Masson染色,并于正置显微镜下拍摄记录。免疫荧光染色采用CD31(R&D)、 α-SMA(Abcam), BSA封闭, 4 ℃孵育过夜,Fluor594(CST)避光孵育1 h,封片,激光共聚焦显微镜(CLM, OLYMPUS, FV1000, 日本)下拍摄记录。
2 结 果
2.1 血管断面观察对比
SEM显示大鼠腹主动脉(n=5)厚度约为(180±32) μm,呈现典型三层结构,内层为菲薄的ECs层;中层为结构致密的SMCs层;外层为结构较为疏松的结缔组织层。PCL/PU血管(n=5)厚度较大鼠腹主动脉略厚,约为(250±24) μm,也呈明显的三层结构,内层为PCL微纳米纤维层;中层为PCL/PU微纳米纤维层,外层为PCL微纳米纤维层(图 1)。

图1 大鼠腹主动脉和PCL/PU血管结构 (SEM, ×300)
Fig 1 Structure of rat abdominal aorta and PCL/PU aorta graft (SEM, ×300)
2.2 爆破压测试效果
测量仪器最大压力值120 kPa≈900 mmHg,本实验中随机抽取PCL/PU血管(n=5),反复充压30 次,充压时膨胀,降压时收缩,该PCL/PU血管均能够保持弹性,期间PCL/PU血管未出现渗漏,其爆破压力值超过900 mmHg,可以耐受正常生理血压(图 2)。

图 2 PCL/PU血管爆破压测试
Fig 2 The burst pressure test of aorta graft
2.3 模量测试结果
通过拉伸测试PCL/PU血管模量达到(5.60±0.34) MPa,断裂伸长率可达到564%±28%;大鼠腹主动脉模量达到(2.06±0.11) MPa,断裂伸长率可达到170%±20%, PCL/PU血管强度高于大鼠腹主动脉(图 3)。
2.4 PCL/PU血管愈合
SD大鼠腹主动脉移植PCL/PU血管术后30 d取材(n=10), 其中1 只在术后1 d内死亡,探查发现死亡原因为PCL/PU血管吻合口破裂,腹腔内出血致死。其余9 只SD大鼠进食以及运动功能等均未见异常。取材样本大体观察可见PCL/PU血管均与自体血管融合良好,在外层形成丰富的滋养血管网,血流通畅(图 4),缝线吻合处光滑,无狭窄、无动脉瘤形成(图 4)。

图 3 大鼠腹主动脉和PCL/PU血管应力应变曲线
Fig 3 The stress strain curve of rat abdominal aorta and PCL/PU aorta graft

图 4 PCL/PU血管大体观察
Fig 4 The gross observation of PCL/PU aorta graft
HE染色可见,大鼠腹主动脉的结构,内层为ECs,中层为SMCs,外层为疏松结缔组织(图 5A、 5B); PCL/PU血管植入30 d内,也形成了类似大鼠腹主动脉的管状结构(EF)。Masson染色观察,大鼠腹主动脉外层可见大量的胶原包裹(CD);PCL/PU血管中层和外层内可见有丰富的胶原纤维相互融合(GH)。
CD31和a-SMA分别为EC和SMC的标记蛋白,PCL/PU血管免疫荧光观察可见,内层有ECs覆盖,ECs结构完整连续,为移植血管提供了良好的封闭性(图 6A);中层分布较多的SMCs,由内到外逐渐减少,推测PCL/PU血管中层的SMCs来源为血循环,因此短期内呈现由内到外逐渐减少的密度梯度;外层可见SMCs呈环形分布,说明短期内周围组织就有成熟的滋养血管长入(图 6B),为PCL/PU血管的改建提供细胞来源。

图 5 大鼠腹主动脉与PCL/PU血管组织组织学观察
Fig 5 Histopathological observation of rat abdominal aorta and PCL/PU aorta graft
3 讨 论
理想的人工血管需要具备良好的力学性能,能够耐受血压的变化,防止血管破裂;还需要具备良好的生物学性能,能够与自体血管相互融合,防止血管阻塞。模拟天然血管的结构和功能,是一种简洁、有效的构建人工血管方法。
PCL是一种应用广泛的生物材料, 已有其运用于组织工程修复受损的表皮、神经、骨缺损、软骨缺损的报道,其具有较好的生物学性能,并且可以完全降解[4-6]。PU是一种柔韧性好具有高度弹性的材料,已有报道使用PU作为人工血管材料,但因其结构致密,限制营养物质交换,愈后不佳等原因并未广泛应用[7]。本研究创新性的结合两种材料的优点,使用静电纺丝技术来进行PCL/PU血管的制造。首先,我们使用致密的PCL纺丝构建表面较为平整的内膜层,从而有效防止血栓形成并同时利于ECs粘附。其次,疏松的PCL纺丝构建外层,模拟天然血管外层的疏松结缔组织,静电纺丝提供的高表面积比和高孔隙率,便于细胞迁入孔隙中。最后,PCL/PU纺丝构建中层,PU和PCL有相似的官能团,按比例混合可使其力学性能协同增强,模拟天然血管中层平滑肌的支撑功能[5]。PCL/PU血管植入30 d,大体观察可见,其外表面形成的丰富的滋养血管网,更加利于物质交换,内层缝合处光滑,无狭窄或血栓;HE染色证实内层形成完整平滑的ECs;中层随着PCL成分的降解,逐渐增大的孔隙更利于SMCs进入纺丝间隙中,Masson染色也证实中层内有丰富的胶原纤维的形成,从而利于PCL/PU血管维持足够的力学性能,也促使PCL/PU血管与自体组织融合;免疫荧光染色显示血管ECs在PCL/PU内表面完整覆盖,而ECs正是止血和减少血栓形成中起着关键细胞[8-9]。SMCs已长入血管中层,其细胞密度由内到外逐渐减少,提示SMC的主要来源为外周血循环,SMCs的迁入也预示着PCL/PU血管后期可能会具有舒张、收缩等血管功能;而PCL/PU血管外膜可见丰富的滋养血管;外层滋养血管长入能进一步促进材料的吸收和功能细胞的迁入[10-12]。
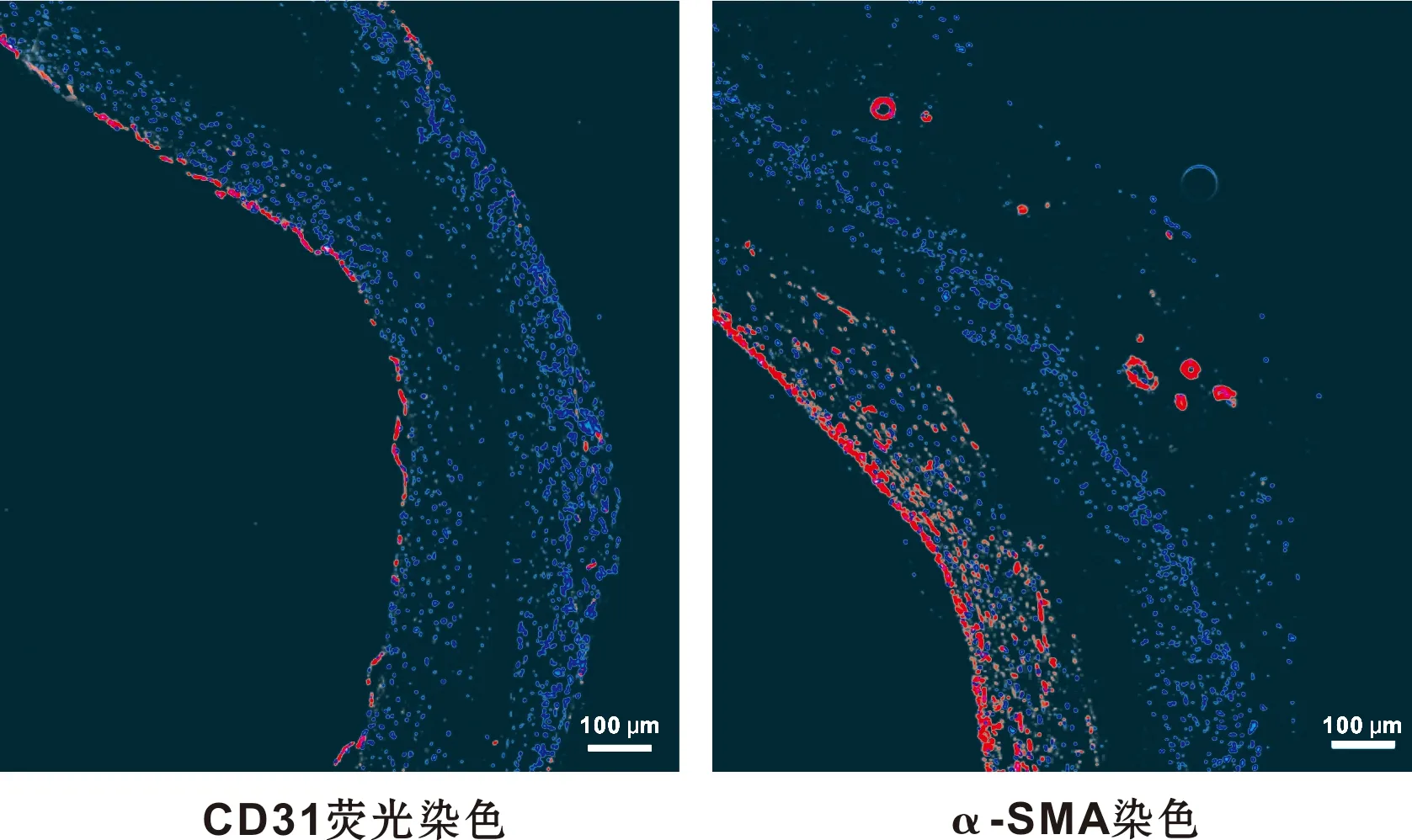
图 6 PCL/PU血管免疫荧光染色
Fig 6 Immunofluorescent staining of PCL/PU aorta graft
综上所述,本研究所合成的PCL/PU弹性仿生人工血管具有良好的力学性能和生物学性能,并能在体内改建同时维持力学强度,是一种具有优良临床应用潜力的人工血管。
