文心兰高效再生体系的建立
2020-07-07李雪青盛玉辉付瑛格周扬赵莹凌鹏宋希强王健
李雪青 盛玉辉 付瑛格 周扬 赵莹 凌鹏 宋希强 王健

摘要:【目的】建立文心兰高效再生体系,为利用转基因技术进行品种改良提供科学依据。【方法】以文心兰柠檬绿的无菌苗叶片为材料,探讨不同植物生长调节剂配比对其原球茎诱导的影响,开展增殖、生根及移栽研究,建立其高效稳定的再生体系。【结果】影响文心兰原球茎诱导的3种植物生长调节剂主次排序为萘乙酸(NAA)>噻苯隆(TDZ)>6-芐氨基嘌呤(6-BA),在1/2MS培养基中添加0.5 mg/L NAA、0.5 mg/L 6-BA和0.3 mg/L TDZ的诱导率最高,达48.0%。培养基中活性炭含量及碳水化合物种类对文心兰原球茎增殖的影响存在明显差异,不同活性炭含量处理间的原球茎增殖系数存在显著差异(P<0.05,下同),添加1.0 g/L活性炭较添加0.5 g/L活性炭的增殖系数显著升高,不同碳水化合物种类间的原球茎增殖系数排序为海藻糖>麦芽糖>蔗糖,最佳增殖和分化培养基为1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L活性炭+20 g/L海藻糖。添加10%椰子水的文心兰幼苗生根数显著高于添加10%香蕉汁和10%苹果汁,每株平均生根量接近4.00条,即生根效果最佳的培养基为1/2MS+0.8 mg/L 6-BA+0.2 mg/L NAA+10%椰子水。移栽过程中根部用水苔包裹后再移至椰糠中,保证光照、水分适宜,适当添加缓释肥,移栽成活率可达100%。【结论】利用海藻糖或麦芽糖作为碳源的文心兰原球茎增殖效果较优,生根数和生根质量优势明显;不同植物生长调节剂配比、碳源和有机物的添加对文心兰组织培养具有明显的促进效果。
关键字: 文心兰;再生体系;原球茎;增殖;生根;移栽
中图分类号: S682.31 文献标志码: A 文章编号:2095-1191(2020)05-1169-07
Abstract:【Objective】In order to provide support for the varieties improvement of Oncidium using transgenic technology, an efficient regeneration system was established. 【Method】 Leaves of sterile plantlets of Oncidium Lemon Green were used as materials. The effects of different plant growth regulators for the induction of protocorms were researched. The proliferation, rooting and transplanting methods were studied and the efficient regeneration system was established.【Result】The most efficient plant growth regulator for the protocorm induction was naphthaleneacetic acid (NAA), followed by thiabendron(TDZ) and 6-benzylaminopurine(6-BA). 1/2MS medium with 0.5 mg/L NAA, 0.5 mg/L 6-BA and 0.3 mg/L TDZ harvested the highest induction rate of 48.0%. The different activated charcoal contents and carbohydrates in media had obvious different effects on protocorm proliferation efficiency, protocorm proliferation times treated by different activated charcoal contents had significant difference. The treatment of 1.0 g/L activated charcoal significantly increased proliferation coefficient than that of 0.5 g/L. Protocorm proliferation coefficients of different carbohydrates was trehalose>maltose>sucrose. The optimal medium for proliferation and differentiation was 1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L activated charcoal+20 g/L trehalose. The rooting number of Oncidium seedlings in the medium with 10% coconut juice was significantly higher than that with 10% banana juice or 10% apple juice, and the average root number per plant was about 4.00. The best rooting medium was 1/2MS+0.8 mg/L 6-BA+0.2 mg/L NAA+10% coconut juice. The roots were then wrapped with moss and the shoots were moved in coconut husk, and the survival rate of transplanted plantlets could reach 100% in the proper light and moisture environment while the slow-release fertilizers were used appropriately. 【Conclusion】Trehalose or maltose as carbon source can obviously improve the proliferation of protocorms of Oncidium,while the root number and quality are greatly increased. The different ratios of plant growth regulators, the different carbon source types and organic matters have obvious promotion effects on regeneration of Oncidium.
Key words: Oncidium; regeneration system; protocorm; proliferation; rooting; transplanting
Foundation item: Hainan Major Science and Technology Project(zdkj201815); Operation Service Reward Project of National Forest Germplasm Resources Service Platform(hdzkpt2019001)
0 引言
【研究意義】文心兰(Oncidium)又名舞女兰、跳舞兰,是兰科(Orchidaceae)文心兰属(Oncidium)植物,原产于美洲热带和亚热带地区(Chase et al.,2009;徐小雁等,2011;王安石等,2015)。因其花序分枝良好、花形优美、花色亮丽,被插花界誉为切花“五美人”之一,具有较高的观赏价值和经济价值(邵寒霜等,2000;陈华和范燕萍,2012;吴晓佩,2017)。近年来,文心兰作为重要的切花和盆花种类,其市场需求量急剧增加,成为洋兰类的新宠(李力,2016)。海南是我国文心兰切花的主要产区之一(柯海丽等,2012),但切花品种以黄色为主,花色较单一,且无香味,不符合人们日益多样化的需求,存在被市场淘汰的风险。利用成熟的基因工程技术可快速培育具备多种花色和香味的文心兰新品种,对促进文心兰产业可持续发展具有重要意义,而建立文心兰高效再生体系是实施基因工程的前提条件。【前人研究进展】目前,有关兰科植物再生体系的建立已有较多报道。樊家荣等(2014)利用1/2MS培养基对大花蕙兰(Cymbidium hybridum)鳞茎进行类原球茎诱导,得出植物生长调节剂的最佳浓度配比为0.5 mg/L 6-苄氨基嘌呤(6-BA)+0.2 mg/L萘乙酸(NAA),增殖分化的最佳天然复合物为150 mL/L椰汁,添加100 g/L香蕉泥对幼苗根生长有显著促进作用。Sherif等(2016)在宝石兰(Anoectochilus)再生体系研究中提出一种通过愈伤组织器官发生并成功诱导形成植株的方法,且证实利用不同浓度的植物生长调节剂[6-BA、NAA、噻苯隆(TDZ)、呋喃氨基嘌呤(KT)、2,4-二氯苯氧乙酸(2,4-D)和吲哚-3-乙酸(IAA)]附加柠檬酸、蛋白胨、椰子水和香蕉泥等天然复合物能有效提高愈伤组织的增殖率。卢娟(2017)发现采用低浓度的6-BA附加椰汁和香蕉泥等天然复合物可促进蝴蝶兰(Phalaenopsis aphrodite Rchb. F.)原球茎增殖。在文心兰方面,Chen和Chan(2000)以花茎再生植株的节间、叶片和根尖为材料,采用1/2MS培养基附加适宜比列TDZ和2,4-D及1 g/L蛋白胨暗培养4~7周,成功诱导出胚性愈伤;金苹(2009)以试管苗叶片为材料,利用1/2MS培养基+0.2 mg/L 6-BA+1.0 mg/L NAA成功诱导出原球茎;张超等(2010)探讨不同基本培养基、碳源和植物生长调节剂对原球茎增殖的影响,结果表明,MS为原球茎的最佳增殖培养基,10 g/L果糖为原球茎的最佳增殖碳源,0.01~0.10 mg/L NAA能促进原球茎增殖,且单独添加1.0 mg/L 6-BA时原球茎的增殖效果优于与NAA配合使用;林鹤延(2012)以文心兰和石斛兰(Dendrobium nobile)原球茎为材料进行兰花反义ACS基因转化并对转基因兰花原球茎进行继代培养与再生;黄霞和卢禹(2016)通过分析不同浓度配比TDZ和2,4-D对文心兰愈伤组织增殖的影响,结果发现添加1.0 mg/L TDZ和3.0 mg/L 2,4-D后,从接种的类原球茎(PLBs)上可诱导出乳白色、较疏松的愈伤组织,诱导率达100%,成功建立了文心兰高频再生体系;王亚平等(2016)以迷你文心兰玉香和金香为材料,建立了迷你文心兰的离体快繁技术体系;叶秀仙等(2016)以文心兰豹斑宝石的花梗为外植体,探究其丛生芽诱导、增殖和生根等关键环节的影响因素,旨在建立丛生芽组培快繁体系;马兰(2019)以1/2N6培养基+0.2 mg/L 6-BA+0.2 mg/L NAA为文心兰继代增殖及幼苗生长培养基取得良好效果。【本研究切入点】柠檬绿是海南文心兰切花的主要品种之一,经济价值高,可作为改良花色花香的品种,但至今未见有关该品种再生体系建立的研究报道。【拟解决的关键问题】以文心兰柠檬绿的无菌苗叶片为材料,探讨不同植物生长调节剂配比对其原球茎诱导的影响,开展增殖、生根及移栽研究,进而建立高效再生体系,为利用转基因技术进行品种改良提供科学依据。
1 材料与方法
1. 1 试验材料
文心兰柠檬绿无菌苗由海南博大兰花科技有限公司提供。
1. 2 原球茎诱导
取生长健壮、完整的无菌苗幼叶,切成长1.0 cm、宽0.5 cm的叶片片段,在1/2MS培养基中添加不同浓度的NAA(0、0.5和2.0 mg/L)、6-BA(0、0.5和1.0 mg/L)和TDZ(0、0.3和0.6 mg/L)等植物生长调节剂组合,按正交试验设计L9(3)4进行优化,每处理接种外植体30个,重复3次,置于组培室中培养7周后观察诱导效果,并统计其诱导率和死亡率。诱导率(%)=诱导数/接种数×100,死亡率(%)=死亡数/接种数×100,其中诱导数为诱导出原球茎的数目。
1. 3 原球茎增殖及分化
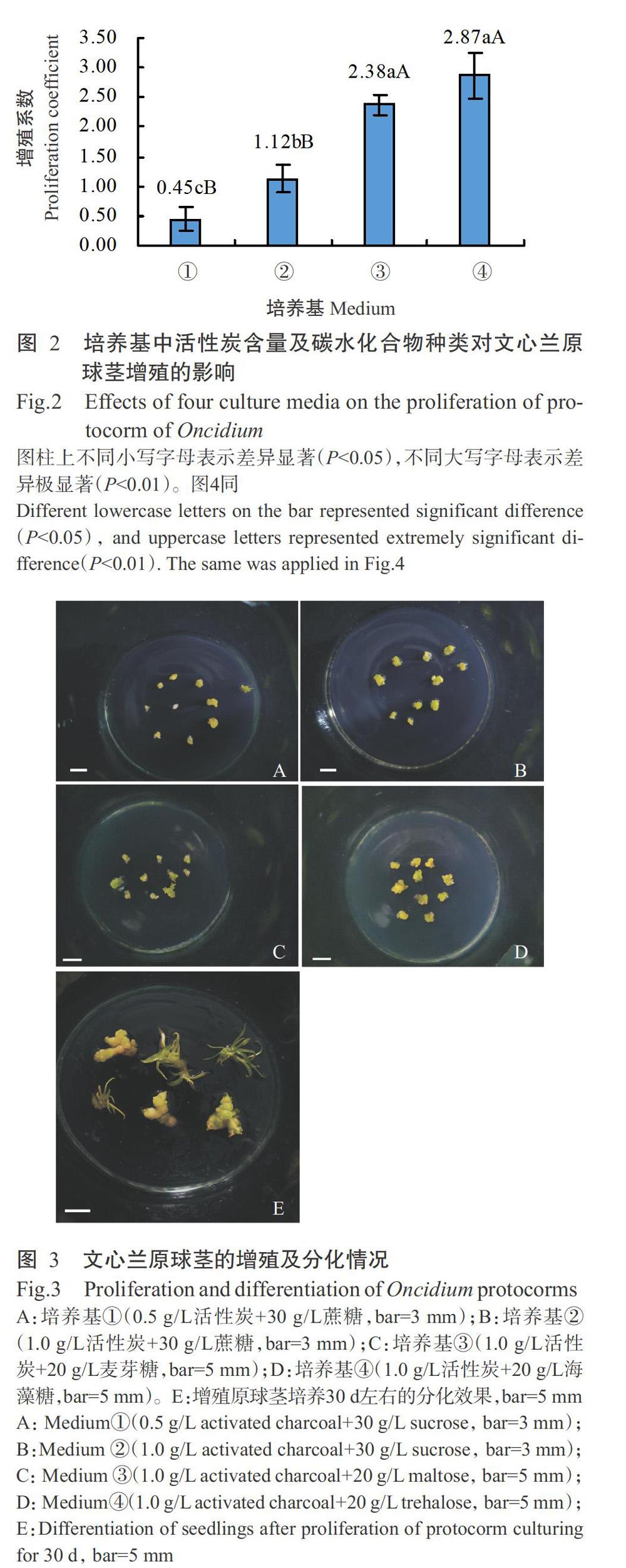
将原球茎接种在4种不同培养基中进行增殖与分化培养,每种培养基接种原球茎50粒,重复3次。培养基①:1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+0.5 g/L活性炭+30 g/L蔗糖;培养基②:1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L活性炭+30 g/L蔗糖;培养基③:1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L活性炭+20 g/L麦芽糖;培养基④:1/2 MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L活性炭+20 g/L海藻糖。培养30 d后统计增殖粒数并计算增殖系数,增殖系数=(现有粒数-原有粒数)/原有粒数,比较分析培养基中活性炭含量及不同碳水化合物对增殖的影响。培养60 d后统计分化数并计算分化率,分化率(%)=分化原球茎数/总原球茎数×100。
1. 4 生根培养
以不添加天然复合物的培养基1/2MS+0.8 mg/L 6-BA+0.2 mg/L NAA为对照,将分化出的幼苗接种于添加不同天然复合物(分别为10%的香蕉汁、椰子汁或苹果汁)的培养基中进行生根培养,每处理接种30个幼苗,重复3次。培养60 d后观察生根情况、统计生根数,并计算平均生根数,平均生根数(条)=生根条数/原有株数。
1. 5 移栽
选取株高约4.0 cm、根长2.0~3.0 cm、生长健壮的幼苗进行移栽。先将已生根的组培苗置于室温下1 d,然后揭开组培瓶盖在室外散色光下炼苗2~3 d,取出小苗以清水洗净根部培养基,稍晾干后用水苔包裹幼苗根部,移植到椰糠基质中,30 d后统计成活率。
1. 6 培养条件
除特殊说明外,培养基中均添加30 g/L蔗糖和5.8 g/L琼脂,pH 5.6,光照强度1500 lx,光照时间12 h/d,培养温度25 ℃。
1. 7 统计分析
利用Excel 2013对试验数据进行统计处理和制图,以SPSS 25.0进行单因方差分析、LSD多重比较及方差分析。
2 结果与分析
2. 1 不同浓度NAA、6-BA和TDZ对文心兰叶片诱导原球茎的影响
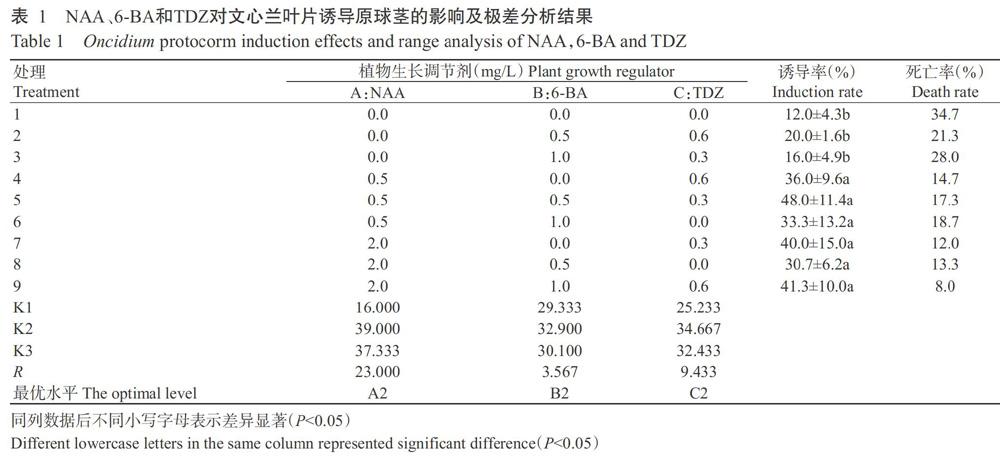
以文心兰无菌苗叶片为材料,利用正交试验研究不同植物生长调节剂种类及浓度对原球茎诱导的影响。由表1可看出,通过极差分析发现因素A(NAA)的R值最大(23.000),而因素B(6-BA)的R值最小(3.567),表明影响文心兰原球茎诱导的3种植物生长调节剂主次排序为NAA>TDZ>6-BA。结合诱导率的LSD多重比较分析结果可知,处理1~3与处理4~9间的原球茎诱导率存在显著差异(P<0.05,下同),其中,处理5(图1-A)的诱导率最高,达48.0%,其次为处理9(图1-B)。在死亡率方面,处理9的死亡率最低,仅8.0%。方差分析结果(表2)显示,NAA对原球茎诱导率的影响最大,达显著水平,而6-BA和TDZ对诱导率的影响均不显著(P>0.05,下同)。综上所述,文心兰原球茎诱导的最优配方组合是A2B2C2,即1/2MS+0.5 mg/L NAA+0.5 mg/L 6-BA+0.3 mg/L TDZ。
2. 2 活性炭含量及碳水化合物種类对文心兰原球茎增殖的影响
由图2可看出,培养基中活性炭含量及碳水化合物种类对文心兰原球茎增殖的影响存在明显差异,以培养基④的增殖系数最大(2.87),培养基①的增殖系数最小(0.45)。经LSD多重比较发现,不同活性炭含量处理间的原球茎增殖系数存在显著差异,添加1.0 g/L活性炭较添加0.5 g/L活性炭的增殖系数显著升高;不同碳水化合物种类间表现为添加麦芽糖或海藻糖的原球茎增殖系数无显著差异,但二者均极显著高于添加蔗糖的增殖系数,其原球茎增殖系数排序为海藻糖>麦芽糖>蔗糖。即文心兰原球茎增殖的最佳培养基为1/2MS+4.0 mg/L 6-BA+0.4 mg/L NAA+1.0 g/L活性炭+20 g/L海藻糖。在培养过程中发现,所有增殖的原球茎在原培养基上再经30 d左右培养,均可分化出幼苗(图3),分化率达100%。
2. 3 不同天然复合物对文心兰幼苗生根的影响
将分化获得的正常生长文心兰幼苗接种在添加不同天然复合物的培养基(1/2MS+0.8 mg/L 6-BA+0.2 mg/L NAA)上进行生根培养,其生根率均为100%,但生长状况及平均生根数存在差异。与对照相比,添加天然复合物处理的文心兰幼苗生根数均极显著增加(图4),生长状况和颜色也较对照优(图5)。在不同天然复合物处理间,添加10%椰子水的生根数显著高于添加10%香蕉汁和10%苹果汁,每株平均生根量接近4.00条,添加10%香蕉汁和10%苹果汁的生根数间无显著差异。因此,文心兰幼苗生根效果最佳的培养基为1/2MS+0.8 mg/L 6-BA+0.2 mg/L NAA+10%椰子水。
2. 4 文心兰生根组培苗的移栽结果
将生长良好、具有3~4片叶的文心兰再生幼苗置于自然室温下炼苗3~4 d再进行移栽,移栽过程用水苔包裹根部以保证其湿润,转移至椰糠穴盘中采用水苔椰糠基质进行幼苗培养(图6),每隔2~3 d以浸盘法进行浇水,保证光照条件充足,移栽15 d后喷施50%多菌灵可湿性粉剂600~800倍液,并适当添加缓释肥,30 d后其成活率达100%。
3 讨论
NAA和6-BA是常用的植物生长调节剂,对文心兰原球茎的增殖和分化具有重要作用(金苹,2009)。6-BA与NAA配伍使用既有利于原球茎的增殖及分化,又有利于幼苗生根,可有效提高组培苗质量(彭立新等,1999)。本研究结果表明,不同浓度的6-BA和NAA对文心兰原球茎诱导增殖均有影响。在原球茎诱导方面,0.5~1.0 mg/L 6-BA有利于文心兰原球茎诱导,而NAA浓度为0.5 mg/L的诱导效果最佳,说明在一定浓度范围内,6-BA和NAA均有利于文心兰原球茎诱导,与李力(2016)、曾武清等(2017)、郭艳芳(2018)的研究结果基本一致;在原球茎增殖方面,较高浓度(4.0 mg/L)6-BA配合较低浓度(0.4 mg/L)NAA可获得较高的增殖系数,与崔广荣等(2005)的研究结果相似。TDZ具有较强的细胞分裂活性,低浓度可诱导兰科植物原球茎或愈伤组织发生(王济红等,2013);高浓度则抑制愈伤组织形成,促进其分化(徐华松等,1996)。在本研究中,文心兰原球茎诱导率也受TDZ浓度影响,在0.3~0.6 mg/L范围内,TDZ对诱导率的提高具有一定促进作用,但与未添加TDZ的诱导率无显著差异,可能与文心兰的品种有关系,具体原因有待进一步探究。
碳水化合物是组织胚转化成小植株的重要物质(Jheng et al.,2006)。Pullman等(2003)研究发现,当麦芽糖取代蔗糖时可提高冷杉组织胚的植株转化效率,并促进其体细胞胚成熟,可能是麦芽糖作为一种优良的碳水化合物渗透剂在关键时期能促进冷杉组织胚发育。Jheng等(2006)通过研究碳源对文心兰PLBs形成和植株再生的影响,发现在培养基中添加麦芽糖和蔗糖对PLBs的增殖有促进作用,但海藻糖较麦芽糖更有利于植株转化。张超等(2010)研究表明,不同碳源对文心兰原球茎增殖效果的排序为果糖>蔗糖>葡萄糖>麦芽糖>山梨醇>甘露醇,以添加10 g/L果糖的增殖效果最佳。本研究结果表明,添加20 g/L海藻糖对文心兰原球茎的增殖有促进作用,添加麦芽糖也有类似作用效果,与Jheng等(2006)的研究结果基本一致。本研究发现,添加1.0 g/L活性炭对文心兰原球茎增殖有明显促进作用,可能是活性炭能吸附组培过程中植物分泌的有害次生代谢物质。此外,活性炭与不同碳水化合物配伍使用的原球茎增殖效果更好,增殖系数最高可达2.87,增殖效果优于单独使用活性炭(李力,2016)。
在文心兰生根培养基中添加适量天然复合物如香蕉汁、椰汁和苹果汁等可有效促进增殖、生根,究其原因可能是此类天然复合物中富含氨基酸、植物激素、矿物质和维生素等营养成分(何松林等,2003)。彭晓明等(2000)研究发现添加香蕉汁、椰乳、番茄汁或蘋果汁的培养基对文心兰增殖和壮苗生根均有促进效果;赵丽和田维敏(2008)也发现在文心兰高效再生体系中添加10%椰子水及1.0 mg/L IBA能有效诱导生根。至今,已有较多研究证实添加椰子水和椰乳等能取得良好的原球茎增殖分化效果,可能是椰乳中含有的营养成分和生理活性物质配比与兰花原球茎增殖及分化所需的配比一致(张梅等,2019)。在本研究中,最佳生根培养基为1/2 MS+0.8 mg/L 6-BA+0.2 mg/L NAA+10%椰子水,且组培苗根数多、植株更浓绿、根生长更健壮,较满若君(2007)、赵丽和田维敏(2008)的研究效果更优。文心兰原球茎诱导率还与叶片选择有关。按照以下要求选择叶片有利于诱导:叶片长、宽分别为1.0和0.5 cm,切口平整,不过嫩(从上到下第1~2片叶子)、不太老(从上到下数第6片叶子后的叶片),因为老叶易变黄,过嫩叶片则易萎蔫,均不利于诱导。
4 结论
利用海藻糖或麦芽糖作为碳源的文心兰原球茎增殖效果较优,生根数和生根质量优势明显;不同植物生长调节剂配比、碳源和有机物的添加对文心兰组织培养具有明显的促进效果。
参考文献:
陈华,范燕萍. 2012. 文心兰花香成分的分析[J]. 江西农业大学学报,34(4):692-698. [Chen H,Fan Y P. 2012. Analysis of aroma components of Oncidium[J]. Acta Agriculturae Universitatis Jiangxiensis,34(4):692-698.]
崔广荣,刘士勋,何玉华,刘云兵,谷业理. 2005. 外源激素、芽苗数及大小对文心兰试管苗增殖的影响[J]. 热带作物学报,26(2):45-49. [Cui G R,Liu S X,He Y H,Liu Y B,Gu Y L. 2005. Effects of hormones,shoot length and number on Oncidium shoot propagation[J]. Chinese Journal of Tropical Crops,26(2):45-49.]
樊家荣,孟想想,曹可. 2014. 大花蕙兰组培快繁技术研究[J]. 生物学杂志,31(6):99-102. [Fan J R,Meng X X,Cao K. 2014. Research on rapid propagation technology of tissue culture of Cymbidium[J]. Journal of Biology,31(6):99-102.]
郭艳芳. 2018. 巧克力文心兰离体培养优化及抗病基因克隆与表达分析[D]. 福州:福建农林大学. [Guo Y F. 2018. Optimization of the in vitro culture conditions, cloning and expression analysis of disease resistance related genes in Oncidium sharry baby[D]. Fuzhou:Fujian Agriculture and Forestry University.]
何松林,孔德政,杨秋生,张启翔,田中道男. 2003. 碳源和有机添加物对文心兰原球茎增殖的影响[J]. 河南农业大学学报,37(2):154-157. [He S L,Kong D Z,Yang Q S,Zhang Q X,Tanaka D. 2003. Effect of carbon sources and organic compounds on the multiplication of Oncidium aloha ?Iwanaga? PLB[J]. Journal of Henan Agricultural University,37(2):154-157.]
黄霞,卢禹. 2016. 文心兰类原球茎的愈伤组织诱导及其植株再生[J]. 广西植物,36(9):1082-1086. [Huang X,Lu Y. 2016. Callus induction and plant regeneration of Onci-dium ‘Gower Ramsey by means of protocorm-like body culture[J]. Guihaia,36(9):1082-1086.]
金苹. 2009. 根癌农杆菌介导ACS反义基因转化文心兰的研究[D]. 福州:福建农林大学. [Jin P. 2009. Studies on the tranformation of antisense ACS gene mediated by Agrobacterium tumefaciens in Oncidium[D]. Fuzhou:Fujian Agriculture and Forestry University.]
柯海丽,黎维诗,刘冬梅,凌绪柏. 2012. 文心兰切花品种的栽培比较研究[J]. 安徽农业科学,40(34):16556-16557. [Ke H L,Li W S,Liu D M,Ling X B. 2012. Cultivation comparison for cut-flower cultivars of Oncidium[J]. Journal of Anhui Agricultuarl Sciences,40(34):16556-16557.]
李力. 2016. 文心兰离体培养技术研究[J]. 农村经济与科技,27(20):38. [Li L. 2016. Study on in vitro culture technology of Oncidium[J]. Rural Economy and Technology,27(20):38.]
林鹤延. 2012. 转基因兰花培养物继代保持及文心蘭ACO基因克隆与表达分析[D]. 福州:福建农林大学. [Lin H Y. 2012. Studies on maintenance of orchid transgenic cultures and cloning and expression analysis of ACO in Oncidium[D]. Fuzhou:Fujian Agriculture and Forestry University.]
卢娟. 2017. 蝴蝶兰花梗腋芽组织培养探究[J]. 南方农业,11(9):117-118. [Lu J. 2017. Study on tissue culture of axil-lary bud of phalaenopsis pedicel[J]. South China Agriculture,11(9):117-118.]
马兰. 2019. 文心兰的茎尖及花梗组织培养和快速繁殖探讨[J]. 现代园艺,(2):15-16. [Ma L. 2019. Study on the ti-ssue culture and rapid propagation of shoot tip and pedicel in Chinese orchid[J]. Current Horticulture,(2):15-16.]
满若君. 2007. 蝴蝶兰、文心兰再生体系的建立及遗传转化体系的初步研究[D]. 南宁:广西大学. [Man R J. 2007. Preliminary studies on regeneration and transformations systems of Phalaenopsis and Oncidium[D]. Nanning:Guangxi University.]
彭立新,王姝,孟广云. 1999. 蝴蝶兰组织培养快繁研究[J]. 天津农业科学,5(2):29-31. [Peng L X,Wang S,Meng G Y. 1999. Study on tissue culture and rapid propagation of Phalaenopsis[J]. Tianjin Agricultural Sciences,5(2):29-31.]
彭晓明,曾宋君,张京丽,赵逢畔. 2000. 文心兰的茎尖及花梗组织培养和快速繁殖[J]. 园艺学报,127(2):127-129. [Peng X M,Zeng S J,Zhang J L,Zhao F P. 2000. In vitro propagation of Oncidium by bud and inflorescence culture[J]. Acta Horticulturae Sinica,127(2):127-129.]
邵寒霜,李继红,王胜培. 2000. Lfy cDNA高效单子叶植物表达载体的构建及转化兰花研究初报[J]. 热带作物学报,21(3):58-62. [Shao H S,Li J H,Wang S P. 2000. Construction and transformation of high efficient monocot expression vector into orchid[J]. Chinese Journal of Tropical Crops,21(3):58-62.]
王安石,林明光,陈施明,韩松,潘英文. 2015. 不同栽培基质对文心兰组培苗生长的影响[J]. 南方农业学报,46(3):462-465. [Wang A S,Lin M G,Chen S M,Han S,Pan Y W. 2015. Effects of different substrates on transplanting survival rate and growth of Oncidium plantlet[J]. Journal of Southern Agriculture,46(3):462-465.]
王济红,刘燕,向立容,祁翔. 2013. 文心兰组培育苗初诱导关键技术研究[J]. 贵州师范大学学报(自然科学版),31(2):1-6. [Wang J H,Liu Y,Xiang L R,Qi X. 2013. Key technical research for induction of the tissue culture seedling of Oncidium[J]. Journal of Guizhou Normal University(Natural Sciences),31(2):1-6.]
王亚平,王燕君,谭志勇,张乐萍,曾美琴. 2016. 迷你文心兰组培快繁技术研究[J]. 现代农业科技,(3):181-183. [Wang Y P,Wang Y J,Tan Z Y,Zhang L P,Zeng M Q. 2016. Study on rapid propagation technogy of tissue culture of mini Oncidium[J]. Modern Agricultural Science and Technology,(3):181-183.]
吴晓佩. 2017. 文心兰离体培养优化及转化铁氧还蛋白基因研究[D]. 福州:福建农林大学. [Wu X P. 2017. Optimization of Oncidium in vitro culture system and transformation ananlysis of Ferredoxin genes[D]. Fuzhou:Fujian Agriculture and Forestry University.]
徐华松,徐九龙,黄学林. 1996. TDZ在植物组织培养中的作用[J]. 广西植物,16(1):77-80. [Xu H S,Xu J L,Huang X L. 1996. Effect of TDZ on plant tissue culture[J]. Guihaia,16(1):77-80.]
徐小雁,龙明华,田敏. 2011. 文心兰花期及花形态结构研究[J]. 南方农业学报,42(6):651-653. [Xu X Y,Long M H,Tian M. 2011. Morphological changes associated with different flowering stages of Oncidium variety Milliongolds[J]. Journal of Southern Agriculture,42(6):651-653.]
叶秀仙,黄敏玲,罗远华,林榕燕,钟淮钦. 2016. 盆花文心兰丛生芽组培快繁技术研究[J]. 福建农业学报,31(11):1198-1203. [Ye X X,Huang M L,Luo Y H,Lin R Y,Zhong H Q. 2016. Bud tissue culture and rapid propagation of potted flower,Oncidum[J]. Fujian Journal of Agricultural Sciences,31(11):1198-1203.]
曾武清,陈柳婵,曾瑞珍,易懋升,宿庆连,郭和蓉,黎扬辉,谢利. 2017. 丽影和红韵蝴蝶兰快速繁殖试验[J]. 广东农业科学,44(8):55-60. [Zeng W Q,Chen L C,Zeng R Z,Yi M S,Su Q L,Guo H R,Li Y H,Xie L. 2017. Micropropagation of Phalaenopsis‘Liyingand‘Hongyun[J]. Guangdong Agricultural Sciences,44(8):55-60.]
张超,荣松,张茜茜,楼楠男. 2010. 基本培养基、碳源及植物生长调节剂对文心兰原球茎增殖的影响[J]. 浙江农业科学,(1):55-59. [Zhang C,Rong S,Zhang Q Q,Lou N N. 2010. Effects of basic medium,carbon source and plant growth regulator on growth of Oncidium protocorm[J]. Journal of Zhejiang Agricultural Sciences,(1):55-59.]
张梅,胡瑾,周艳,李君一,冯佑鸿,李依蔓. 2019. 白花兜兰的无菌播种和离体快速繁殖[J]. 种子,38(3):45-49. [Zhang M,Hu J,Zhou Y,Li J Y,Feng Y H,Li Y M. 2019. Tissue culture and rapid propagation of Paphiopedilum emersonii[J]. Seed,38(3):45-49.]
赵丽,田维敏. 2008. 文心兰高效再生体系研究[J]. 安徽农业科学,36(20):8502-8503. [Zhao L,Tian W M. 2008. Study on the high-efficient regeneration system of Onci-dium[J]. Journal of Anhui Agricultuarl Sciences,36(20):8502-8503.]
Chase M W,Williams N H,de Faria A D,Neubig K M,Amaral M C E,Whitten W M. 2009. Floral convergence in Oncidiinae(Cymbidieae;Orchidaceae):An expanded concept of Gomesa and a new genus Nohawilliamsia[J]. Annals of Botany,104(3):387-402.
Chen J T,Chan W C. 2000. Efficient plant regeneration through somatic embryogenesis from callus cultures of Oncidium(Orchidaceae)[J]. Plant Science,160(1):87-93.
Jheng F Y,Do Y Y,Liauh Y W,Chung J P,Huang P L. 2006. Enhancement of growth and regeneration efficiency from embryogenic callus cultures of Oncidium ?Gower Ramsey? by adjusting carbohydrate sources[J]. Plant Scien-ce,170(6):1133-1140.
Pullman G S,Johnson S,Peter G,Cairney J,Xu N. 2003. Improving loblolly pine somatic embryo maturation:Comparison of somatic and zygotic embryo morphology,germination,and gene expression[J]. Plant Cell Reports,21(8):747-758.
Sherif N A,Kumar T S,Rao M V. 2016. In vitro regeneration by callus culture of Anoectochilus elatus Lindley,an endangered terrestrial jewel orchid[J]. In Vitro Cellular & Developmental Biology-Plant,52:72-80.
(責任编辑 兰宗宝)
