染料木素磺酸钠激活ERK信号调节脑缺血凋亡相关基因的表达
2020-07-06张丽梅虞子宁刘瑞珍曹性玲李良东黄志华
张丽梅,虞子宁,黎 晓,刘瑞珍,曹性玲,李良东,黄志华
(赣南医学院 1.2018级硕士研究生;2.2019级硕士研究生;3.基础医学院;4.第一附属医院,江西 赣州 341000)
脑卒中是目前严重威胁人类健康和寿命的常见疾病,具有极高的致死率和致残率。其中,缺血性脑卒中约占85%[1]。目前缺血性脑卒中的机制较为复杂[2-3],涉及线粒体损伤、钙超载、兴奋性氨基酸的神经毒性、氧自由基累积、炎性反应等病理生理多方面改变。目前已有大量文献表明凋亡与缺血性脑卒中有十分密切的关系[4-6]。因此,抗凋亡干预策略一直是治疗缺血性脑卒中的重要目标。
植物雌激素在学习记忆、突触可塑性以及神经元再生等方面有重要调节作用[7]。染料木素(又名金雀异黄素、染料木黄酮)(genistein, Gen),系植物雌激素的一种,在豆腐、蚕豆、大豆、野葛和羽扇豆等豆类食品中含量较高。研究已证实,染料木素对心、脑血管疾病均有较好保护作用[8-9]。然而,染料木素的水和脂溶性差,生物利用度低,使其临床应用和药物开发受很大限制。为此,我们参照索志荣[10]的方法,对Gen进行磺化,合成了强水溶性化合物——染料木素磺酸钠(genistein-3' -sodium sulfonate, GSS),分子式C15H10O8SNa,为白色结晶粉末。
课题组的前期研究表明,GSS可以通过抑制细胞凋亡进而保护缺血性脑卒中所带来的神经元损伤[11-12],但其作用机制不清楚。胞外信号调节激酶(extracellular signal-regulated kinases,ERK)是将信号从表面受体传导至细胞核的关键。有研究发现,磷酸化激活的ERK可以防止神经功能缺损和神经元死亡,对脑缺血再灌注起保护作用[13-14]。本项目拟探讨GSS是否通过ERK信号抑制细胞凋亡来减轻大鼠脑缺血再灌注损伤。
1 材料与方法
1.1药物与试剂试剂GSS购自上海习氏化工有限公司(上海)。Tris、SDS、30%丙烯酰胺、高效裂解液购自中国索莱宝公司。 Bax、Bcl-2、Caspase 3和GAPDH的一抗及其相应的二抗购自Cell SignalingTechnology(美国加利福尼亚州圣地亚哥)。TRIZzol Reagent购自Ambion公司。反转录试剂盒购自美国Thermofisher。生理盐水(NS)购自Simgen(中国北京)。超高灵敏度化学发光成像系统(GE AI600UV,美国)。荧光定量PCR仪(ABI QuantStudio 7,美国)。
1.2动物SD大鼠,雄性,体重 250~300 g,购自湖南斯莱克景达实验动物有限公司[动物许可证号:SCXK(湘)2016-0002,合格证号43004700048216]。饲养温度为22~25 ℃,相对湿度为50%~60%,饲养笼内干燥清洁,每隔日换垫料1次。自由饮无菌纯净水,自由取用SPF清洁级饲料。所有实验动物购回后至少适应性饲养一周后再进行实验。
1.3 MCAO模型制备及分组
1.3.1大鼠局灶性脑缺血再灌注损伤模型的制备参照LONGA等[15]的方法制备MCAO动物模型,即局灶性脑缺血再灌注损伤模型。SPF级SD大鼠,雄性,体重250~280 g,大鼠用10%水合氯醛溶液(350 mg·kg-1,ip)麻醉,作正中切口,切开皮肤并分层钝性分离皮下组织,用眼科镊轻轻分离颈总动脉、颈外动脉及颈内动脉,于向心端夹闭颈总动脉、远心端夹闭颈内动脉,于远心端结扎并剪断颈外动脉,用眼科剪于颈外动脉作一斜切口,将一尼龙线(长4 cm,线体直径0.26 mm,头端直径0.36 mm)经颈外动脉切口缓慢向颈内动脉入颅方向推进,以颈总动脉分叉处为标记,推进18~20 mm感到轻微阻力时,即达到较细大脑前动脉,阻断大脑中动脉的所有血液供应,缝合皮下组织和皮肤,2 h后,拔出尼龙线至颈外动脉处,并剪去尼龙线残端,完成脑缺血再灌注损伤模型。假手术组大鼠只暴露和分离出颈总动脉、颈外动脉和颈内动脉,并结扎颈内动脉,不闭塞大脑中动脉。术中严格控制室温在23~25 ℃。
1.3.2实验分组及给药方法①将大鼠随机分成3组:采用大鼠大脑中动脉栓塞(MCAO)动物模型,分为假手术组、脑缺血再灌注损伤模型组、模型组+GSS组(2 mg·kg-1)。模型组+GSS组于缺血后10 min分别从舌下静脉注射不同剂量的GSS,假手术组和模型组给予同体积的生理盐水。②将大鼠随机分成5组:采用MCAO动物模型,分为假手术组、脑缺血再灌注损伤模型组、模型组+GSS组(2 mg·kg-1)、模型组+GSS+U0126组、模型组+ U0126组。假手术组、模型组、模型+GSS组在造模前30 min于侧脑室注射溶剂DMSO,模型+GSS+U0126组和模型+U0126组于侧脑室注射U0126,给药量均为1.0 μL。药物治疗组于缺血后10 min分别从舌下静脉注射不同剂量的GSS,假手术组和模型组给予同体积的生理盐水。
1.3.3侧脑室给药方法大鼠麻醉后,剔除头顶部毛发,固定于立体定位仪,按前囟后0.9 mm,颅骨中缝旁开1.6 mm定位后,分离颅顶部皮肤和皮下组织,暴露颅骨和前囟,颅骨钻打孔,微量泵注射器于硬膜下3.0 mm入皮层。参考文献[16]设U0126的剂量为1 μg/只,U0126的浓度为1 μg·μL-1,给药体积为1.0 μL,给药速度0.25 μL·min-1。
1.4 Westernblot方法将大脑皮层组织加入细胞裂解液充分裂解,12 000×g,4 ℃离心5 min,BCA方法行蛋白定量,取50 μg总蛋白加入上样缓冲液煮沸变性,经SDS/PAGE凝胶电泳,然后电转移至NC膜,封闭后,一抗4 ℃过夜,二抗室温孵育1 h,增强化学发光试剂孵育1 min后曝光、显影和定影,对结果进行吸光度扫描分析,并与对照组结果进行对比。
1.5 Realtime-PCR方法TRIzol提取总RNA,酶标仪测总RNA的浓度和纯度,取4 μg RNA样本,RNA逆转录为cDNA:反应板置冰上,向反应孔加入cDNA 2 μL、1x SYBR10 μL,10 μM引物2 μL,加超纯水至20 μL。反应条件:95 ℃预变性20 min,95 ℃变性10 s,61 ℃退火20 s,72 ℃延伸25 s,共40个循环。引物:Bax: 5' TGGTTGCCCTTTTCTACTTTGC 3', 5' CAGCCACAAAGATGGTCACTGTC 3';Bcl-2: 5' CTGTGGATGACTGAGTACCTGAACC 3', 5' AGACAGCCAGGAGAAATCAAACAG 3';Caspase3:5' GAACGAACGGACCTGTGGAC 3', 5' AACCATGACCCGTCCCTTG 3';B-Actin:5' TGTGACGTTGACATCCGTAAAGAC 3', 5' GGACTCATCGTACTCCTGCTTG 3'。
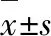
2 结 果
2.1 GSS对缺血再灌注损伤大鼠皮层半损伤区ERK的激活作用如图1所示,与对照组相比,模型组p-ERK的蛋白表达水平明显降低,经GSS治疗后p-ERK的蛋白表达水平显著升高。

图1 GSS对缺血半损伤区ERK蛋白及磷酸化蛋白表达水平的影响
2.2 U0126阻断了GSS对凋亡相关基因表达的调节作用如图2所示,模型组与对照组相比,Bax和Caspase 3的mRNA水平明显升高, Bcl-2的mRNA水平明显降低;经GSS(2 mg·kg-1)治疗后, Bax和Caspase3的mRNA水平显著下降, Bax的mRNA水平显著升高。结果表明,GSS可抑制凋亡对脑缺血起保护作用。与单纯GSS治疗组相比,经侧脑室给予ERK抑制剂(U0126)后, Bax和Caspase 3的mRNA水平明显升高,Bcl-2的mRNA水平明显降低。可见,U0126阻断了GSS对MCAO大鼠凋亡相关基因的调节作用。
图2 U0126和GSS对缺血半损伤区Bax、Bcl-2和Caspase 3mRNA表达的影响
3 讨 论
神经元凋亡是缺血性脑卒中的病理特征性改变之一。Bcl-2基因家族是目前较公认与凋亡密切相关的基因,在神经系统中,Bcl-2和Bax是细胞凋亡的标记因子[17],Bcl-2有抑制凋亡的作用,Bax则起促进凋亡的作用:若Bcl-2表达增多,形成Bcl-2-Bcl-2同源二聚体或形成Bcl-2-Bax异源二聚体时,起抑制细胞凋亡的作用;若Bax表达增多,则形成Bax-Bax同源二聚体,起促进细胞凋亡的作用,同时损伤线粒体,并介导细胞色素C及其他促凋亡蛋白释放到细胞质,最终诱发Caspase依赖性死亡和非依赖性死亡。Caspase-3是调控细胞凋亡的关键蛋白[18]。在细胞凋亡阶段发生的级联反应中凋亡信号将其激活,裂解相应的胞浆和胞核底物,最终导致细胞 DNA 损伤和细胞凋亡[19]。我们的前期研究结果表明,GSS可以保护MCAO模型诱导的脑损伤,其涉及的潜在机制是增加Bcl-2/Bax表达率以及降低Caspase3活性,进而抑制细胞凋亡[12]。
ERK信号通路参与细胞的多种生物学过程,包括细胞增殖、迁移、分化和死亡[20]。大多数研究证实,神经细胞中的ERK信号通路具有抗凋亡的作用,它的下游包含了凋亡相关蛋白(Bcl-2、Bax等),在缺血性脑卒中发挥了重要作用。我们的结果显示:给予GSS治疗后p-ERK的蛋白表达水平明显增加,提示GSS可能通过提高ERK的活化,减轻脑缺血再灌注诱导的神经元损伤。为了证明GSS是否通过ERK调节凋亡相关蛋白的表达,我们用了ERK抑制剂干预GSS的作用,结果显示,U0126阻断了GSS对凋亡相关基因表达的调节作用,说明GSS很可能是通过ERK信号调节凋亡相关基因的表达起保护作用。
综上所述,GSS可能通过激活ERK信号通路,抑制促凋亡相关基因Bax和Caspase3的表达,升高抑凋亡相关蛋白Bcl-2的表达,进而抑制缺血性脑卒中损伤后的细胞凋亡,从而减轻神经元损伤。本项目研究为开发一种新型抗凋亡药物来治疗缺血性中风提供了实验依据,但是GSS是如何激活ERK信号进而调控细胞凋亡仍然有待研究。
