IRF3/7在葡聚糖硫酸钠诱导结肠炎中的作用机制研究
2020-07-06沈镇平刘雨霞刘志平
王 斐,谢 璐,沈镇平,刘雨霞,刘志平
(赣南医学院 1.2017级硕士研究生; 2.基础医学院;3.2015级生物技术本科生;4.炎症与免疫中心,江西 赣州 341000)
炎症性肠病(Inflammatory bowel diseases, IBDs),包括克罗恩病和溃疡性结肠炎,是一种以慢性肠道炎症为特征的疾病[1]。IBD在发达国家比较常见,近20年来,在中国的发病率也呈持续上升的状态[2]。由于IBD发病机制不清楚,复发率高,极大影响患者及其家属的生活质量[3],因此研究IBD的发病机制迫在眉睫[4]。
干扰素调节因子家族(Interferon regulatory factors, IRFs)是共同含有一个保守的N端DNA结合域(DBD)和一个IRF相关结构域(IAD)的转录因子家族[5],在哺乳动物中由9个成员组成:IRF1-IRF9。IRFs参与机体细胞凋亡、肿瘤发生、宿主防御、病毒潜伏和免疫反应等多种生物学功能的调节[6]。其中IRF3和IRF7在I型IFN介导的先天免疫中起着关键作用[7]。IRF3和IRF7是异源二聚体,但这两个因子在很多方面发挥着不同的作用。IRF3组成性表达在多种类型的细胞中,主要存在于细胞质中,诱导感染早期Ⅰ型IFN-β转录[8]。IRF7主要存在于B细胞、浆细胞样树突状细胞(PDC)和单核细胞中,低表达在其他大多数细胞中,且需要IFN-α激活进而再诱导更多的IFN-α[9]。
研究显示,DSS诱导的结肠炎小鼠结肠组织中IRF3、IRF7基因表达量升高;IRF3-/-小鼠对葡聚糖硫酸钠(Dextran sodium sulfate, DSS)诱导的结肠炎的易感性增加[10]。这提示IRF3缺失可能与IBD的发生相关。但IRF3/7与IBD之间的关系尚不明确。为进一步确定IRF3/7-/-小鼠对DSS诱导的结肠炎的易感性,并探讨IRF7是否与IFR3通过相同的信号通路在结肠炎的发生发展中起作用,本研究利用DSS饲喂IRF3/7-/-小鼠构建结肠炎模型,探讨IRF3/7在结肠炎发生发展中的作用和可能机制。
1 材料与方法
1.1材料
1.1.1动物WT使用购于南京模式动物研究所的C57BL/6小鼠,IRF3/7-/-小鼠由中科院昆明动物所齐晓朋研究员提供,均饲养于赣南医学院实验动物中心。
1.1.2试剂DSS购自美国MP Biomedicals公司;Sybergreen 试剂盒购自美国赛默飞;TSLP-ELISA试剂盒、IL-33-ELISA试剂盒均购自武汉博世德生物工程有限公司。
1.2方法
1.2.1小鼠生存率由致炎剂DSS诱导小鼠产生结肠炎,实验组为IRF3/7-/-小鼠,对照组为WT小鼠,第0天在饮用水加入3%DSS,5天后撤DSS,换正常饮用水继续喂养。记录各组小鼠在0~10天的生存率。
1.2.2小鼠结肠炎模型造模方法第0天将小鼠的饮用水加入2%的DSS,喂5天后撤DSS,换正常饮用水继续喂养。记录各组小鼠在第0、3、5、6、7、8天的体重。并分别在0、3、5、8天这4个结肠炎发生发展最典型的时间点处死小鼠测量结肠长度、称量脾脏重量并采集结肠组织。
1.2.3 PCR测定目标基因表达在特定时间收集肠道样品,使用Trizol 分离RNA,反转录成cDNA, 然后通过目标基因如细胞因子的特定引物,使用 Sybergreen 试剂盒检测炎症细胞因子TNF-α、IL-6、IL-1β、MCP-1及TLSP、IL-33的基因表达情况。见表1。

表1 引物序列
1.2.4 ELISA测定目标蛋白表达对小鼠结肠组织进行匀浆,14 000 rpm 离心,取上清。按ELISA试剂盒方法,使用样品稀释液对结肠提取蛋白样品进行稀释,加样,37 ℃孵育,加入酶标抗体孵育后加入底物液显色,最后加入终止液,于450 nm处测定OD值。
1.3统计学分析采用Graph Pad Prism 7.0软件进行数据分析。数据用均数±标准误表示。生存率用Log-rank检验。组间比较采用单因素方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1IRF3/7-/-小鼠对DSS诱导产生的结肠炎高度易感我们首先检测WT和IRF3/7-/-小鼠在较高浓度的DSS诱导结肠炎的生存率。发现在3% DSS喂养条件下,在DSS喂养5天后IRF3/7-/-小鼠有明显的致死现象,表现为便血严重,体重急速下降。到第8天时IRF3/7-/-小鼠开始出现死亡,到第10天死亡60%,而WT小鼠在这个浓度DSS中全部存活(图1A)。之后我们将DSS的浓度调整为2%,重新建立结肠炎模型,发现IRF3/7-/-小鼠在DSS撤药后虽然不死亡,但体重下降较WT严重(图1B),并且小鼠呈现萎蔫状态。在不同时间点收集小鼠的结肠组织,测量长度发现IRF3/7-/-小鼠随着炎症越严重,结肠的长度缩短的程度越高,在第5天和第8天与WT小鼠相比有很明显差异(图1C)。同时脾脏重量结果显示IRF3/7-/-小鼠在DSS处理第5天比WT小鼠脾脏更大,进一步支持IRF3/7-/-小鼠对DSS诱导产生的结肠炎更易感(图1D)。
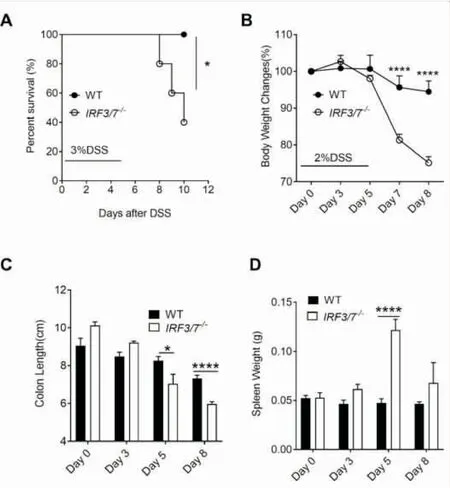
图1 IRF3/7-/-小鼠对DSS诱导产生的结肠炎高度易感
A:3% DSS喂养后各组小鼠生存率;WT和IRF3/7-/-, 每组n=5。B:2% DSS喂养后各组小鼠的体重变化;WT和IRF3/7-/-, 每组n=6。C:2% DSS喂养后各组小鼠的结肠长度;WT和IRF3/7-/-, 每组n=5~7。D:2% DSS喂养后各组小鼠的脾重情况WT和IRF3/7-/-, 每组n=5~7。注:*P<0.05; ****P<0.0001。
2.2炎症细胞因子的表达量测定我们在不同时间点收集小鼠结肠组织,使用qPCR检测炎症细胞因子的表达情况。IL-6和TNF-α是由单核巨噬细胞分泌产生的细胞因子,是IBD中相关的主要促炎介质[11]。在本次实验中我们发现IL-6和TNF-α基因表达在结肠炎中呈上调趋势,并且IRF3/7-/-小鼠的TNF-α的表达量在第8天比WT小鼠显著升高(图2 A,B)。我们也检测了其他炎症细胞因子IL-β和MCP-1的表达,在DSS处理后第5天,也是结肠炎出现的时间点,IRF3/7-/-小鼠结肠中IL-1β和MCP-1的表达量显著性高于WT小鼠(图2 C, D)。
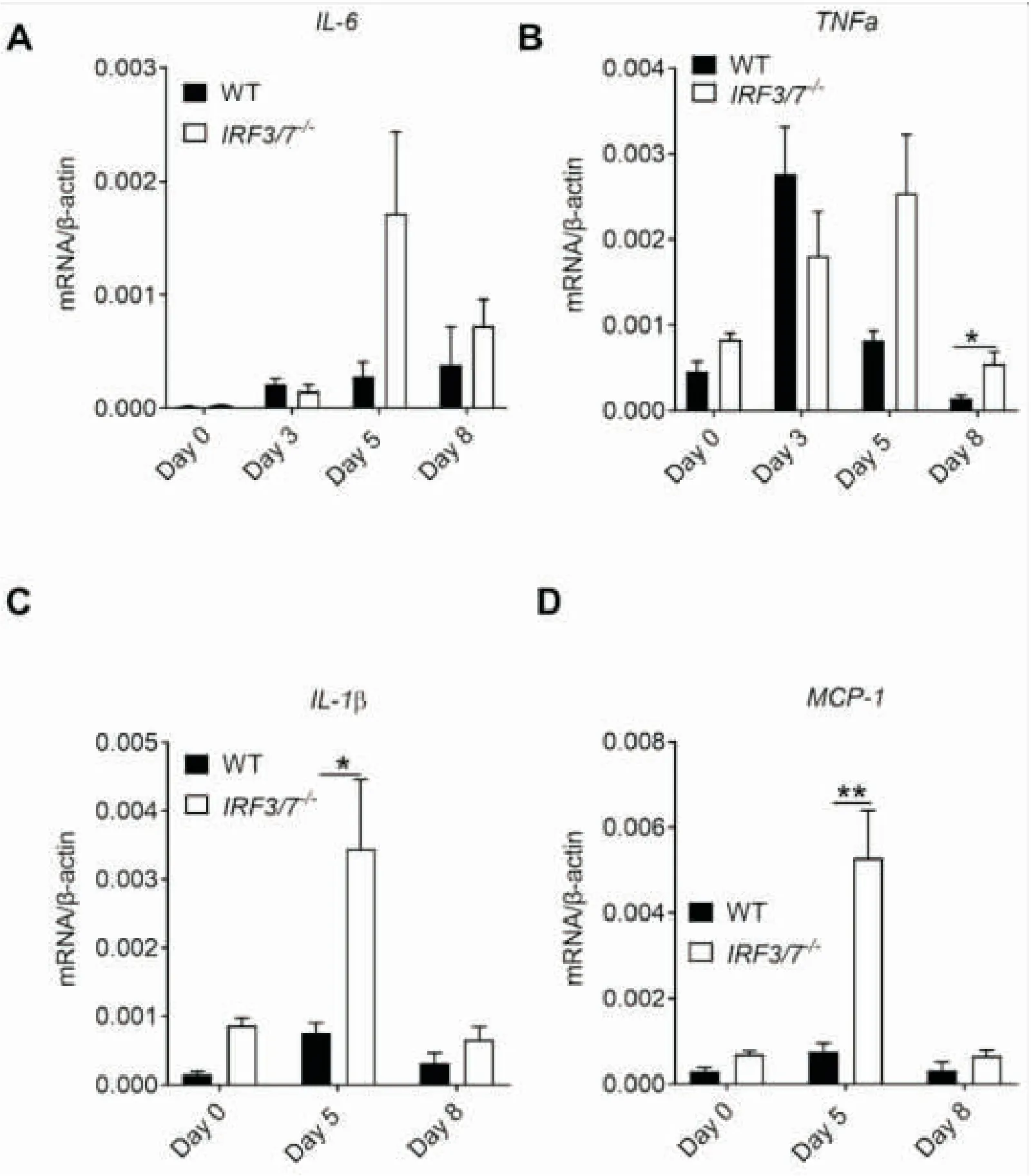
图2 IRF3/7-/-小鼠结肠组织中炎症细胞因子的表达
A:2% DSS处理后各组小鼠不同时间点的结肠组织中IL-6的表达量。B:TNF-α基因的表达量。C:IL-1β基因的表达量。D:MCP-1基因的表达量。注:WT和IRF3/7-/-, 每组n=4~8;*P<0.05,**P<0.01。
2.3IRF3/7-/-小鼠TSLP和IL-33的表达量在结肠炎症阶段明显更高TSLP和IL-33都是已知对结肠有保护作用的细胞因子,在结肠炎症恢复期起很重要的作用。IRF3-/-小鼠在DSS诱导的结肠炎的炎症和恢复期,伴有TSLP和IL-33生成的缺陷[10]。本次研究的实验组为IRF3/7-/-小鼠,通过结肠组织提取RNA检测TSLP的表达量发现,IRF3/7-/-小鼠炎症时期(第5天)结肠组织中TSLP基因相对与同期WT小鼠不但没有缺陷,而且有着更高趋势的表达水平(图3A)。IL-33结果显示IRF3/7-/-小鼠炎症时期(第5天)结肠组织中IL-33基因相对与同期WT小鼠也没有缺陷,并且有显著性上调(图3B)。为了进一步确认,我们利用ELISA检测TSLP和IL-33的蛋白表达。与qPCR的结果一致,在结肠炎症时期IRF3/7-/-小鼠的TSLP和IL-33的表达没有缺陷,在第8天IL-33比WT还更高(图3C,3D)。这提示IRF3/7在结肠炎所介导的作用不依赖于TSLP和IL-33, 这一点可能与IRF3的作用机制不同。
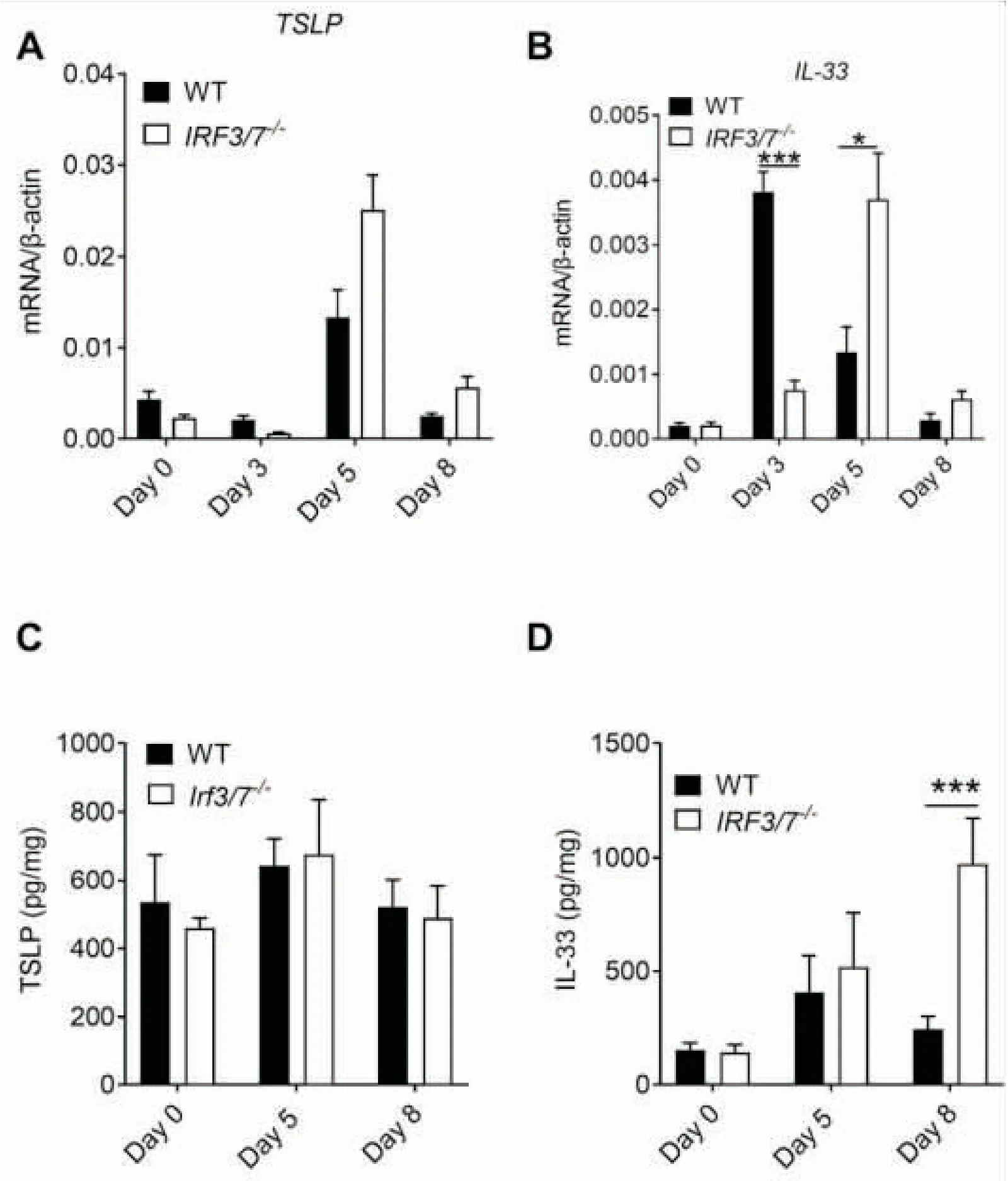
图3 IRF3/7-/-小鼠结肠TSLP、IL-33基因和蛋白的表达
A:不同时间点结肠中TSLP的基因表达情况(PCR法)。B: 不同时间点结肠中IL-33的基因表达情况(PCR法)。C:不同时间点结肠中TSLP蛋白表达情况(ELISA法)。D:不同时间点结肠中IL-33蛋白表达情况(ELISA法)。注:WT和IRF3/7-/-, 每组n=4~8;*P<0.05, ***P<0.001。
3 讨 论
尽管IBD的发生机制至今未明,但DSS因其诱导的急性结肠炎具有溃疡性结肠炎中炎症和溃疡的典型组织学特征而被广泛应用于结肠炎动物模型[12]。本研究利用DSS建立的小鼠结肠炎模型,探讨IRF3、IRF7与结肠炎的关系。结果显示,IRF3/7-/-小鼠对DSS诱导的结肠炎十分易感,表现在比WT小鼠有更高的死亡率,且结肠长度缩短更为严重。结肠组织匀浆中TNF-α、IL-6、TSLP和IL-33在炎症刺激第5天和第8天的基因表达和蛋白含量较WT组明显升高。
IRF3和 IRF7都是调节Ⅰ型干扰素的重要转录因子,能够控制Ⅰ型干扰素(IFN-α和IFN-β)的产生[13]。但是,IRF3和IRF7调节Ⅰ型干扰素的机制可能不同,有研究表明IRF3具有有限的DNA结合位点特异性,而IRF7具有更广泛的DNA结合特异性,有助于其刺激延迟型IFN基因表达[14]。IRF3在细胞组成性表达,是病毒感染早期反应的重要组成部分[15-16],IRF3的过度表达显著增强了病毒介导的IFN-α/β基因的表达[17]。IRF7不在细胞中组成性表达,而是由IFN、LPS或者病毒感染诱导表达[18]。且文献表明,IRF7在TLR7/9/MyD88信号通路中起调控作用[19]。如果IRF7缺失,IFN-α的产生严重受损,而MyD88缺失IFN-α的产生并不受影响,提示IRF7在诱导Ⅰ型IFN-α的通路中起重要作用[20]。前期研究表明在IRF3-/-小鼠结肠炎的炎症期和恢复期,伴有TSLP和IL-33生成的缺陷[10]。但在本次研究中发现IRF3/7-/-小鼠结肠组织中TSLP和IL-33的基因表达和蛋白含量较WT组明显升高,趋势与IRF3-/-小鼠不一致,提示在DSS诱导的结肠炎中IRF3和IRF7的作用机制和所介导的信号通路可能不同,也即是IRF7可能介导特异的信号通路。
综上所述,IRF3/7-/-小鼠对DSS诱导的结肠炎有更为易感的趋势,并且在结肠炎发生发展中IRF3/7-/-小鼠在肠道炎症细胞因子比WT小鼠明显上调。说明IRF3/7对结肠炎均有保护作用。但是,与IRF3-/-小鼠不同,IRF3/7-/-小鼠在肠道TSLP和IL-33的表达无明显缺陷,提示IRF7与IRF3在结肠炎中的作用机制可能不一样。研究IRF7和IRF3在机体抵抗结肠炎中的不同作用有利于我们了解IBD发生的复杂机制。
