尿酸对大鼠肾细胞线粒体损伤及Pgam5/Drp1表达的影响*
2020-07-06封宝红张艳霞朱戈丽巩雪敏毕智敏胡曼莉
封宝红,伍 军,张艳霞,朱戈丽,巩雪敏,毕智敏,胡曼莉
(武汉市第三医院肾内科,湖北武汉430060)
高尿酸血症(hyperuricemia,HUA)是慢性肾脏病最常见的并发症之一。随着我国居民生活水平的提高和方式的改变,HUA患病率逐年上升,发展为我国重要的公共卫生问题之一[1]。我国慢性肾脏病患者的HUA患病率为36.6%~50.0%,且HUA成为肾功能进展的独立危险因素[2]。HUA具有体内嘌呤代谢紊乱、尿酸增高等病理特征,当尿酸在肾脏中长期积累,可造成肾实质损伤,称为尿酸性肾病[3-4]。近年来,线粒体功能障碍在急性肾病和慢性肾病中的重要性受到越来越多人的重视[5-7]。研究显示,线粒体DNA(mitochondrial DNA,mtDNA)稳定性与人类多种疾病相关[8]。受损的线粒体将其DNA释放到循环系统中,血清和尿中mtDNA水平可能是肾脏疾病的生物标志物[9]。前期研究结果显示,尿酸引起的大鼠肾小管上皮细胞损伤中,胞内线粒体功能障碍,活性氧簇(reactive oxygen species,ROS)增加,膜电位降低,细胞凋亡增加[10]。磷酸甘油酸变位酶家族成员 5(phosphoglycerate mutase family member 5,Pgam5)作为一种线粒体蛋白,在细胞凋亡和坏死过程中起关键作用,可介导线粒体发动蛋白相关蛋白1(dynamin-related protein 1,Drp1)参与调控细胞凋亡[11]。为了进一步探讨尿酸在肾细胞中引起损伤的机制,本研究将从线粒体损伤及Pgam5/Drp1表达变化的角度进行阐述。
材料和方法
1 材料
大鼠肾细胞NRK-52E由中国科学院细胞库提供。DMEM培养基(HyClone);胎牛血清(Gibco);DMSO和尿酸(Sigma);MTT、Hoechst 33258染液、兔抗Drp1抗体(用于免疫荧光染色和Western blot检测)、兔抗Pgam5抗体(用于Western blot检测)、兔抗GAPDH抗体和抗荧光淬灭封片液(Bioswamp);Annexin V-FITC/PI凋亡检测试剂盒(BD);兔抗Pgam5抗体(Biorbyt);线粒体提取试剂盒(Solarbio);细胞质和核RNA提取试剂盒(Borgen Biotek);反转录试剂盒(TaKaRa);SYBR Green PCR试剂盒(KAPA Biosystems)。
2 方法
2.1 细胞培养及分组 将细胞从液氮罐中取出,将细胞悬液转移至离心管中,1 000 r/min离心3 min,弃上清,加入1 mL DMEM培养基悬浮细胞,转移培养瓶中,再加入4 mL含10%胎牛血清的DMEM进行培养,2~3 d换液1次。收集对数生长期细胞,调整细胞浓度接种于96孔板中,每孔180 μL,每孔5×103个细胞。将细胞分为正常组和尿酸干预组,每组设置3复孔,分组干预后置于37℃、5%CO2培养箱中继续培养24 h后进行实验检测。尿酸干预组处理:根据前期研究结果[7],选择浓度为0.6 mmol/L的尿酸干预。2.2 MTT法检测细胞活力 分组处理细胞24 h后,取出细胞培养板,每孔加入20 μL浓度为5 g/L的MTT溶液,继续培养4 h。弃上清,每孔加入150 μL DMSO溶液,摇床低速振荡15 min,充分溶解结晶物。酶标仪检测490 nm处各孔吸光度(A490),比较对照组和尿酸干预组的细胞活力。
2.3 Hoechst 33258染色 分组处理细胞24 h后,加入4%多聚甲醛固定细胞10 min。弃固定液,PBS洗涤2次,加入少量Hoechst 33258染液,覆盖细胞即可,染色5 min。弃染液,PBS洗涤5次,于荧光显微镜下观察细胞形态及凋亡情况。
2.4 流式细胞术检测细胞凋亡 胰蛋白酶消化细胞,制备细胞悬液,收集至离心管中,1 000 r/min离心5 min。加入PBS重悬细胞,取5×105个细胞,1 000 r/min离心5 min。弃上清,加入1 mL预冷PBS重悬细胞,1 000 r/min 离心 5 min。弃上清,加入 200 μL binding buffer重悬细胞,加入10 μL Annexin V-FITC和 10 μL PI,混匀后,避光孵育 30 min。加入300 μL binding buffer,进行流式细胞术检测。
2.5 透射电镜观察 收集消化后的细胞,PBS清洗2次,1 000 r/min离心5 min。PBS重悬,取1×106个细胞使用2.5%戊二醛4℃预固定45 min,再采用1%锇酸固定。梯度乙醇脱水后,丙酮、环氧树脂浸透,加入包埋剂,放入聚合包埋箱聚合。切成超薄切片,双染法染色,送至武汉大学人民医院电镜室进行透射电镜观察拍照。
2.6 RT-qPCR检测mRNA表达 采用线粒体提取试剂盒提取细胞线粒体:取5×107个细胞,冰浴研磨30~40次,将细胞匀浆转移至离心管中,10 000 r/min离心5 min,取上清;10 000 r/min离心5 min,取上清;12 000 r/min离心10 min,离心后的上清用于提取细胞质基质蛋白,而管底沉淀为线粒体。再采用细胞质和核RNA提取试剂盒提取线粒体RNA,反转录试剂盒将RNA反转录为cDNA,以cDNA为模板进行PCR扩增。Pgam5的正向引物序列为5’-ACCTGAAGAAAAGGAACG-3’,反向引物序列为5’-TCATAGAGGAATGGACGAT-3’;GAPDH的正向引物序列为5’-CAAGTTCAACGGCACAG-3’,反向引物序列为 5’-CCAGTAGACTCCACGACAT-3’。引物由武汉天一辉远生物科技有限公司合成。
2.7 免疫荧光染色 将各组细胞消化制成单细胞悬液,将1×108/L细胞接种至放有盖玻片的24孔板中,培养过夜。PBS洗涤2次,加入4%多聚甲醛固定30 min。PBS洗涤3次,加入0.5%Triton X-100室温下通透20 min。PBS洗涤3次,加入5%BSA室温封闭1 h,PBS洗涤后,取出盖玻片,加入I抗稀释液(抗Pgam5和Drp1抗体稀释比1∶200),湿盒内室温孵育1 h。PBS洗涤3次,加入Alexa Fluor 594标记的II抗稀释液,室温孵育1 h,PBS洗涤5次。取出一块载玻片,滴加一滴含DAPI的抗荧光淬灭封片液,将盖玻片贴在载玻片上,于荧光显微镜下观察。
2.8 Western blot检测蛋白水平 提取各组细胞质基质蛋白,定量后以20 μg蛋白上样量进行SDSPAGE。将蛋白转至PVDF膜,5%脱脂奶粉封闭液室温封闭2 h。加入I抗(抗Pgam5、Drp1和GAPDH抗体稀释比1∶1 000),室温孵育1 h,PBS洗涤3次。加入HRP标记的II抗,室温孵育1 h,PBS洗涤3次。将膜置于暗室中,滴加化学发光试剂,与膜充分接触后,将膜置于全自动化学发光分析仪中检测。
3 统计学处理
采用SPSS 22.0软件进行统计学分析,GraphPad Prism 5.0软件进行统计图绘制。每组实验均进行3次重复,计量资料以均数±标准差(mean±SD)表示,两组间比较采用t检验,以P<0.05表示差异具有统计学意义。
结 果
1 尿酸对肾细胞活力的影响
MTT法检测细胞活力,与正常组细胞比较,经过尿酸干预24 h后的NRK-52E细胞的活力显著降低(P<0.01),见图1。

Figure 1.The effect of uric acid on the viability of NRK-52E cells.Mean±SD.n=3.**P<0.01 vs normal group.图1 尿酸对NRK-52E细胞活力的影响
2 尿酸对肾细胞形态及凋亡的影响
采用Hoechst 33258染色观察细胞形态,发现正常组细胞大部分细胞呈圆形或椭圆形,细胞核呈均匀蓝色荧光,出现极少浓染致密的细胞碎片,呈亮蓝色,即为凋亡小体;尿酸干预组细胞形态异常,出现大量亮蓝色细胞碎片,即凋亡小体增多,见图2A。采用流式细胞术检测了各组细胞凋亡水平,统计Q2-2和Q2-4细胞凋亡率,结果显示尿酸干预组细胞凋亡率显著高于正常组(P<0.01),见图2B。
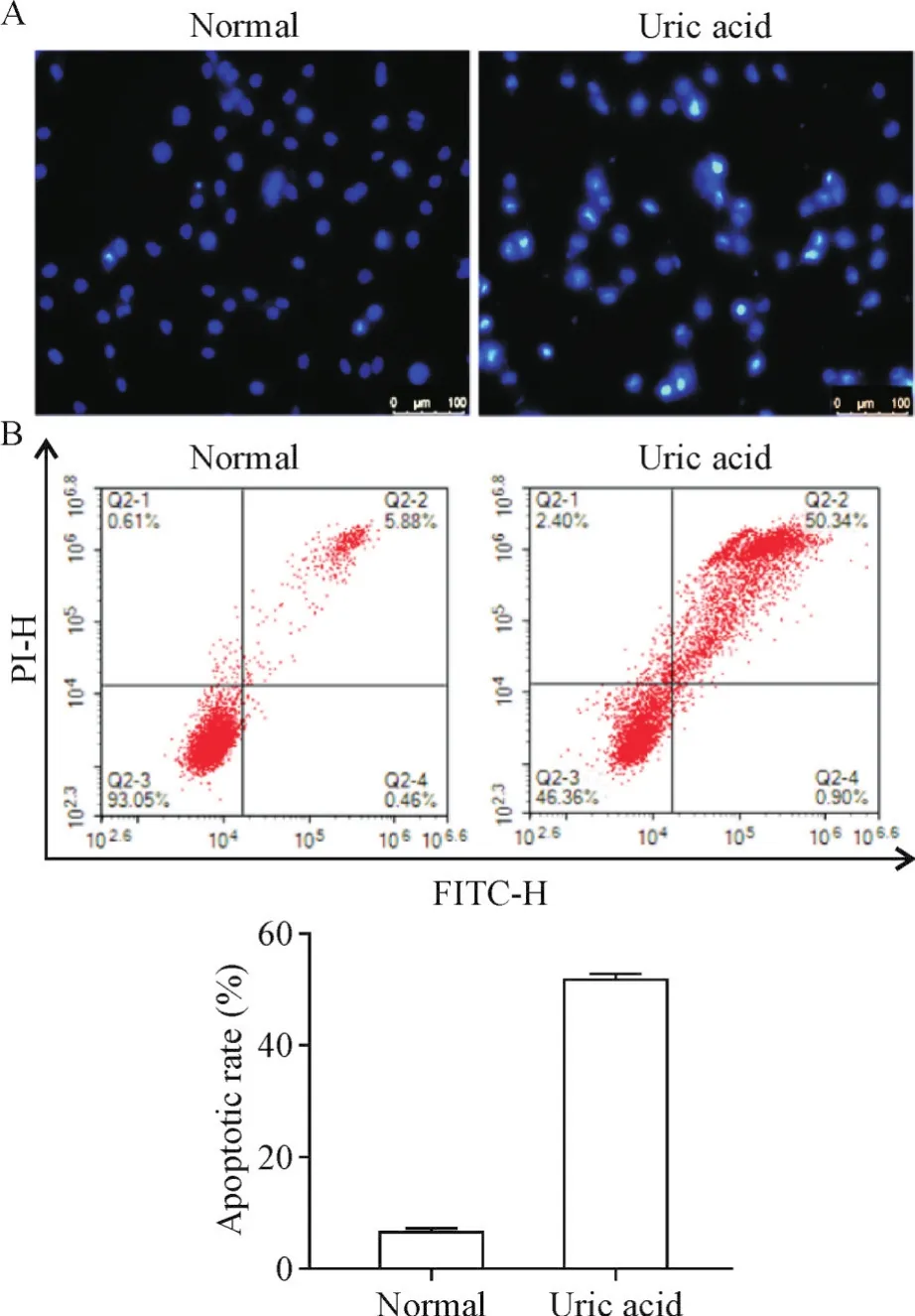
Figure 2.The morphological observation(A;×200)and apoptotic rate detection(B)of the NRK-52E cells after treated with uric acid.Mean±SD.n=3.**P<0.01 vs normal group.图2 NRK-52E细胞形态观察及凋亡率检测
3 尿酸对肾细胞线粒体形态结构的影响
透射电镜下观察细胞线粒体形态变化,正常组细胞线粒体形态正常,嵴结构完整;尿酸干预组线粒体肿胀、空泡化,且嵴结构被破坏,出现断裂,见图3。

Figure 3.The morphological changes of mitochondria in the NRK-52E cells treated with uric acid observed under transmission electron microscope(×5 000).图3 透射电镜观察NRK-52E细胞线粒体形态结构的变化
4 尿酸对肾细胞Pgam5和Drp1表达的影响
免疫荧光染色结果显示,经过尿酸干预后的NRK-52E细胞中Pgam5和Drp1阳性表达增加,见图4。RT-qPCR和Western blot结果显示,与正常组比较,尿酸干预组细胞线粒体中Pgam5的mRNA表达显著降低(P<0.01),而细胞质基质中Pgam5和Drp1的蛋白表达均显著升高(P<0.01),见图5。

Figure 4.The expression of Pgam5 and Drp1 in the NRK-52E cells with immunofluorescence staining(×200).图4 NRK-52E细胞Pgam5和Drp1阳性表达的免疫荧光观察

Figure 5.The mRNA expression of Pgam 5 in mitochondria(A)and the protein expression of Pgam 5 and Drp1 in cytoplasmic matrix(B)in theNRK-52E cells treated with uric acid.Mean±SD.n=3.**P<0.01 vs normal group.图5 NRK-52E细胞线粒体Pgam5的mRNA表达及细胞质基质中Pgam5和Drp1的蛋白表达情况
讨 论
细胞凋亡是一种自发性、程序性死亡过程,在人类健康和疾病中起着关键的作用[12]。细胞的凋亡是所有多细胞生物控制细胞增殖和维持组织内稳态的重要机制,当凋亡失调时可能导致多种疾病的发生[13]。本研究结果显示,尿酸干预NRK-52E细胞后,细胞增殖率降低,凋亡率升高,细胞形态异常。细胞凋亡过程受多种通路调控,其中,细胞线粒体介导的内源性凋亡通路为凋亡发生的主要机制之一[14]。为了进一步了解尿酸引起肾细胞凋亡的作用机制,我们使用透射电镜观察细胞线粒体,发现尿酸干预使NRK-52E细胞线粒体出现空泡化,且嵴结构受到破坏,而线粒体的形态变化、线粒体网络的断裂及线粒体嵴的重塑与细胞凋亡的发生密切相关[15],因此推测尿酸可能通过线粒体途径诱导肾细胞凋亡。
线粒体是一种多功能细胞器,可储存能量并参与细胞多种应激反应过程,其本身也不断受到ROS的刺激,而过度的ROS可引起蛋白质修饰、mtDNA损伤等,最终导致线粒体功能障碍[16]。Pgam5是一种分子大小为32 kD的线粒体膜蛋白,研究显示,Pgam5通过独立促进线粒体有丝分裂来保护细胞,避免细胞发生坏死[17]。而另一方面,线粒体应激可导致内源性Pgam5从受损的线粒体中释放至细胞质基质中,与其他蛋白结合发挥作用[18-19]。Pgam5可促进Bax向线粒体易位和Drp1去磷酸化,形成的Bax-Pgam5-Drp1复合物是执行线粒体内源性细胞凋亡所必需的[20-21]。Drp1是发动蛋白超家族的一种尿苷三磷酸(uridine triphosphate,GUP)酶,以二聚体和四聚体形式存在于细胞质基质中,被线粒体外膜上的受体招募至线粒体,具有催化细胞内线粒体分裂的作用[22]。Wang 等[23]免疫共沉淀结果显示 Drp1 可与Bax结合,是Bax线粒体易位必需的结合蛋白。Bax线粒体转移,导致线粒体膜电位降低以及结构发生变化,促进线粒体释放细胞色素C,引发下游的级联反应,从而诱导线粒体内源性凋亡途径的激活[24]。本研究结果显示,尿酸干预后NRK-52E细胞线粒体中Pgam5 mRNA表达降低,而在细胞质基质中Pgam5和Drp1蛋白表达显著升高。
综上所述,本研究结果提示尿酸诱导可肾细胞破坏线粒体形态、结构,上调细胞质基质中Pgam5/Drp1表达,诱导细胞凋亡。因此,通过高浓度尿酸干预肾细胞模拟尿酸性肾病病理模型而探讨尿酸干预机制将为尿酸性肾病的防治提供一定的理论基础。值得注意的是,在Hoechst 33258染色中未观察到尿酸处理后细胞核异常现象,但在免疫荧光染色中发现个别细胞出现细胞核异常增大,因此推测尿酸可能对肾细胞核产生影响,但引起该变化的机制我们尚不清楚,将在进一步的研究中进行探讨。
