TL1A通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生*
2020-07-06尹凤荣战蓉蓉张晓岚
尹凤荣, 战蓉蓉, 王 冬,宋 佳,李 辉,张 红,张晓岚
(河北医科大学第二医院消化内科,河北省消化病重点实验室,河北省消化病研究所,河北石家庄050035)
肠纤维化是炎症性肠病(inflammatory bowel disease,IBD)的严重并发症,持续的炎症反应可引起肠道黏膜反复损伤、修复,最终导致瘢痕形成及肠壁纤维化,肠腔狭窄或梗阻以及脓肿等并发症,严重影响着患者生活质量。而炎症性肠病导致肠纤维化的机制尚未完全明确,并且目前的主要治疗药物仍然缺乏能够有效抑制或逆转肠纤维化的方法。肠纤维化的发生是一个复杂、动态的过程,目前认为是在易感基因基础上出现了肠黏膜免疫失衡,释放多种炎症因子和生长因子激活肠道间质细胞进而产生胶原等细胞外间质(extracellular matrix,ECM)成分过度沉积,最终导致肠纤维化[1]。
作为肠道炎症反应的中心环节,CD4+T细胞在调控体内免疫应答和维持免疫平衡稳定中发挥重要作用,其中,辅助性T细胞(T helper cells,Th)又包含Th1、Th2及Th17等3种细胞亚群。Th1细胞主要分泌干扰素γ(interferon-γ,IFN-γ),而Th17细胞主要分泌白细胞介素17(interleukin-17,IL-17)。肿瘤坏死因子样配体1A(tumor necrosis factor ligand-related molecule 1A,TL1A)可通过影响肠黏膜T细胞的活化、增殖,促进Th1细胞的极化及效应功能,上调IFN-γ的表达,从而促进肠黏膜的炎症反应和纤维化的发生[2,4]。同时,TL1A还可作用于 Th17细胞使其分泌IL-17增加,导致肠黏膜免疫失调引发肠道炎症反应,而慢性炎症反应是肠纤维化发生的首发因素,炎症反应可进一步激活肠成纤维细胞的活化,产生大量ECM,以致肠纤维化的形成。因此,TL1A可能通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生。
材料和方法
1 实验动物
野生型C57BL/6小鼠,体重20~22 g,8~10周龄,清洁级,由河北医科大学实验动物中心提供(合格证编号为911102)。TL1A过表达的转基因(LCK-CD2-TL1A-transgenic)小鼠,体重20~22 g,8~10周龄,清洁级,种鼠由美国Cedars-Sinai医学中心IBD与免疫生物学研究中心赠予,后期由我方在层流动物实验室饲养繁殖并进行鉴定。
2 主要试剂及仪器
髓过氧化物酶(myeloperoxidase,MPO)试剂盒购自南京建成生物工程研究所;ELISA试剂盒购于联科生物技术有限公司;抗CD4、IL-17和IFN-γ抗体及同型对照抗体购自BD。FACSAriaⅡ流式细胞分选仪购自碧迪医疗器械(上海)有限公司;FV12-IXCOV激光共聚焦显微镜购自OLYMPUS。
3 方法
3.1 动物模型的建立与实验分组 将转基因(transgene,Tg)小鼠与 C57BL/6野生型(wild type,WT)小鼠随机分为DSS/WT组、DSS/Tg组、control/WT组和control/Tg组,每组6只。Control组给予饮用蒸馏水,DSS组给予间断饮用2%DSS,分别为第1~5天、第8~12天、第15~19天、第22~26天、第27和28天,其余时间均饮用蒸馏水,第29天先应用乙醚麻醉小鼠,然后断颈处死小鼠。
3.2 疾病活动指数(disease activity index,DAI) 每天观察小鼠的进食情况、体重变化、大便的性状、精神状态、毛发光泽程度和活动情况等。以DAI评分的标准,见表1,评估小鼠的粪便性状,每日的体重及大便潜血情况,并记录评分。

表1 DAI评分的标准Table 1.The DAI scoring criteria
3.3 结肠炎症程度评估 采用HE染色观察结肠组织学损伤,并参照Cooper等[5]评分标准,见表2进行。MPO检测试剂盒检测结肠组织MPO活性。
3.4 分离并提取肠黏膜固有层单个核细胞(lamina propria mononuclear cells,LPMC)及脾脏和肠系膜淋巴结(mesenteric lymph nodes,MLN)单个核细胞
3.4.1 分离提取脾脏单个核细胞 无菌环境中钝性分离脾脏,迅速放入装有RPMI-1640完全培养基(2 mL)的培养皿,用1 mL注射器内芯底部研磨脾脏。用70 μm尼龙细胞滤网滤过细胞,应用28 mLRPMI-1640完全培养基于研磨过程中冲洗细胞滤网和培养皿,最终虑至50 mL离心管。20℃、3 000 r/min离心细胞悬液10 min。弃去上清,加入2 mL红细胞裂解液,重悬细胞,常温静置2 min,加入10 mL RPMI-1640完全培养基,20℃、3 000 r/min离心细胞悬液10 min。弃去上清,加入2 mL RPMI-1640完全培养基重悬细胞,计数细胞并调整浓度为2×109/L。

表2 结肠组织病理学的Cooper评分标准Table 2.Colon histopathology scoring criteria by Cooper
3.4.2 分离提取MLN单个核细胞 无菌环境中钝性分离MLN,迅速放入装有RPMI-1640完全培养基(2 mL)的培养皿,用1 mL注射器内芯底部研磨MLN。用70 μm尼龙细胞滤网滤过细胞,用8 mL RPMI-1640完全培养基于研磨过程中冲洗细胞滤网和培养皿,最终虑至50 mL离心管,20℃、3 000 r/min离心细胞悬液10 min。弃去上清,加入2 mL RPMI-1640完全培养基重悬细胞,并计数细胞,并调整浓度为2×109/L。
3.4.3 分离提取LPMC 无菌环境取出结肠,置于放有冰冷1×PBS的培养皿中;应用20 mL注射器反复冲洗肠腔粪便,移入新的放有冰冷1×PBS的培养皿中,进一步清除残余脂肪组织和肠系膜。在无菌通风操作台中,移入新的放有冰冷1×PBS的培养皿中,纵向剪开肠管,转入放有有1×HBSS的培养皿中,把肠管切成长3~4 cm的小段。组织移入放有20 mL预消化液的50 mL试管,放入37℃恒温箱,低转速(40×g)孵育20 min,孵育过程中需剧烈旋转3次,孵育完毕弃去预消化液,应用1×HBSS冲洗2次。组织移入放有1~2mL消化液的培养皿上,用刀片快速切剁成大小约1 mm×1 mm×1 mm的碎块组织。组织移入新的50 mL离心管中,加入10 mL消化液,放入37℃恒温箱,低转速(40×g)孵育20 min,孵育过程中需剧烈旋转3次。用70μm细胞滤网滤过细胞悬液至新的50 mL试管中,加入20 mL RPMI-1640完全培养基,此时细胞悬液总量30 mL。2 000 r/min离心细胞悬液5 min,小心弃去上清,1 mL 42%Percoll溶液重悬沉淀,混匀后再加入4 mL 42%Percoll溶液。用5 mL注射器轻轻把3 mL 75%Percoll溶液于细胞液底部轻轻加入,形成分界液面。2 000 r/min,离心42%/75%Percoll梯度液20 min,离心后,两种不同Percoll液交界面上可形成LPMCs白环。界面下为破碎红细胞形成的红环,底层为死细胞和小片状颗粒,最上面一层为上皮细胞。用1 mL移液枪于交界面LPMCs白环处小心收集单个核细胞2 mL,移入14 mL试管,加入RPMI-1640完全培养基至总体积10 mL,2 000 r/min 离心,5 min,小心弃去上清,用 500 μL RPMI-1640完全培养基重悬细胞,计数调整细胞浓度为2×109/L。
3.4.4 ELISA 将96孔板用浓度为0.5 mg/L的anti-CD3e包被2 h,再以2 mg/L的anti-CD28包被,各组取125 μL的2×109/L LPMC加入每孔中。将接种好的细胞在5%CO2、37℃条件下在细胞培养箱中培养48 h,然后取上清,采用ELISA法检测,操作按试剂盒说明书进行。
3.5 流式细胞术 分离并提取脾脏和MLN单个核细胞,调整浓度为1×109/L。将单核淋巴细胞数调整浓度为1×109/L;各取1 mL,加入Cell Activation Cocktail 2 μL,37℃避光培养 4 h;CD16/32 1 μL 封闭,4℃、5 min;加CD4抗体室温孵育30 min,PBS清洗后加Perm/Wash,4℃、500×g离心5 min,弃上清,重复1次;最后应用100 μL Perm/Wash重悬细胞后加入抗IL-17和INF-γ抗体,涡旋混匀,4℃避光孵育40~50 min;加入Perm/Wash清洗,样本流式管中分别加入500 μL的PBS重悬细胞,上机检测。
3.6 Masson染色 包埋的结肠组织以4 μm的厚度连续切片,按以下步骤进行染色:二甲苯脱蜡,梯度乙醇脱蜡至水,自来水冲洗1 min,苏木精4 min,充分水洗,酸性丽春红品红10 min,充分水洗,1%磷钼酸3 min,2%苯胺蓝1 min,0.2%冰醋酸片刻,梯度乙醇脱水,二甲苯透明,中性树胶封片。在光镜下观察肠组织的纤维化程度,采用Image-Pro Plus 6.0图像分析软件,对结果进行定量分析,结果以平均吸光度表示。
3.7 天狼星红染色 石蜡包埋的结肠组织以4 μm的厚度连续切片,按以下步骤进行染色:二甲苯脱蜡,梯度乙醇脱蜡至水,自来水冲洗1 min,天青石蓝15 min,蒸馏水充分冲洗,天狼星红饱和苦昧酸染液10 min,蒸馏水充分冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。在光镜下观察肠组织的纤维化程度,采用Image-Pro Plus 6.0图像分析软件对结果进行定量分析,结果以平均吸光度表示。
4 统计学处理
统计分析采用SPSS 18.0软件,以均数±标准差(mean±SD)表示计量资料数据,多组间采用单因素方差分析(one-way ANOVA)比较,以P<0.05为差异有统计学意义。
结 果
1 TL1A促进小鼠慢性实验性结肠炎相关肠纤维化的发生
与WT+DSS组相比,Tg+DSS组小鼠的DAI评分升高更加显著(P<0.05),见图1A。TL1A加重病理学炎症程,通过光镜下观察小鼠结肠组织HE染色,可见正常组小鼠的结肠黏膜上皮保持完整,且上皮、固有层、黏膜肌层构成的腺体均排列整齐;野生型小鼠中,与control组相比,DSS组小鼠的结肠可见黏膜缺失,浅溃疡形成,腺体被破坏或消失,杯状细胞可见减少,黏膜及黏膜下层可见水肿,并可见中性粒细胞及淋巴细胞浸润,病理评分进一步升高P<0.05),见图1C、D;MPO活性更高(P<0.05),见图1B。
马松染色和天狼星红染色观察结肠胶原沉积的结果显示,与DSS/WT组相比,DSS/Tg组的肠道纤维化程度更重(P<0.05),见图1E、F。
2 TL1A上调CD4+IFN-γ+和CD4+IL-17+T细胞的比例
免疫荧光染色法测定显示,与DSS/WT组小鼠相比,DSS/Tg组小鼠的结肠组织中CD4+IFN-γ+和CD4+IL-17+T细胞的平均吸光度升高[IFN-γ:(115.428±13.933)U/gvs(94.562±17.030)U/g,P<0.05;IL-17:(126.426±15.939)U/gvs(84.528±11.967)U/g,P<0.05],见图2。流式细胞术检测结果显示,MLN单个核淋巴细胞中CD4+IFN-γ+、CD4+IL-17+T细胞数的百分比明显升高(CD4+IFN-γ+:8.04%±0.44%vs6.71%±0.26%,P<0.05;CD4+IL-17+:5.61%±0.19%vs2.47%±0.28%,P<0.05);脾脏中单个核细胞中CD4+IFN-γ+和CD4+IL-17+T细胞数的百分比明显升高(CD4+IFN-γ+:10.45%±0.66%vs7.29%±0.58%,P<0.05;CD4+IL-17+:3.33%±0.33%vs2.10%±0.36%,P<0.05),见图3。
3 TL1A促进IFN-γ和IL-17的分泌
ELISA法检测脾脏、MLN和LPMC单个核细胞分泌IFN-γ分泌水平,结果显示,与DSS/WT组小鼠相比,DSS/Tg组小鼠的IFN-γ和分泌水平明显升高(P<0.05),见图4。
讨 论
目前认为,IBD相关肠纤维化的发生机制是在易感基因基础上,大量炎症细胞释放促炎因子,引起肠道的慢性炎症,使肠道持续处于损伤和修复并存的状态[6],导致肠壁以胶原为主的细胞外间质(extracellular matrix,ECM)在肠组织的过度合成和异常沉积,最终形成肠纤维化,表现为肠狭窄或肠梗阻等严重的并发症[7-8]。
TL1A是新近发现的一种肿瘤坏死因子家族成员,是IBD的易感基因。TL1A通过与受体DR3相结合,刺激T淋巴细胞的激活,促进Th1和Th17等细胞的活化与效应功能,参与肠道炎症反应[9-10]。在对IBD患者研究中发现,结肠LPMC的TL1A表达升高,且与炎症的严重程度呈正相关[11]。有学者通过用抗TL1A抗体干预后,发现其在缓解肠道炎症的同时减轻了纤维化程度,提示TL1A在结肠炎症反应中发挥了促炎促纤维化作用,且可能与抑制IFBs增殖与活化,减少胶原合成的同时增加胶原分解有关[12-13]。本研究发现,饮用DSS后,与野生型小鼠相比,转基因小鼠DAI和病理评分进一步升高,证明TL1A过表达促进了慢性实验性结肠炎小鼠的肠道炎症反应。通过天狼星红染色观察DSS诱导的小鼠结肠炎中肠道胶原纤维的改变,发现转基因小鼠与野生型小鼠饮用DSS水后,与control组相比,结肠不仅仅出现了炎症的改变,在黏膜及黏膜下层出现胶原蛋白的沉积,马松染色、天狼星红染色提示胶原染色的面积明显增多,而且,转基因小鼠病变程度更重。这表明TL1A在促进结肠发生炎症的同时,也会促进胶原的合成与过度沉积,进而在肠纤维化的发生发展中发挥重要作用。

Figure 1.Establishment of DSS-induced chronic experimental colitis-associated intestinal fibrosis model.A:DAI,consisting of weight loss,stool consistency and OB,was measured daily;B:MPO activity were expressed;C:HE staining(×100);D:Histological score;E:Masson-staining(×200);F:Sirius red staining(×200).Mean±SD.n=6.*P<0.05,**P<0.01 vs control group in WT mice.图1 成功建立DSS诱导的慢性实验性结肠炎模型
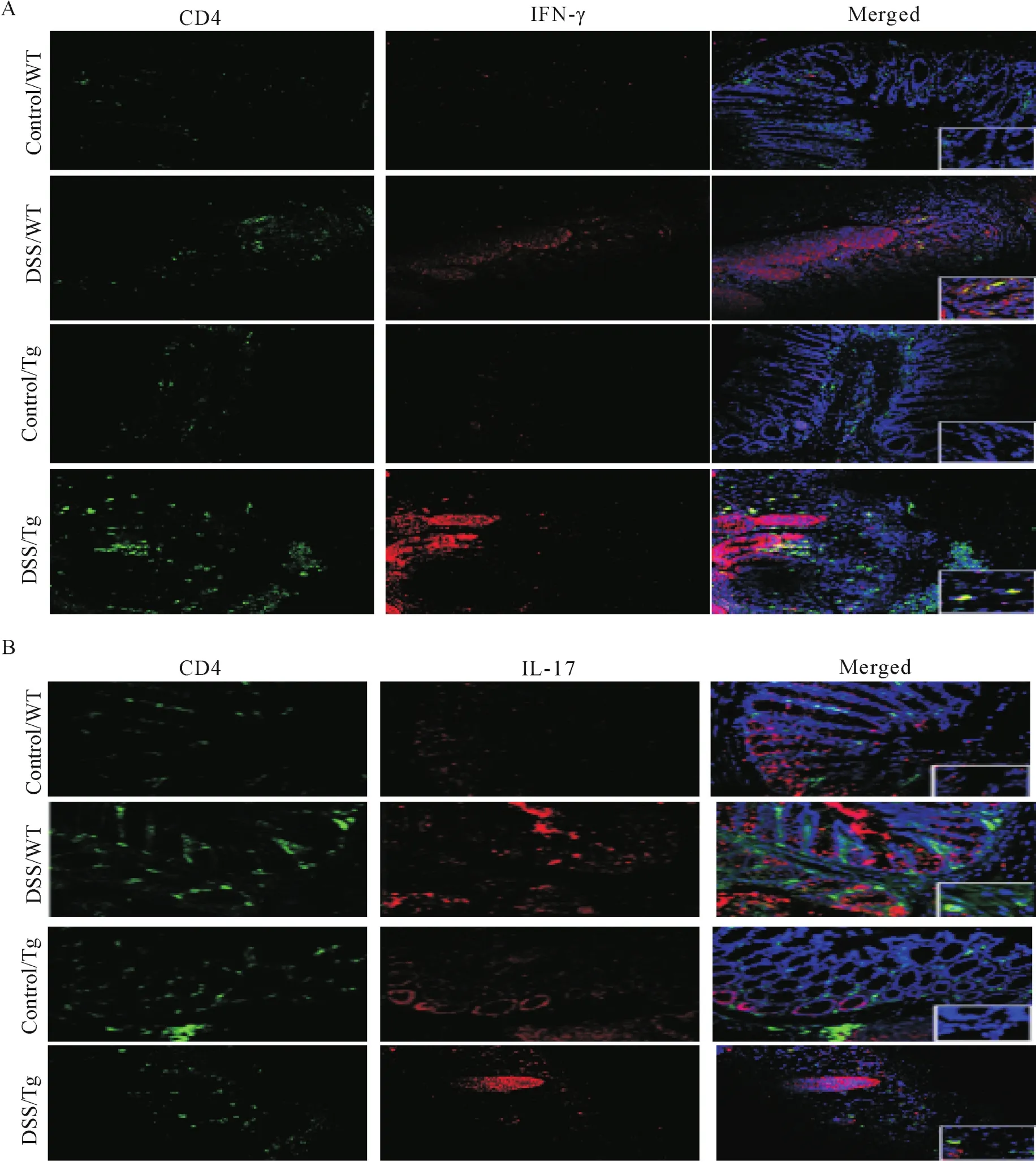
Figure 2.Immunofluorescence detection of IFN-γ and IL-17 expression in mouse intestinal tissues(×200).A:IFN-γ expression and the position in the intestinal tissue of the mice;B:IL-17 expression and position in the intestinal tissue of the mice.图2 免疫荧光法检测IFN-γ和IL-17在小鼠肠组织中的定位表达
目前,研究表明,TL1A作为调控Th细胞的关键因子,可促进CD4+T细胞分化为Th1细胞和Th17细胞,分泌大量的促炎因子IFN-γ和IL-17,参与IBD的发生。在T细胞转移及DSS诱导的慢性结肠炎小鼠模型中发现,TL1A可通过上调肠相关淋巴样组织中CD4+T细胞的IFN-γ和IL-17表达,增强Th1和Th17细胞的效应功能,促进肠黏膜炎症和纤维化发生[14-15],研究证实,TL1A能诱导CD患者的肠黏膜固有层CD4+T细胞分化成为Th17细胞,IL-17分泌增加加重肠道炎症反应的发生;同时也可促进IFN-γ产生,使Th1介导的免疫反应增强[16]。研究发现纤维性CD患者的肠活检标本IL-17的表达升高,并且在狭窄性CD患者中IL-17能刺激肌成纤维细胞产生更多的胶原[17]。因此,我们推测TL1A通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生,参与肠纤维化的发生。
本研究通过检测Th1和Th17细胞的百分比发现,与DSS/WT组小鼠相比,DSS/Tg组脾脏、MLN中CD4+IFN-γ+细胞和CD4+IL-17+细胞的百分比均明显升高,同时IFN-γ和IL-17的分泌水平也明显升高,表明TL1A通过促进Th1和Th17细胞的分化,进而分泌IFN-γ和IL-17增加,参与慢性实验性结肠炎相关肠纤维化的发生。与此同时,我们通过免疫荧光法、流式细胞术及ELSIA,亦证实了在DSS组中转基因小鼠与野生型小鼠相比,TL1A促进了IFN-γ和IL-17的分泌。这表明TL1A通过上调IL-17和IFN-γ的表达,促进了慢性实验性结肠炎相关肠纤维化的发生发展。

Figure 4.The levels of IFN-γ(A~C)and IL-17(D~E)in the supernatants of mononuclear cells from spleen(A,D)and MLN(B,E)and lamina propria(LPMC;C,F)were measured by ELISA.Mean±SD.n=6.*P<0.05 vs DSS/WT group.图4 ELSIA法检测IFN-γ和IL-17在小鼠脾脏、肠系膜淋巴结和肠黏膜固有层单个核细胞上清培养液中的表达水平
综上所述,TL1A通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生。
