自体富血小板血浆对骨关节炎模型兔软骨细胞凋亡及NLRP3/IL-1β通路的影响*
2020-07-06屈一鸣邵高海张铭华朱凤臣曹春风
屈一鸣,邵高海,张铭华,李 波,朱凤臣,何 超,曹春风,赵 波
(重庆医科大学附属永川医院骨科,重庆402160)
膝骨关节炎属于常见骨关节疾病,伴随炎症、疼痛、骨组织病变、关节功能丧失,随着老龄化的升高发病率逐渐升高,使膝关节功能降低,影响患者生活质量[1]。目前临床治疗骨关节炎的方法较多,但关节自身再生能力较差,目前尚无理想治疗方法,因此促进损伤软骨的修复及进行干预、预防对于提高患者预后十分重要。富血小板血浆(platelet-rich plasma,PRP)是自体血液中分离的血液制品,其含有的高浓度血小板可释放出大量的生长因子,促进软骨的修复,多项研究证实其能够促进软骨组织再生及修复[2-3]。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)在固有免疫中发挥重要作用,近期研究显示NLRP3信号通路的异常激活与骨关节炎的发生密切相关[4],然而其是否参与PRP修复骨关节炎受损软骨过程目前尚不清楚。本研究复制兔骨关节炎模型并给予PRP治疗,旨在探究其对受损软骨的修复作用及可能的作用机制。
材料和方法
1 实验动物
SPF级雄性新西兰大白兔27只,体重1.8~2.0 kg,由重庆医科大学实验动物中心提供,实验动物生产及使用许可证号为SCXK(渝)2018-0003,动物质量合格证号为2019012704,饲养温度控制在22~25℃,湿度为50%,饲养1周后用于实验。
2 主要药品、试剂与仪器
玻璃酸钠(sodium hyaluronate,SH)注射液购于山东博士伦福瑞达制药有限公司;苏木素-伊红染色试剂盒购于中杉金桥生物公司;免疫组化检测试剂盒购于北京索莱宝有限公司;RIPA裂解液、BCA检测试剂盒和TUNEL染色试剂盒购于碧云天生物技术有限公司;脱钙液购于BOSTER;兔抗鼠NLRP3、caspase-1、含caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和白细胞介素1β(interleukin-1β,IL-1β)抗体购于Abcam;兔抗鼠caspase-3、Bax、β-actin和Bcl-2抗体及HRP标记的Ⅱ抗购于Sigma。NLRP3抑制剂MCC950和IL-1β抑制剂eucalyptol购自MCE;NLRP3和IL-1β ELISA试剂盒购自上海恒斐生物科技有限公司。
RM2135型石蜡切片机购于TKO;BX53型光学显微镜购于Olympus;Gel Doc XR型凝胶成像仪购于Bio-Rad;OmniPAGE Maxi型垂直电泳仪购于Cleave。
3 实验方法
3.1 PRP的制备 根据Freymiller等[5]的方法制备PRP:采集兔耳静脉血10 mL,200×g离心10 min后,收集白层膜以上血浆,置于离心机中,800×g离心10 min,下层0.8 mL为PRP,吹打均匀,细胞数为(1.98±0.33)×109/L。
3.2 模型制备和分组 随机选择6只兔作为假手术(sham)组,剩余21只兔用于模型制备。采取改良Hulth法[6]制备左膝骨关节炎模型:于关节正中部位做一切口,长为4 cm,将关节腔逐层打开后,探查关节腔内是否存在病变,将前交叉部位韧带、内侧副韧带切断,并切除内侧半月板,止血后用生理盐水冲洗腔内,逐层缝合切口。造模后第1天经肌肉注射青霉素预防感染,注射量为3×105U/kg,连续注射1周,隔天换药至伤口愈合,观察到兔出现关节肿胀、活动度降低、皮温升高的特征,则代表模型成功,6周后停止造模。假手术组仅切开膝关节皮肤,不做其他处理。造模成功18只,将造模成功的兔随机分为模型(model)组、SH组和PRP组,每组6只。SH组于左膝关节腔注射0.5 mL SH注射液,每周1次;PRP组于左膝关节腔注射0.5 mL PRP,每次1次;sham组和model组均注射等量生理盐水,连续5周。
3.3 样本采集及软骨细胞的分离和培养 末次给药结束后,兔禁食、禁水12 h,采用空气栓塞法处死兔,立刻用手术刀截取模型组兔约1 mm×1 mm×1 mm胫骨近端软骨面,置于DMEM培养液中,除去血污,青、链霉素双抗清洗3次,加入胰酶消化,消化完全后,离心,弃去上清液,随后加入0.025%Ⅱ型胶原酶,37℃恒温震荡5 h,离心收集细胞,并用DMEM混悬,培养于含有10%FBS的DMEM培养液中。获取膝关节腔观察关节大体情况;将一部分软骨组织置于10%多聚甲醛中固定24 h,另一部分软骨组织冻存于-80℃。
3.4 软骨大体形态观察 肉眼观察膝关节软骨表面,采取Pelletier评分[7]对软骨大体形态进行评定,根据软骨表面缺损情况、光泽等来评定,评分为0~4分,评分越高表明软骨损伤越严重。
3.5 HE染色评定软骨病理形态学的变化 取出固定的软骨组织,置于脱钙液中处理10 d后,进行石蜡包埋,制备石蜡切片,切片厚度为6 μm,HE染色,参照Mankin评分[8]对软骨组织病理学变化进行评定。
3.6 TUNEL染色观察软骨组织细胞凋亡情况 软骨组织石蜡切片在二甲苯中脱蜡、乙醇中脱水后,添加不含DNase的蛋白酶,PBS洗涤3次后,在样品上加50 μL TUNEL检测液,37℃避光孵育60 min,PBS洗涤3次,采取抗荧光淬灭封片液封片,在荧光显微镜下观察细胞凋亡情况。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
3.7 免疫组化检测NLRP3/IL-1β通路蛋白的表达采用SP染色法染色软骨组织切片,切片经脱蜡脱水后置于0.3%过氧化氢中孵育10 min,微波修复后采用血清封闭抗原,采用Ⅰ抗(1∶200)孵育切片,4℃冷藏过夜后,清洗后添加Ⅱ抗室温下孵育1 h,添加链卵白素Ⅱ抗稀释液,经DAB显色、苏木素复染、透明、脱水、封片后,在光镜下观察蛋白染色情况,NLRP3蛋白定位在细胞膜上,ASC、caspase-1和IL-1β定位在细胞质或细胞浆内,用ImageJ软件定量评估蛋白阳性表达率。
3.8 Western blot法检测凋亡相关蛋白表达 软骨组织脱钙处理后,用RIPA裂解液提取组织蛋白,BCA法检测蛋白浓度后,统一量取40 μg进行SDSPAGE,将分离后的蛋白转移至PVDF膜上,5%脱脂奶粉溶液封闭膜后,采用抗caspase-3、Bax、Bcl-2抗体(1∶300)孵育,浓膜用HRP标记的Ⅱ抗孵育,经ECL发光显影后用ImageJ软件定量分析蛋白相对表达。
3.9 NLRP3和IL-1β调控关系的验证 取分离的软骨细胞,用DMEM培养液调整细胞密度为1×108/L,随后接种到24孔板中,培养过夜。设置对照(control)组(不经任何处理)、MCC950(125 μmol/L)组和eucalyptol(500 μmol/L)组,每组设置6个复孔。按照分组处理,继续培养48 h后,用ELISA测定各组细胞NLRP3和IL-1β的水平。
4 统计学处理
采用SPSS 22.0软件进行分析。计量资料以均数±标准差(mean±SD)描述,多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 自体PRP对兔软骨大体形态的影响
如图1所示,假手术组的膝关节大体色泽明亮,关节表面平整,软骨厚度正常,未发生退变;模型组的兔软骨表面不平整,关节失去正常光泽,软骨组织呈片状剥落,见图中虚线部位;经SH或PRP治疗后软骨组织得到一定的修复,其中PRP组的改善优于SH组。

Figure 1.General condition of the rabbit cartilage in each group.图1 各组兔软骨大体情况
与假手术组相比,模型组的Pelletier评分显著升高(P<0.05);与模型组相比,SH组和PRP组的Pelletier评分显著降低(P<0.05),且PRP组的Pelletier评分低于SH组(P<0.05),见表1。
2 自体PRP对兔软骨组织形态的影响
假手术组的软骨细胞排列整齐、潮线完整清晰,基质染色均匀;模型组的软骨组织不清晰,软骨层变薄,细胞紊乱排列,数量减少,潮线模糊;经SH或PRP治疗后软骨细胞数量增多,软骨组织、细胞形态接近正常,见图2。
与假手术组相比,模型组的Mankin评分显著升高(P<0.05);与模型组相比,SH 组和 PRP组的Mankin评分显著降低(P<0.05),且PRP组的Mankin评分低于SH组(P<0.05),见表1。
3 自体PRP对骨关节炎模型兔软骨细胞凋亡的影响
与假手术组相比,模型组的细胞凋亡率显著升高(P<0.05);与模型组相比,SH组和PRP组的细胞凋亡率显著降低(P<0.05),且PRP组的细胞凋亡率低于SH组(P<0.05),见图3、表1。
4 自体PRP对兔软骨组织NLRP3/IL-1β通路相关蛋白表达的影响

Figure 2.HE staining was used to observe the pathomorphological changes of cartilage in rabbits(×200).图2 HE染色观察兔软骨组织病理形态学变化
与假手术组相比,模型组NLRP3、ASC、caspase-1和IL-1β的蛋白阳性表达率显著升高(P<0.05);与模型组相比,SH和PRP组的NLRP3、ASC、caspase-1和IL-1β蛋白阳性表达率显著降低(P<0.05),且PRP组NLRP3、ASC、caspase-1和IL-1β的蛋白阳性表达率低于SH组(P<0.05),见图4、表2。

Figure 3.The apoptosis of rabbit chondrocytes observed by TUNEL staining(×200).图3 TUNEL染色观察兔软骨细胞凋亡情况

表1 各组兔软骨Pelletier评分、Mankin评分和软骨细胞凋亡率的比较Table 1.Comparison of Pelletier scores,Mankin scores and chondrocyte apoptotic rates in the rabbits with different treatments(Mean±SD.n=6)
5 自体PRP对兔软骨组织凋亡相关蛋白表达的影响
以阴性对照组为参考,定量描述各组蛋白表达水平,与假手术组相比,模型组的caspase-3和Bax蛋白表达显著升高(P<0.05),Bcl-2蛋白的表达显著降低(P<0.05);与模型组相比,SH和PRP组的caspase-3和Bax蛋白表达显著降低(P<0.05),Bcl-2蛋白的表达显著升高(P<0.05),且PRP组的 caspase-3和Bax蛋白表达低于SH组(P<0.05),Bcl-2蛋白表达高于SH组(P<0.05),见图5、表3。
6 NLRP3调控IL-1β的水平
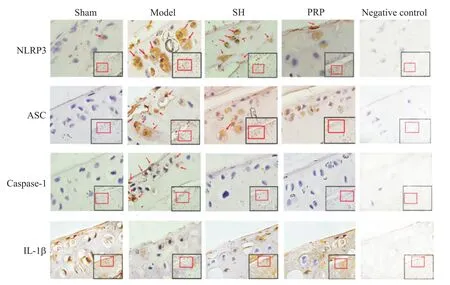
Figure 4.The protein expression of NLRP3,ASC,caspase-1 and IL-1β in the cartilage tissues detected by immunohistochemical staining(×200).图4 免疫组化法检测软骨组织中NLRP3、ASC、caspase-1和IL-1β蛋白表达

表2 各组NLRP3、ASC、caspase-1和IL-1β蛋白的表达Table 2.The protein expression of NLRP3,ASC,caspase-1 and IL-1β in each group(Mean±SD.n=6)

Figure 5.The protein expression of caspase-3,Bax and Bcl-2 in cartilage tissues detected by Western blot.图5 Western blot法检测软骨组织中caspase-3、Bax和Bcl-2蛋白表达
细胞实验中,与对照组相比,MCC950组NLRP3和 IL-1β的水平显著降低(P<0.05),eucalyptol组NLRP3的水平无明显变化(P>0.05),IL-1β的水平则显著降低(P<0.05),见表4。
讨 论
骨关节炎属于慢性退行关节疾病,病理特征主要为关节软骨变性、软骨下骨硬化等,临床表现为关节疼痛、活动受限等,病情严重者造成残疾[9-10]。本研究采取改良Hulth法切除兔膝关节前交叉韧带、内侧半月板等造成关节力学失稳,引发膝骨关节炎,这一过程与临床骨关节炎机理相似,结果显示模型组兔软骨表面不平整,关节失去正常光泽,软骨组织呈片状剥落,Pelletier评分显著高于假手术组,病理检测发现软骨层变薄,细胞紊乱排列,数量减少,潮线模糊,Mankin评分显著高于假手术组,表明兔软骨组织受到损伤,与以往膝关节动物模型制备结果相似[11],提示兔骨关节炎模型制备成功。
PRP是从自身血液中分离的含高浓度血小板的血液制品,其能够促进损伤软骨修复,在临床上的应用逐渐开展起来。研究发现膝骨关节炎患者经PRP治疗能够明显改善膝关节功能,减轻患者疼痛,其治疗有效率明显优于SH[12]。动物研究显示骨关节炎兔经关节腔内注射PRP能够明显提高软骨细胞数量,促进软骨修复[13]。本研究发现骨关节炎兔经SH和PRP治疗后软骨组织得到一定的修复,且Pelletier评分和Mankin评分明显降低,PRP组Pelletier评分和Mankin评分显著低于SH组,提示PRP能够缓解骨关节炎软骨损伤,促进软骨修复,效果优于SH,然而其具体机制尚不清楚。

表3 各组caspase-3、Bax和Bcl-2蛋白的水平Table 3.The protein levels of caspase-3,Bax and Bcl-2 in each group determined by Western blot(Mean±SD.n=6)

表4 各组NLRP3和IL-1β水平的变化Table 4.The protein levels of NLRP3 and IL-1β in each group(μg/L.Mean±SD.n=6)
NLPR3属于NLRs家族重要成员,当受到危险信号刺激后能够激活NLRP3蛋白,进而招募ASC和caspase-1组装为NLRP3炎性小体,活化IL-1β前体,使其成为成熟IL-1β,分泌至胞外,发挥炎症效应[14]。本研究发现,与对照组相比,MCC950组NLRP3和IL-1β表达降低,eucalyptol组NLRP3表达无明显变化,IL-1β表达显著降低,提示NLPR3调控IL-1β表达,参与炎症反应。过往研究显示NLPR3炎性小体的活化与骨关节炎的发生密切相关[15]。Fioravanti等[16]研究发现在骨关节炎患者血清检测中发现NLPR3和IL-1β水平明显升高,且与关节肿胀度呈正相关。Zhao等[17]研究发现经LPS诱导的软骨细胞中NLPR3、IL-1β蛋白表达明显升高,推测NLPR3炎症小体可能是骨关节炎新的治疗靶点。Sun等[18]研究证明姜黄素通过抑制炎症通路NLRP3激活降低炎症细胞因子表达从而发挥对骨关节炎的保护作用。本研究发现,与假手术组相比,模型组NLRP3、ASC、caspase-1和IL-1β蛋白阳性表达率显著升高;给予SH或PRP治疗后,通路蛋白阳性表达率均降低,且PRP组蛋白阳性表达率低于SH组,推测NLRP3信号通路参与兔骨关节炎的发病过程,且富血小板可能通过抑制NLRP3信号通路的活化,进而发挥对关节炎模型兔关节软骨的保护作用。
细胞凋亡在骨关节炎软骨损伤中起着支配性作用。细胞凋亡处于正常生理进程,然而过度凋亡属于病理性。软骨细胞凋亡过程受到凋亡相关蛋白的控制,例如:Bcl-2属于抗凋亡蛋白,能够抵抗多种因素引发的细胞凋亡;Bax为凋亡诱导因子,与Bcl-2呈拮抗作用,参与细胞凋亡[19];caspase-3为细胞凋亡的执行者,在接收到细胞凋亡信号刺激后,使其发生裂解活化,进而使细胞程序性凋亡[20]。本研究发现与假手术组相比,模型组软骨组织细胞凋亡率明显升高,而给予PRP干预后细胞凋亡率明显降低;进一步对凋亡相关蛋白检测发现模型组caspase-3、Bax蛋白表达明显升高,Bcl-2蛋白表达明显降低,PRP干预后,细胞caspase-3、Bax蛋白表达明显降低,Bcl-2蛋白表达升高,提示PRP可通过抑制软骨组织细胞凋亡进而缓解软骨组织损伤,发挥对节炎模型兔骨关节软骨的保护作用。
综上所述,PRP能够促进骨关节炎兔受损软骨的修复,其机制可能与抑制NLPR3/IL-1β信号通路并减少软骨细胞凋亡有关。然而PRP仅能缓解软骨组织损伤而不能完全逆转,这可能与作用剂量有关,后续仍需完善设计方案,进一步充分论证PRP对骨关节炎的修复作用。
