高压氧通过激活CREB/BDNF信号通路减轻阿尔茨海默病小鼠海马神经元突触损伤*
2020-07-06尹传红闫宇辉
尹传红,闫宇辉
(1大连医科大学附属第一医院高压氧科,2辽宁中医药大学药学院,辽宁大连116600)
阿尔茨海默病(Alzheimer disease,AD)是发生在老年期或老年前期的一种中枢神经系统退行性疾病,以神经细胞内神经纤维缠结(nerve fiber tangles,NFT)、细胞外老年斑(senile plaques,SP)以及大量神经元丢失、突触损伤为主要病理特征[1],患者临床症状主要表现为学习与记忆能力障碍等[2]。随着我国老年人口化速度加快,导致AD的发病率也逐年增加,严重影响患者及其家人的生活质量。国内外现有治疗AD的药物虽能部分缓解症状,但无法补充脑内丢失的神经元,改善突触功能。因此,寻找并建立能促进脑内神经元功能重建的新方法,对治疗AD等神经退行性疾病具有重要意义。
环磷酸腺苷反应元件结合蛋白(CAMP response element binding protein,CREB)/脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号通路在神经元保护与再生、突触形成及学习记忆改善等方面都发挥着重要的调节作用,通过激活CREB/BDNF信号通路能够抑制AD病理微环境对小鼠海马神经元的损伤,发挥神经保护作用[3]。
高压氧(hyperbaric oxygen,HBO)是指在超过一个大气压的环境下,呼吸的氧分压大于1.0绝对大气压。HBO具有改善脑组织功能的作用,目前受到越来越多的关注[4]。HBO能够增加机体含氧量,进而有效提高脑组织氧分压和微循环血流动力,改善神经细胞缺氧缺血状态和血液供应,从而促进神经组织功能恢复[5]。研究表明,HBO能够通过提高机体抗自由基损伤能力来改善AD小鼠的学习记忆功能,但是其对AD小鼠海马神经元突触功能的影响未进行研究[6],并且CREB/BDNF信号通路与HBO改善AD小鼠学习记忆能力的相关性尚未见文献报道。因此,本项工作应用APP/PS1转基因(trangenic,TG)小鼠作为AD模型小鼠,重点探讨HBO对其学习记忆能力和海马区神经元突触功能的改善作用与CREB/BDNF信号通路的关系。
材料和方法
1 动物、试剂与设备
1.1 动物 SPF级6月龄雄性野生型(wild-type,WT)C57BL/6小鼠10只,体重(28.0±2.0)g,购自辽宁长生生物有限公司,动物合格证号为SCXK(辽)2015-0001。SPF级6月龄雄性APP/PS1TG小鼠30只,体重(27.0±2.5)g,购自北京中科泽晟生物技术有限公司,动物合格证号为SCXK(京)2013-0001。小鼠分笼饲养,室温维持在20~25℃,每日12 h光照维持昼夜循环。
1.2 试剂 CREB抑制剂H89购自Sigma;尼氏染色试剂盒购自碧云天生物有限公司;兔抗β-actin抗体购自北京博奥森生物有限公司;CREB、BDNF和GAPDH引物购自上海生工生物技术有限公司;PCR逆转录试剂盒购自北京全式金生物技术有限公司;兔抗突触素(synapsin,SYN)、突触后致密区蛋白95(postsynaptic density protein 95,PSD95)、生长相关蛋白 43(growth-associated protein 43,GAP43)、CREB、p-CREB和BDNF抗体购自Abcam;辣根过氧化物酶标记的羊抗兔IgG购自北京中杉金桥生物有限公司;DAB显色试剂盒购自大连美仑生物有限公司;其余试剂均为国产分析纯。
1.3 仪器设备 实验动物高压氧舱购自烟台宏远氧业集团公司;Ti-S型倒置荧光显微镜购自Nikon;Morris水迷宫仪购自成都仪器厂;石蜡切片机购自Lecia;real-time PCR仪购自ABI;水平核酸电泳仪和湿电蛋白转膜仪购自Bio-Rad。
2 实验方法
2.1 动物分组及治疗方法 小鼠在适应性饲养1周后,APP/PS1TG小鼠按照随机数字表法随机分为TG组、HBO组及H89组,另取同龄WT C57BL/6小鼠作为阴性对照组(WT组),每组10只小鼠。HBO及H89组小鼠进行高压氧治疗。每日上午将小鼠放入动物高压氧舱,高压氧舱事先利用纯氧洗舱3次后,加压到0.25 MPa(2.5 ATA),进行纯氧治疗,每次持续1 h,随后缓慢减压,动物出舱,每天1次,5 d为一个疗程,暂停2 d进入下一个疗程,小鼠共进行6个疗程的治疗[7]。H89组小鼠于HBO治疗前1 h给予H89(2 μg/L)侧脑室注射,每次 5 μL,隔天注射 1次[8]。WT及TG组小鼠放入动物高压氧舱但是不予以治疗。
2.2 Morris水迷宫 水迷宫设备为一个圆形游泳池(直径1.6 m,高60 cm)和浸没式平台(直径10 cm,距离表面2 cm)位于游泳池的固定位置。水温设定在(23±1)℃。前5 d进行逃避潜伏期实验,连续5 d每天4个象限,每个象限1次。设备自动记录小鼠找到隐匿平台的时间,上平台后保持15 s后从平台上取出小鼠。若60 s小鼠未找到平台,引导小鼠上平台,并保持15 s。记录到达隐藏平台时间和到达平台前的游泳距离和速度。5 d训练后取出平台,让小鼠自由游泳90 s记录游过平台的次数及小鼠处在原平台象限的时间,根据所得到数据来比较各组小鼠的空间记忆能力。
2.3 筑巢实验 将小鼠单笼饲养,并在鼠笼内部放入垫料。每个鼠笼内放入8张5 cm×5 cm的棉花垫,每个鼠笼放置的位置一致并做好记录。第3天早上观察各组小鼠的筑巢情况并拍照。按照文献报道的方法判断每只小鼠的筑巢分数[9]。
2.4 脑组织取材 筑巢实验结束后第2天,给小鼠腹腔注射50 mg/kg戊巴比妥钠进行麻醉,待麻醉后将其置于手术台上,利用预冷的生理盐水进行灌流后快速将整个大脑取出。将脑组织沿矢状缝切开,左半脑置于30%蔗糖溶液中脱水,用于制作冰冻切片,进行尼氏染色;而右半脑储存于-80℃冰箱中,用于real-time PCR及Western blot检测。
2.5 尼氏染色 将左半脑置于包埋盒中,加入冰冻包埋剂,置于-80℃冰箱中进行速冻24~48 h,随后利用恒冷切片机对组织进行连续切片,隔十取一,片厚7 μm。将切片置于梯度乙醇中的顺序为:100%乙醇30 s、95%乙醇30 s、70%乙醇30 s,双蒸水洗涤切片3次;将切片浸入甲酚紫染液中,56℃孵育1 h,双蒸水洗涤3次;中性分色液2 min,浸入100%乙醇中脱水,中性树胶封片,显微镜下观察并拍照。
2.6 real-time PCR 用TRIzol提取各组小鼠海马组织总RNA,按RevertAidTMFirst Strand cDNA Synthesis Kit反转录生成cDNA;按照qPCR SYBR®Green Master Mix所示构建PCR。相关引物序列见表1。反应条件如下:95℃ 5 min;95℃ 10 s,55℃ 30 s,40个循环。以GAPDH作为内参照。mRNA的相对表达量用2-ΔΔCt值表示,实验重复3次。
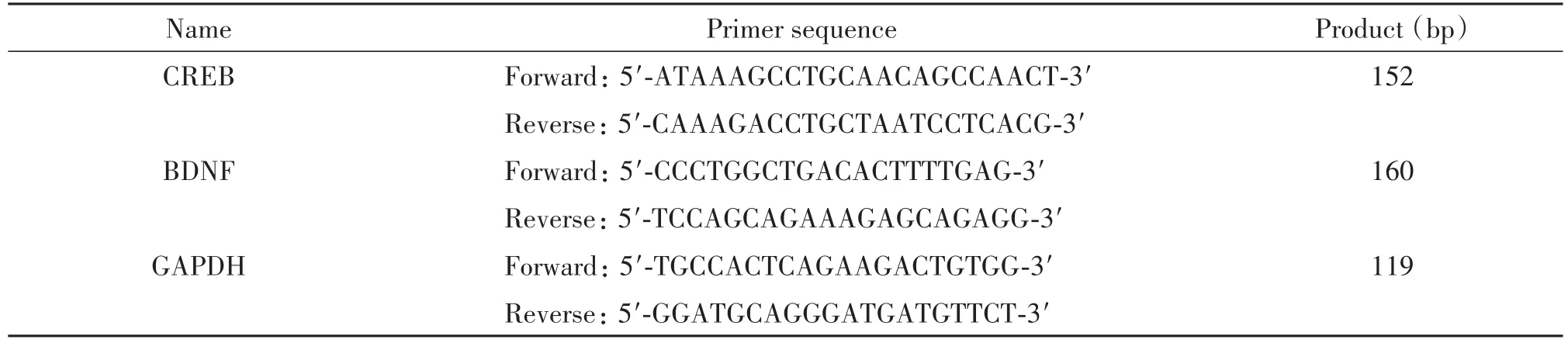
表1 real-time PCR引物序列Table 1.The sequences of the primers for real-time PCR
2.7 Western blot 分离小鼠海马区脑组织,加入RIPA裂解液后放入手动匀浆器内手动制备脑匀浆。冰上孵育30 min后,3 000×g离心15 min,转移上清液至离心管中备用。用BCA法测定蛋白质含量,以保证每组样品上样量一致。随后加入蛋白上样缓冲液,蛋白变性,进行SDS-PAGE,随后300 mA电流下转膜1.5 h。将转膜后的PVDF膜用TBST洗5 min,将PVDF膜移至封闭液中,室温摇床上摇动封闭1 h,TBST洗膜3次,每次5 min;分别加入I抗(1∶1 000)进行孵育,4℃孵育过夜;次晨,TBST洗膜3次,每次5 min;加入HRP标记的Ⅱ抗(1∶1 000),室温孵育1 h;TBST洗膜3次,每次5 min;将按照试剂盒配置ECL工作液,滴加ECL工作液到PVDF膜上,放置2 min后弃工作液;用吸水纸吸去过多液体,拍照并用ImageJ软件分析相对灰度。
3 统计学处理
数据采用GraphPad Prism 6软件进行分析处理。数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两两组间比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 HBO对小鼠学习记忆能力的影响
我们利用Morris水迷宫实验检测HBO对APP/PS1小鼠的空间位置感和空间定位学习记忆能力的影响,定位航行结果显示,与WT组相比,TG组小鼠的逃避潜伏期显著延长(P<0.05);与TG组相比,HBO治疗后小鼠逃避潜伏期显著缩短(P<0.05);而与HBO组相比,H89组小鼠逃避潜伏期显著延长(P<0.05),见图1A、B。同时,空间探索实验结果显示,第6天撤去平台后,与WT组相比,TG组小鼠穿越原平台次数显著减少(P<0.05),处于原平台象限时间也显著缩短(P<0.05);与TG组相比,HBO组小鼠穿越原平台次数显著增加(P<0.05),并且处于原平台象限时间也显著延长(P<0.05);而与HBO组相比,H89组小鼠穿越原平台次数显著减少(P<0.05),处于原平台象限时间也显著缩短(P<0.05),见图1C、D。
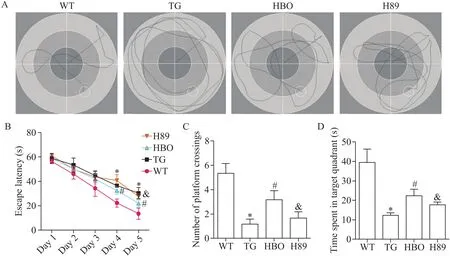
Figure 1.The therapeutic effects of HBO on the cognitive decline of APP/PS1 mice.A:the representative swimming paths in the escape latency experiment on day 5;B:quantitative analysis of the escape latency;C:quantitative analysis of the number of crossing the removed platform;D:quantitative analysis of the time spent in the target quadrant.Mean±SD.n=10.*P<0.05 vs WT group;#P<0.05 vs TG group;&P<0.05 vs HBO group.图1 HBO对APP/PS1小鼠认知功能的影响
2 HBO对小鼠筑巢能力的影响
筑巢实验结果显示,WT组小鼠搭建了具有立体感的巢穴,筑巢分数高;TG组小鼠撕咬了部分棉垫,没有很好地进行筑巢,与WT组相比,筑巢分数显著降低(P<0.05);HBO组小鼠搭建了浅平状的巢穴,与TG组相比,筑巢分数显著增加(P<0.05);与HBO组相比,H89组小鼠同样没有很好地进行筑巢,筑巢分数显著降低(P<0.05),见图2。
3 HBO对小鼠海马区尼氏体结构及数量的影响
尼氏染色结果显示,WT组小鼠海马区神经元排列整齐致密,形态规则,且神经元内尼氏体充盈,呈虎斑状或点状;TG组小鼠海马区神经元排列散乱、间隙较大,尼氏体数量较少,染色较浅;HBO组小鼠海马区神经元形态有所改善,排列较为整齐,尼氏体数量增多,染色加深,而H89组海马区神经元与TG组类似,尼氏体数量减少,排列较为散乱,见图3。
4 HBO对小鼠海马区突触相关蛋白SYN、PSD95及GAP43蛋白表达的影响
Western blot结果显示,与WT组相比,TG组小鼠海马区SYN、PSD95及GAP43蛋白表达显著减少(P<0.05);而与TG组相比,HBO组小鼠海马区SYN、PSD95及GAP43蛋白表达显著增加(P<0.05);而与HBO组相比,H89组SYN、PSD95及GAP43蛋白表达显著降低(P<0.05),见图4。
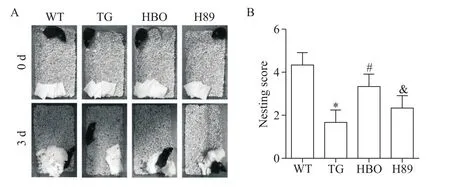
Figure 2.Comparison of the nesting ability of the mice in each group.A:representative images of mice nesting at 0 and 3 d;B:quantitative analysis of nesting score.Mean±SD.n=10.*P<0.05 vs WT group;#P<0.05 vs TG group;&P<0.05 vs HBO group.图2 各组小鼠筑巢能力的比较

Figure 3.Comparison of Nissl body structure and quantity of neurons in the hippocampus of the mice in each group.图3 各组小鼠海马的尼氏体结构和神经元数量的比较

Figure 4.Comparison of SYN,PSD95 and GAP43 protein expression in the hippocampus of the mice in each group.Mean±SD.n=5.*P<0.05 vs WT group;#P<0.05 vs TG group;&P<0.05 vs HBO group.图4 各组小鼠海马区SYN、PSD95和GAP43的蛋白表达
5 HBO对小鼠海马区CREB及BDNF mRNA表达的影响
real-time PCR结果显示,与WT组相比,TG组小鼠海马区CREB及BDNF mRNA相对表达量显著减少(P<0.05);与TG组相比,HBO治疗后小鼠海马区CREB及BDNF mRNA相对表达量显著增加(P<0.05);而H89组小鼠海马区CREB及BDNF mRNA相对表达量与HBO组相比显著减少(P<0.05),见图5。
6 HBO对小鼠海马区CREB、p-CREB及BDNF蛋白水平的影响
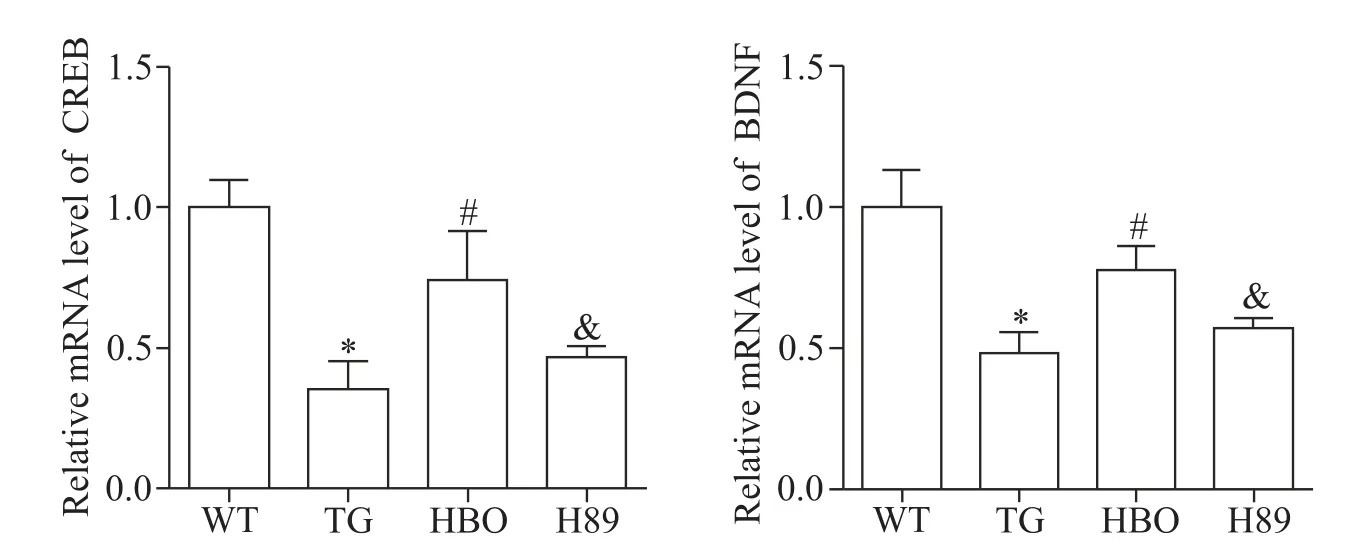
Figure 5.Comparison of relative mRNA expression of CREB and BDNF in the hippocampus of the mice in each group.Mean±SD.n=5.*P<0.05 vs WT group;#P<0.05 vs TG group;&P<0.05 vs HBO group.图5 比较各组小鼠海马区CREB和BDNF mRNA的相对表达量
Western blot结果显示,与WT组相比,TG组小鼠海马区p-CREB及BDNF蛋白水平显著降低(P<0.05);而与TG组相比,HBO组小鼠海马区p-CREB及BDNF蛋白水平显著升高(P<0.05);与HBO组相比,H89组p-CREB及BDNF蛋白水平显著降低(P<0.05);CREB蛋白表达水平在各组之间无显著性差异(P>0.05),见图6。
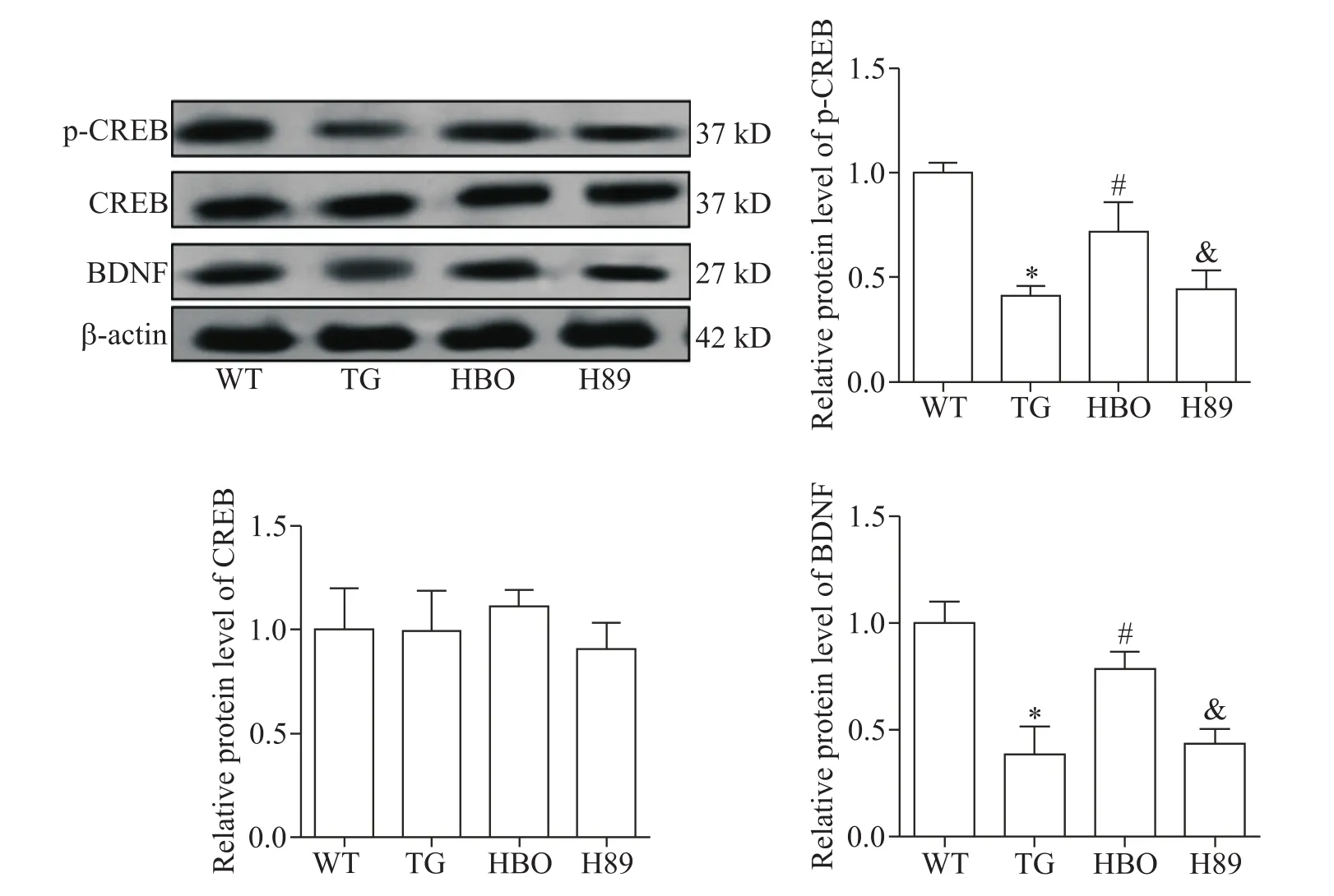
Figure 6.Comparison of CREB,p-CREB and BDNF protein levels in the hippocampus of the mice in each group.Mean±SD.n=5.*P<0.05 vs WT group;#P<0.05 vs TG group;&P<0.05 vs HBO group.图6 比较各组小鼠海马中CREB、p-CREB和BDNF的蛋白水平
讨 论
AD是一种中枢神经系统退行性疾病,目前公认的AD的发病机制有淀粉样蛋白沉积、氧化应激和炎症反应等假说。研究表明,AD患者脑内海马区域病理特征相关蛋白及信号通路改变会造成记忆损害[9]。CREB是真核生物细胞核内的调控因子,与神经元的生长、损伤、再生、突触可塑性及学习与记忆能力密切相关。CREB对神经元功能的调控作用依赖于Ser133位点的磷酸化,能促进CRE序列的转录,并调节其下游与学习记忆能力相关的靶基因的转录。BDNF作为其下游靶基因,其基因启动子区域含有CRE序列,受p-CREB的调控。BDNF作为一种神经营养因子,参与一系列细胞内信号传导过程,对神经元、轴突和树突形态以及突触可塑性具有保护作用[10]。研究显示,AD患者脑内p-CREB及BDNF表达均显著降低,从而造成神经元再生障碍、突触损伤及学习与记忆能力损害等[11-12]。目前很多药物都能够作用于CREB及BDNF,旨在上调p-CREB及BDNF表达来减轻神经元及突触损伤,从而改善学习与记忆能力,例如黄酮类化合物山奈素可通过减轻AD小鼠脑内氧化应激反应并激活CREB/TrkB/BDNF信号通路发挥神经保护作用[13];丁苯酸钠能够通过增加p-CREB、BDNF及NT-3表达,改善AD小鼠海马神经元突触功能和可塑性,从而减轻记忆损害[14]。但是上述药物只是在动物及细胞水平上证明了其有效性,距离临床试验甚至上市销售还有相当远的路要走。而HBO作为临床上一种重要的治疗手段,其作用机制多样,具有升高血液含氧量,缓解氧化应激状态,抑制炎症反应,促进神经再生,促进Aβ蛋白降解等抗AD样作用[15]。本研究显示HBO治疗后能够显著改善APP/PS1小鼠的学习记忆能力,接近于WT小鼠的学习与记忆能力。筑巢结果显示HBO治疗后的小鼠筑巢能力增强,评分增加,以上说明了HBO能够改善海马及前脑皮质的功能,提高APP/PS1小鼠的学习记忆能力及智力水平。此外,尼氏染色结果显示TG组小鼠海马区尼氏体排列稀疏、数量减少,而HBO治疗后,海马区尼氏体排列较紧密、数目增多,说明HBO改善APP/PS1小鼠学习记忆能力可能与减轻海马神经元损伤有关。
突触在神经元之间紧密接触并起到彼此传递信息的作用。虽然具体分子机制尚不完全清楚,但是AD病理损伤导致的海马突触数量减少及突触蛋白表达降低是造成学习记忆障碍的重要原因[16]。多种突触相关蛋白一起来维持突触的功能并调控神经递质的释放,通常认为Aβ能够结合突触相关蛋白使其失活,这被认为是AD患者突触可塑性障碍的病理机制之一。SYN位于突触前膜,是有代表性的与突触囊泡相关的蛋白,主要调节神经递质的释放,可以用来反映突触的密度和分布;而位于突触后膜的PSD-95也是一种调节突触分布的重要骨架蛋白,在突触兴奋和维持突触结构和功能可塑性上发挥着重要的作用。因此,它特别容易受到AD病理损伤所导致的毒性作用[9]。轴突膜蛋白GAP43是一种神经特异性的蛋白质,主要参与神经细胞外生长及突触发育形成和神经细胞再生[17]。AD患者海马内SYN、PSD-95及GAP43蛋白含量比正常同龄人明显减少,提示AD患者海马内神经元突触丢失明显。Li等[18]通过增加APP/PS1小鼠海马神经元突触蛋白的表达来发挥逆转认知功能障碍的作用。Lecca等[19]利用苯丝氨酸增加SYN、PSD95密度来改善神经元死亡、神经炎症及突触功能障碍。因此,寻求可以提高AD患者脑内突触相关蛋白表达水平的治疗手段是目前的研究热点。本研究结果显示,HBO能够增加小鼠海马区突触相关蛋白SYN、PSD-95及GAP43的表达,说明了HBO发挥改善APP/PS1小鼠认知功能障碍,减轻海马神经元损伤的作用,可能与增加海马区突触密度、改善突触功能有关。
为了阐明HBO对CREB/BDNF信号通路活性的影响,我们对小鼠海马内CREB/BDNF信号通路的相关蛋白基因和蛋白表达进行了评价,结果显示HBO能够上调CREB、BNDF mRNA及p-CREB、BNDF蛋白的表达,说明了Aβ诱导的CREB/BDNF信号通路抑制可以被HBO激活。为了进一步探讨HBO发挥改善APP/PS1转基因小鼠认知功能障碍作用的机制与激活CREB/BDNF信号通路的关系,我们利用一种常用的CREB磷酸化的抑制剂H89,来抑制CREB活性,阻止其激活BDNF,以阻断CREB/BDNF信号通路[20]。结果显示H89可以逆转HBO上调小鼠海马区CREB、BNDF mRNA及p-CREB、BNDF蛋白表达的作用,同时HBO改善小鼠海马神经元结构及突触功能,提高小鼠学习记忆能力的作用均被CREB活性抑制剂H89所阻断或减弱,这说明了HBO改善APP/PS1小鼠的学习记忆能力,可能与激活CREB/BDNF信号通路,减轻小鼠海马神经元突触损伤有关。
综上所述,HBO可改善APP/PS1小鼠的学习记忆能力与智力水平,减轻海马区神经元突触损伤,上调突触相关蛋白表达,发挥神经保护作用。本研究也对HBO发挥神经保护作用与CREB/BDNF信号通路之间是否存在联系做了初步探讨,但HBO对APP/PS1小鼠发挥神经保护作用是否是通过调控CREB/BDNF信号通路实现的仍有待进一步研究。
