尿毒症毒素通过刺激巨噬细胞外泌体分泌miR-22促进心肌细胞自噬*
2020-07-06晏子友魏志鑫罗富里万鸣宏
晏子友,魏志鑫,罗富里△,万鸣宏
(1江西中医药大学附属医院,江西南昌330006;2江西中医药大学,江西南昌330000)
大量证据表明,尿毒症毒素,特别是蛋白结合类亚群,如硫酸吲哚酚(indoxyl sulfate,IS),不能通过日常血液透析有效清除,是心血管疾病的主要危险因素之一[1-2]。先前的一项临床研究表明,高血清IS水平与慢性肾脏疾病(chronic kidney disease,CKD)患者的心血管疾病(cardiovascular disease,CVD)死亡率相关[3]。最近,有研究证实了IS在体外可通过增强氧化应激上调心肌细胞的自噬水平[4]。但是,目前尚不清楚IS诱导心肌细胞自噬的更深层机制。微小RNA(microRNA,miRNA,miR)是小的内源性非编码RNA,在细胞增殖、分化、凋亡和应激反应中起关键作用。据报道,miR-22是一种进化保守的miRNA,在心脏组织中高度表达,并可作为心脏重塑的重要调节剂[5]。研究发现miR-22可调节结直肠癌细胞的自噬[6]。巨噬细胞是尿毒症微环境的重要组成部分,在很大程度上影响着CVD的发展与转归[7]。外泌体(exosomes,Exos)是由包括巨噬细胞在内的多种细胞释放的囊泡,内含大量miRNAs[7-8]。本研究探讨了IS刺激巨噬细胞分泌的外泌体对心肌细胞自噬的影响,分析IS是否通过调控外泌体的miR-22表达诱导心肌细胞自噬。
材料和方法
1 细胞培养
人单核细胞株THP-1和大鼠心肌细胞株H9c2购自ATCC。THP-1细胞在含有10%胎牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的RPMI-1640培养基(HyClone)中培养。H9c2细胞在含有10%胎牛血清的DMEM培养基(Thermo Scientific)中培养。
2 方法
2.1 IS刺激巨噬细胞及外泌体分离 将THP-1细胞(5×108/L)接种到10 cm培养皿中。加入佛波酯(130 μg/L;Sigma)诱导24 h,弃去上清液,加入无血清RPMI-1640培养基,然后加入IS(500 μmol/L;Sigma)处理细胞48 h。对照组加入相同体积PBS处理。
使用ExoQuick外泌体快速提取试剂盒(Biomars)从培养基上清液中分离外泌体。具体操作为:将培养基以3 000×g离心15 min以去除细胞和细胞碎片,然后在预冲洗的离心过滤装置(Amicon Ultra-15;Millipore)中以5 000×g离心30 min;通过涡旋进一步将样品与ExoQuick-TC试剂混合,孵育过夜,在4℃下以1 500×g离心30 min,取沉淀并重悬于无酶水中。
2.2 透射电子显微镜法观察外泌体 将从细胞培养基中获得的沉淀物洗涤并重悬于0.2%多聚甲醛中。取3 μL重悬的沉淀物液滴在Formvar-碳涂层的镍电子显微镜(Electron Microscopy Sciences)格栅上,并在室温下孵育5 min,用1.75%乙酸铀酰染色,PBS洗涤格栅,并使其在室温下半干燥,然后在H7500透射电子显微镜(HITACHI)中观察外泌体。
2.3 高效液相色谱-荧光法(high-performance liquid chromatography with fluorescence detection,HPLCFLU)检测外泌体中IS 参照文献方法[9]用LC-20A+RF20A高效液相色谱系统(Shimadzu)检测外泌体中是否存在IS。
2.4 RT-qPCR分析巨噬细胞及其外泌体中miR-22的水平 通过RNA提取试剂盒(Promega)提取总RNA。使用PrimeScipt RT试剂盒(TaKaRa)和茎环引物(5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGAGTG-3')对分离的RNA进行逆转录。使用SYBR试剂盒(Bio-Rad)通过MX3000p实时PCR检测系统(Stratagene)进行实时PCR。将反应物在96孔板中于95℃扩增5 min;然后95℃10 s、55.7℃ 30 s,进行40个循环。通过2-ΔΔCt法计算miR-22的相对表达。miR-22和内参照U6的正向引物序列分别为5'-GCCTGAAGCTGCCAGTTGA-3'和5'-CTCGCTTCGGCAGCACA-3',反向引物序列分别为5'-GTGCAGGGTCCGAGGT-3'和5'-AACGCTTCACGAATTTGCGT-3'。
2.5 巨噬细胞外泌体对H9c2细胞活力的影响H9c2细胞以每孔4×104个接种于96孔板,分为对照组和不同浓度外泌体组,每组设3个平行复孔。不同浓度外泌体组分别加入含10、20、30、40和50 mg/L外泌体的培养液;对照组加入不含外泌体等体积的培养液处理。处理48 h后,使用CCK-8试剂盒(碧云天生物技术有限公司)评估细胞活力。在37℃的黑暗环境中温育1 h后,用Synergy HT多功能酶标仪(BioTek)测量每个孔在450 nm的吸光度(A)。
2.6 巨噬细胞外泌体进入H9c2细胞的内在化 将巨噬细胞外泌体在37℃的黑暗环境中用PKH26(Sigma)标记15 min后在PBS中洗涤3次,并在4℃以100 000×g离心2 h。然后,将标记的外泌体添加到制备的H9c2细胞中分别共培养12和21 h。温育后,将细胞用PBS洗涤1次,并用含4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)的 PBS将细胞核染色5 min。使用荧光显微镜观察H9c2细胞摄取巨噬细胞外泌体的情况。
2.7 Western blot检测H9c2细胞中外泌体表面标志蛋白CD63及自噬相关蛋白P62和LC3的表达 使用RIPA裂解缓冲液从经外泌体处理的H9c2细胞中(处理方法同2.5)提取总蛋白质。BCA定量后,在聚丙烯酰胺凝胶上电泳,将蛋白质样品转移到聚偏二氟乙烯膜上。将膜与Ⅰ抗[抗CD63、P62、LC3及GAPDH抗体(1∶1 000);购自Cell Signaling Technology]在4℃孵育过夜。将膜与Ⅱ抗(1∶8 000;购自Abcam)在室温下孵育2 h。使用增强型化学发光试剂检测免疫复合物。
2.8 细胞转染 取对数生长期的H9c2细胞,以每孔5×104个接种于24孔板,每孔加入含20 mg/L外泌体的培养液。然后用脂质体2000转染试剂(Sigma)分别将miR-22模拟物(miR-22 mimic)和miR-22抑制物(miR-22 inhibitor)转染入细胞。加入相应的乱码miRNA作为对照(mimic NC和inhibitor NC)。处理48 h后,收集细胞并进行上述测定。
3 统计学处理
采用SPSS 19.0进行数据分析。所有实验独立重复至少3次,结果采用均数±标准差(mean±SD)表示。使用单因素方差分析(one-way ANOVA)和独立样本t检验分析组间差异。以P<0.05为差异有统计学意义。
结 果
1 IS对巨噬细胞及其分泌的外泌体和H9c2细胞中miR-22表达的影响
在IS刺激下,通过透射电子显微镜在巨噬细胞培养基中观察到直径在40~100 nm之间的圆形结构,见图1A,并且IS刺激的巨噬细胞中外泌体表面标志蛋白CD63的水平显著高于对照组(P<0.05),见图1B,表明巨噬细胞在IS刺激下可分泌外泌体。此外,HPLC-FLU分析显示IS已在外泌体提取过程中被清除掉,见图2。与对照组相比,IS组巨噬细胞及其分泌的外泌体和H9c2细胞中miR-22的水平均显著上调(P<0.01),见图3。

Figure 2.HPLC-FLU analysis chromatogram of IS.A:macrophage-derived exosomes;B:macrophage-derived exosomes+IS.图2 IS的HPLC-FLU分析色谱图
2 外泌体进入H9c2细胞的内在化
外泌体与H9c2细胞共培养12 h后,部分PKH26标记的外泌体位于H9c2细胞的细胞质中;21 h后,可见大部分外泌体位于H9c2s细胞的细胞质中,见图4。这些数据表明,巨噬细胞外泌体可被内化到H9c2细胞中。
3 外泌体对H9c2细胞自噬的影响

Figure 3.The effect of IS on expression of miR-22 in the macrophages,macrophage-derived exosomes(Exos) and H9c2 cells.Mean±SD.n=3.**P<0.01 vs control group.图3 IS对巨噬细胞及其分泌外泌体和H9c2细胞中miR-22表达的影响
使用CCK-8法测定H9c2细胞的活力,结果显示,随着外泌体浓度的增大,H9c2细胞的活力逐渐降低(P<0.05),见图5A。与对照组相比,不同浓度外泌体均可显著上调H9c2细胞中miR-22的水平,这种影响呈剂量依赖性(P<0.05),见图5B。除了细胞活力降低和miR-22水平增加外,Western blot分析显示,巨噬细胞外泌体的刺激降低了H9c2细胞P62的表达,并促进了LC3-Ⅰ向LC3-Ⅱ的转化,这种变化呈剂量依赖性(P<0.05),见图5C,表明巨噬细胞外泌体刺激提高了H9c2细胞的自噬水平。

Figure 4.Representative photos of the H9c2 cells uptaking PKH26-labeled macrophage-derived exosomes at 12 and 21 h.图4 PKH26标记的巨噬细胞外泌体与H9c2细胞共培养12和21 h可内化到H9c2细胞中

Figure 5.Effects of macrophage-derived exosomes(Exos)on the viability and autophagy of H9c2 cells.A:the effect of Exos on the viability of H9c2 cells;B:the effect of Exos on the expression of miR-22 in the H9c2 cells;C:the effect of Exos on the protein expression of autophagy markers P62 and LC3 in the H9c2 cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图5 外泌体对H9c2细胞活力和自噬的影响
4 miR-22促进外泌体诱导的心肌细胞自噬
在巨噬细胞外泌体刺激下,用miR-22抑制物转染的H9c2细胞比用阴性对照miRNA转染的细胞具有更高的活力,而与miR-22模拟物转染的细胞相比,相应的对照细胞表现出更高的活力,见图6A。探讨miR-22表达的改变是否会影响自噬的实验结果显示,在巨噬细胞外泌体刺激条件下,miR-22模拟物转染的H9c2细胞与相应的阴性对照miRNA转染的细胞相比具有显著更高的LC3-Ⅱ/LC3-Ⅰ比率及更低的P62蛋白表达水平;而miR-22抑制物则产生了相反的结果,见图6B。这些结果证实了miR-22在一定程度上参与了巨噬细胞外泌体促进心肌细胞自噬的过程。
讨 论
透析患者的心血管疾病具有复杂且多方面的病理生理学特征,与收缩和舒张功能障碍、容量超负荷、动脉高血压和交感神经活化均有关[10]。除了这些传统的危险因素外,越来越多的证据表明,尿毒症毒素可能与CKD患者的CVD发展有关[2-3]。IS是肠道来源的尿毒症毒素,近年来研究显示其对心肌细胞和心脏成纤维细胞具有促肥大、促纤维化和促炎作用[11]。在一项针对258名尿毒症患者的多中心研究中,IS水平升高与随后的心力衰竭相关[12]。巨噬细胞是尿毒症微环境的重要组成部分之一,先前研究发现IS可直接调控巨噬细胞的功能,促进其介导的心肌纤维化[13-14]。本研究发现,IS刺激下可促进巨噬细胞分泌外泌体,并且外泌体与H9c2细胞共培养可显著增加H9c2细胞的自噬水平。因此,巨噬细胞分泌的外泌体可能在IS诱导的心肌细胞自噬中发挥重要作用。
外泌体是新近发现的一类小囊泡,被认为是细胞间通信的主要方式之一,其分泌可见于包括巨噬细胞在内的几乎所有细胞[15]。外泌体的主要特征包括杯状形态、40~100 nm直径和特定脂质筏蛋白如CD63的富集[16]。本研究观察到巨噬细胞分泌的外泌体的直径在40~100 nm之间,呈圆形结构。外泌体中含有大量miRNAs,其中一些miRNAs已成为心血管疾病基因表达的重要调节因子。先前的研究表明,循环miR-22可以通过靶向p38α来促进饥饿心肌细胞的自噬[5]。此外,据报道miR-22过表达可以促进结直肠癌细胞中的自噬,这表明miR-22在细胞自噬中具有重要作用[6]。本研究中,IS刺激可显著促进巨噬细胞及其分泌的外泌体中miR-22的上调,并且miR-22上调可显著促进LC3-Ⅰ向LC3-Ⅱ转化,同时降低P62蛋白的表达,而转染miR-22抑制物则产生了相反的结果。LC3是关键的自噬调节蛋白,有Ⅰ型和Ⅱ型两个亚型,其中,LC3-Ⅱ型蛋白的生成与自噬的发生有关[17]。P62在细胞质中合成,当自噬发生时,P62与LC3-Ⅱ蛋白结合,并在自噬溶酶体中降解[17]。因此,P62水平会随着自噬的发生而降低。这些结果证实了miR-22参与了巨噬细胞外泌体诱导的心肌细胞自噬。
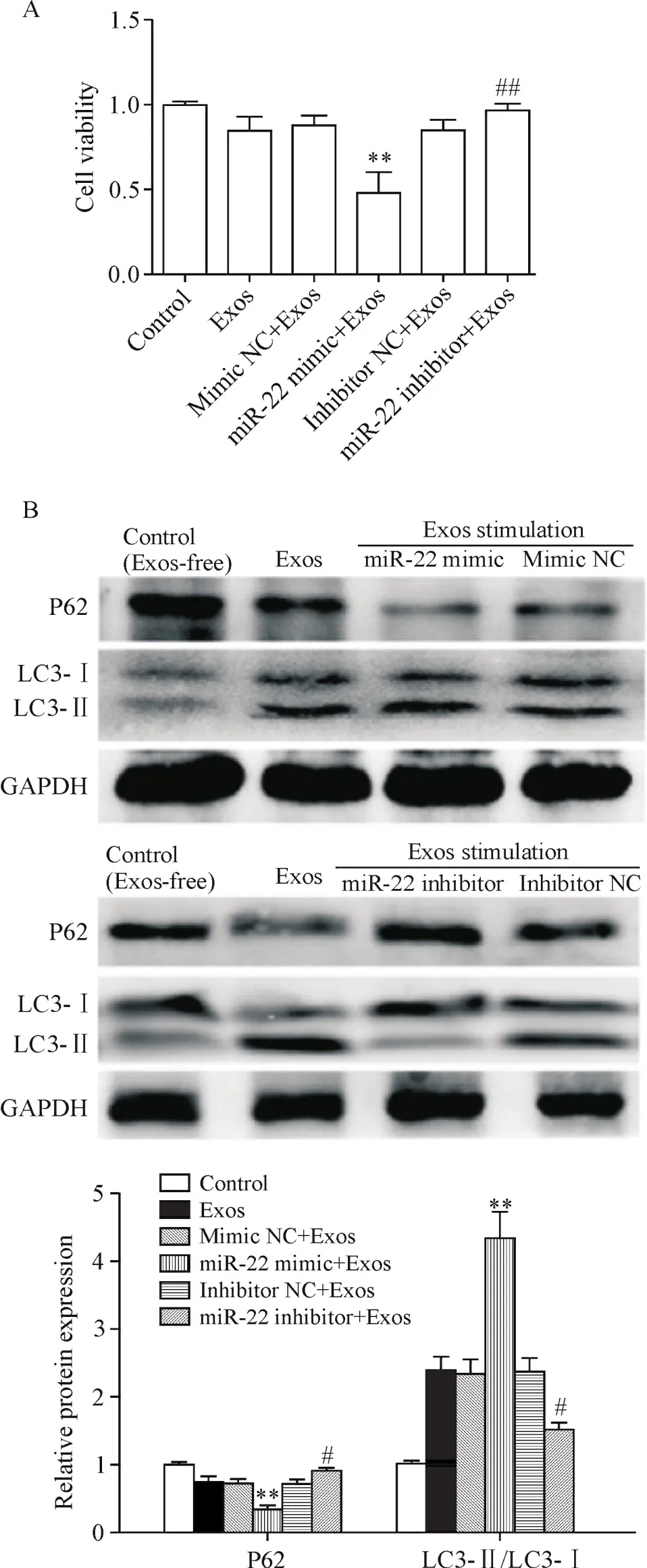
Figure 6.miR-22 promoted autophagy of H9c2 cells induced by macrophage-derived exosomes(Exos).A:the effect of miR-22 mimic and miR-22 inhibitor on the viability of H9c2 cells induced by Exos;B:the effects of miR-22 mimic and miR-22 inhibitor on the protein expression of autophagy markers P62 and LC3 in the H9c2 cells.Mean±SD.n=3.**P<0.01 vs mimic NC+Exos group;#P<0.05,##P<0.01 vs inhibitor NC+Exos group.图6 miR-22促进巨噬细胞外泌体诱导的H9c2细胞自噬
综上所述,IS刺激的巨噬细胞可通过外泌体途径上调心肌细胞miR-22的表达,促进心肌细胞的自噬反应。这揭示了一种新的心肌细胞在尿毒症微环境下发生自噬的调控机制。
