乔松素对内质网应激所致内皮细胞凋亡的抑制作用及机制*
2020-07-06郭亚新王晓旭宗传龙姚树桐秦树存
于 飞,田 华,卢 珊,郭亚新,王晓旭,,焦 鹏,宗传龙,姚树桐,△,秦树存△
[山东第一医科大学(山东省医学科学院)1基础医学院,2动脉粥样硬化研究所,山东省高校动脉粥样硬化重点实验室,3生命科学学院,山东泰安27100]
动脉粥样硬化(atherosclerosis,AS)是多种细胞介导下的慢性炎症性病理过程,作为心脑血管疾病的主要病理基础,严重危害人类的健康。血管内皮细胞、平滑肌细胞、单核/巨噬细胞等均参与AS的发生发展,其中血管内皮细胞损伤和凋亡是AS发病的始动环节,因此保护血管内皮细胞对于AS的防治具有重要意义[1]。有研究表明,摄入富含黄酮类食物的量与AS的发生率和死亡率呈负相关,其中蜂胶黄酮具有广泛的抗AS功能[2]。
乔松素(pinocembrin)是一种存在于植物和蜂胶中含量较高的黄酮类天然化合物,具有抗菌、抗原虫、抗氧化、抗凋亡等多种药理学活性。另有研究表明,辛伐他汀和乔松素联合治疗ApoE-/-小鼠14周可显著降低小鼠血清脂质水平,改善内皮细胞功能,减轻AS病变,并且联合疗法的疗效优于单用辛伐他汀[3],且单独应用乔松素可使ApoE-/-小鼠AS斑块面积缩小,降低血清中和斑块内血管内皮生长因子的水平,并具有防止斑块破裂和稳定斑块的作用[4]。乔松素可减轻脂多糖诱导的内皮细胞凋亡,其机制可能与抑制核因子κB p65活化有关[5]。大量研究证实内质网应激(endoplasmic reticulum stress,ERS)信号途径介导AS的发生发展尤其是易损性斑块的形成[6-8]。ERS凋亡途径在棕榈酸和氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导的血管内皮细胞凋亡中具有重要作用[9-10]。本课题组既往研究证实,蜂胶醇提物可通过抑制ERS凋亡途径关键分子C/EBP同源蛋白(C/EBP homologous protein,CHOP)的表达减轻ox-LDL诱导的血管内皮细胞凋亡[11],但是蜂胶醇提物中发挥细胞保护作用的有效成分及其调控CHOP的上游分子机制尚未被完全阐明。本研究在ERS诱导剂衣霉素(tunicamycin,TM)诱导的人脐静脉内皮细胞(human umbilicalvein endothelial cells,HUVECs)损伤模型上,探讨乔松素对CHOP表达、CHOP上游调控蛋白——蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)磷酸化水平及活化转录因子6(activating transcription factor 6,ATF6)核转位的影响,以进一步明确蜂胶黄酮抗AS的有效成分并深入探讨其对内皮细胞凋亡的调控作用及机制。
材料和方法
1 主要试剂
乔松素、TM和小鼠抗β-actin抗体购自Sigma;MTT购自 Genview;Annexin V-FITC/碘化丙啶(propidium iodide,PI)凋亡测定试剂盒和Hoechst 33342/PI双染试剂盒分别购自南京凯基和南京建成公司;RIPA裂解液和BCA蛋白定量试剂盒购自Solarbio;兔抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、ATF6、p-PERK、p-eIF2α 和CHOP多克隆抗体及AlexaFluor 488标记的驴抗兔II抗购自Cell Signaling Technology、Sigma和Invitrogen;DAPI和辣根过氧化物酶标记的II抗分别购自上海碧云天和北京中杉金桥公司;ECL试剂盒和PVDF膜分别购自Pierce和Millpore。
2 方法
2.1 细胞培养与实验分组 HUVECs由中国科学院上海生物化学与细胞生物学研究所细胞库提供,用DMEM培养液(含10%FBS+1×105U/L青霉素+100 mg/L链霉素)在37℃、5%CO2的培养箱中培养。处理前换无血清培养液同步化12 h,然后参照文献报道及本课题组的预实验结果随机分为如下3组:(1)正常对照(control)组:培养液中常规培养;(2)TM组:培养液中加入10 mg/L的TM[12];(3)乔松素干预(pinocembrin)组:分别在培养液中先加入6.25、12.5、25 和 50 mg/L[13]乔松素预处理 1 h,再加入 10 mg/L的TM。培养24 h后收集细胞。
2.2 细胞活力和乳酸脱氢酶(lactate dehydrogenase,LDH)的测定 接种于96孔板的细胞按照上述分组处理后,按既往报道的MTT法[13]检测细胞活力。以正常对照组细胞活力为100%,其余各组细胞活力以其吸光度(A)值占对照组A值的百分比表示。培养液中LDH活性检测按照试剂盒说明进行。
2.3 Hoechst 33342/PI双染色荧光显微镜观测细胞死亡情况 接种细胞于放有无菌盖玻片的6孔培养板中,经处理后吸弃培养液,将100倍稀释的Hoechst 33342染色液加到细胞爬片上,37℃避光孵育15 min;PBS润洗后将200倍稀释的PI染色液加到爬片上,室温避光孵育10 min;PBS润洗后抗淬灭剂封片。激光共聚焦显微镜(Olympus)下观察(Hoechst 33342激发光波长352 nm,呈蓝色;PI激发光波长488 nm,呈红色)。PI阳性率(%)=红色细胞数/蓝色细胞数×100%。
2.4 Annexin V-FITC/PI双染流式细胞术检测 细胞接种于6孔培养板内经相应处理后,用胰酶消化,100×g离心5 min,弃上清,收集细胞并重悬于500 μL上样缓冲液中,加入 5 μL Annexin V-FITC 和 5 μL PI,轻微摇匀后,室温避光孵育15 min,随即在流式细胞仪(Becton Dickinson)上检测。总细胞凋亡率(%)=早期凋亡率(Annexin+/PI-)+晚期凋亡率(Annexin+/PI+)。
2.5 免疫荧光细胞化学法检测ATF6核转位情况 细胞接种于放有无菌盖玻片的6孔培养板内,处理后经PBS润洗3次,4%多聚甲醛固定20 min,PBS润洗后以0.1%Triton X-100室温透化5 min,以10%驴血清封闭30 min,滴加兔抗人ATF6抗体(1∶100),4℃孵育过夜,PBS润洗后滴加Alexa Fluor 488标记的驴抗兔IgG(1∶500),37℃避光孵育30 min,再以DAPI复染细胞核(蓝色)5 min,PBS充分润洗后以抗淬灭剂封片。激光共聚焦显微镜下观察,细胞核呈蓝色,ATF6呈绿色。
2.6 Western blot分析 采用RIPA试剂提取各组细胞总蛋白,BCA法测定蛋白浓度。调整蛋白浓度一致后进行SDS-PAGE分离,电转至PVDF膜后室温封闭,分别加入兔抗 p-PERK(1∶200)、p-eIF2α(1∶200)、GRP78(1∶500)和CHOP(1∶500)多克隆抗体及小鼠抗β-actin(1∶1 000)多克隆抗体,4℃孵育过夜,TBST洗膜后加入Ⅱ抗(1∶2 000)孵育2 h,经化学显色底物ECL进行发光显示,应用化学发光成像系统(上海欧翔科学仪器有限公司)进行图像采集。采用Image-Pro Plus图像分析软件(Version 6.0,Media Cybernetics)分析蛋白条带积分吸光度(integral absorbance,IA),以靶蛋白IA/β-actinIA的比值反映靶蛋白相对水平。
3 统计学处理
结果用均数±标准差(mean±SD)表示。采用SPSS 13.0统计软件进行单因素方差分析,组间两两比较应用SNK法,以P<0.05为差异有统计学意义。
结 果
1 乔松素抑制TM所致的HUVECs活力降低
用 6.25、12.5、25和 50 mg/L的乔松素处理HUVECs 24 h,与正常对照组相比,6.25、12.5和25 mg/L乔松素处理组细胞活力无显著改变(P>0.05),而50 mg/L乔松素处理组细胞活力显著降低(P<0.05),表明剂量为6.25~25 mg/L的乔松素对细胞无毒性作用,见图1A。与对照组相比,TM处理细胞24 h后细胞活力显著降低(P<0.01),然而给予乔松素预处理1 h,细胞活力较TM组显著增加,尤其以12.5和25 mg/L乔松素处理组更为显著(P<0.05或P<0.01),见图1B。
2 乔松素抑制TM所致的HUVECs膜损伤
TM组细胞LDH漏出显著增加(P<0.01),而乔松素(12.5和25 mg/L)预处理组LDH漏出较TM组显著减少(P<0.05或P<0.01),见图 2A。Hoechst 33342/PI双染法观察细胞形态,TM组细胞膜通透性增加甚至破裂,从而允许PI穿过细胞膜至核内与DNA结合,细胞核红色荧光阳性细胞增加(P<0.01),而乔松素(12.5和25 mg/L)预处理组细胞膜损伤减轻,表现为细胞核红色荧光阳性细胞数显著减少(P<0.01),见图2B。
3 乔松素减轻TM所致的HUVECs凋亡
流式细胞术结果显示,TM组细胞凋亡率显著增加,为对照组的4.3倍(P<0.01);与TM组比较,12.5和25 mg/L的乔松素预处理组细胞凋亡率分别降低15.3%和22.1%(P<0.05和P<0.01),见图3。
4 乔松素抑制TM所诱导的HUVECs内GRP78和CHOP上调
与对照组相比,TM组GRP78和CHOP表达显著升高(P<0.01),而乔松素(12.5和25 mg/L)预处理可显著抑制TM所诱导的GRP78和CHOP上调(P<0.05或P<0.01),见图4。
5 乔松素抑制TM所致的HUVECs内ATF6核转位
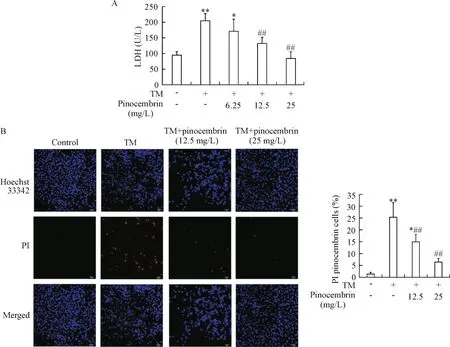
Figure 2.Effect of pinocembrin on TM-induced membrane damage in HUVECs.The cells were pretreated with the indicated doses of pinocembrin for 1 h,and then stimulated with TM(10 mg/L)for 24 h.The degree of cell membrane damage was determined by LDH activity in media(A)and Hoechst 33342(blue)/PI(red)double-staining assay(B).Images were captured using a laser scanning confocal microscope,and PI-positive cells in 5 randomly chosen fields each containing about 100 cells were quantified(scale bar=20 μm).Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;##P<0.01 vs TM group.图2 乔松素对TM所致的HUVECs膜损伤的影响
采用免疫荧光染色法显示ATF6核转位情况,对照组绿色荧光主要分布于细胞浆,而核内很少或者无表达;TM组细胞核内出现强绿色荧光染色;而与TM组相比,乔松素(12.5和25mg/L)预处理组的细胞核内绿色荧光强度显著降低,见图5。
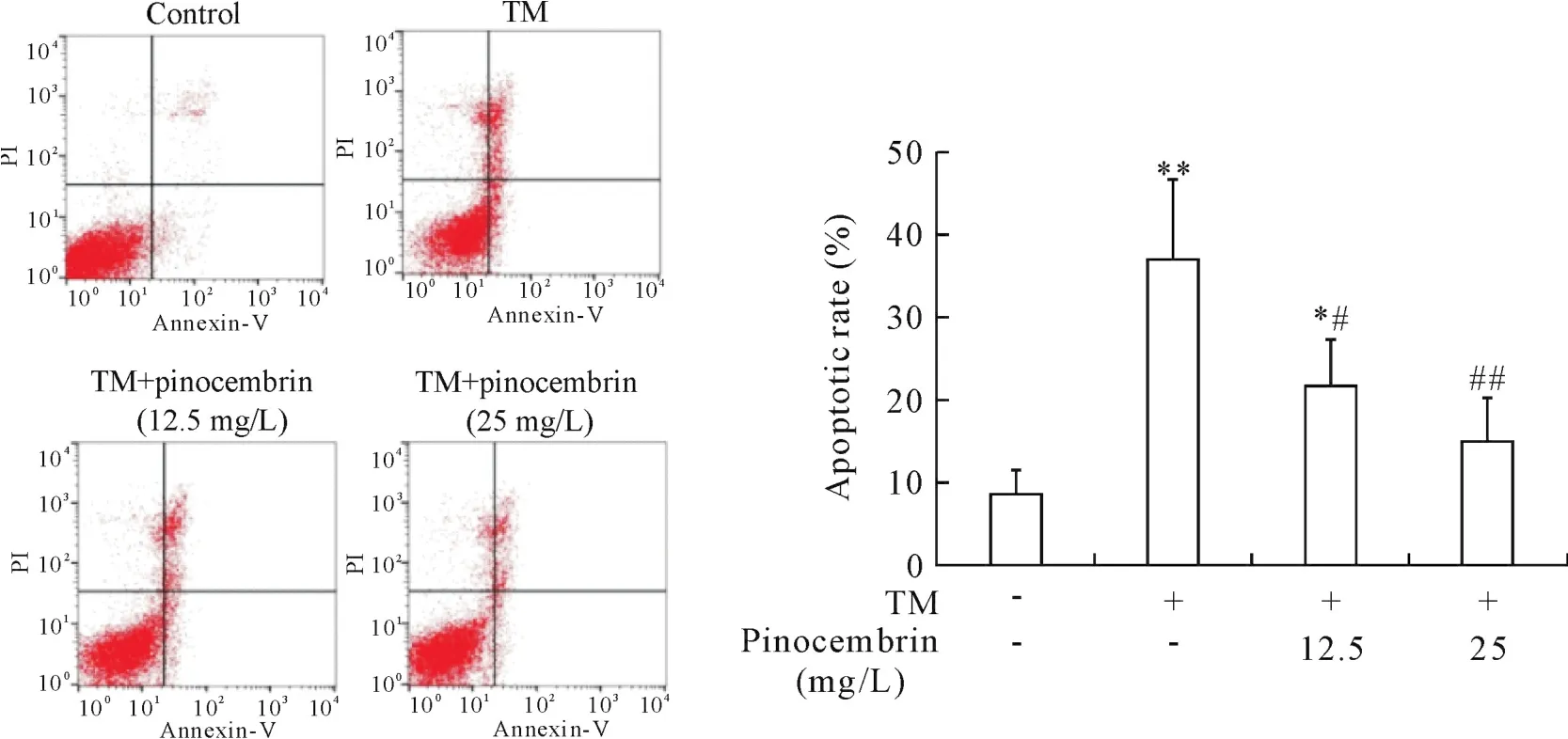
Figure 3.Effect of pinocembrin on TM-induced apoptosis of HUVECs.The cells were pretreated with 12.5 and 25 mg/L of pinocembrin for 1 h,and then treated with TM(10 mg/L)for 24 h.The cell apoptosis was analyzed by flow cytometry with Annexin V-FITC/PI staining,and the total apoptotic rates(early-and late-stage apoptosis)were calculated.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TM group.图3 乔松素对TM所致HUVECs凋亡的影响
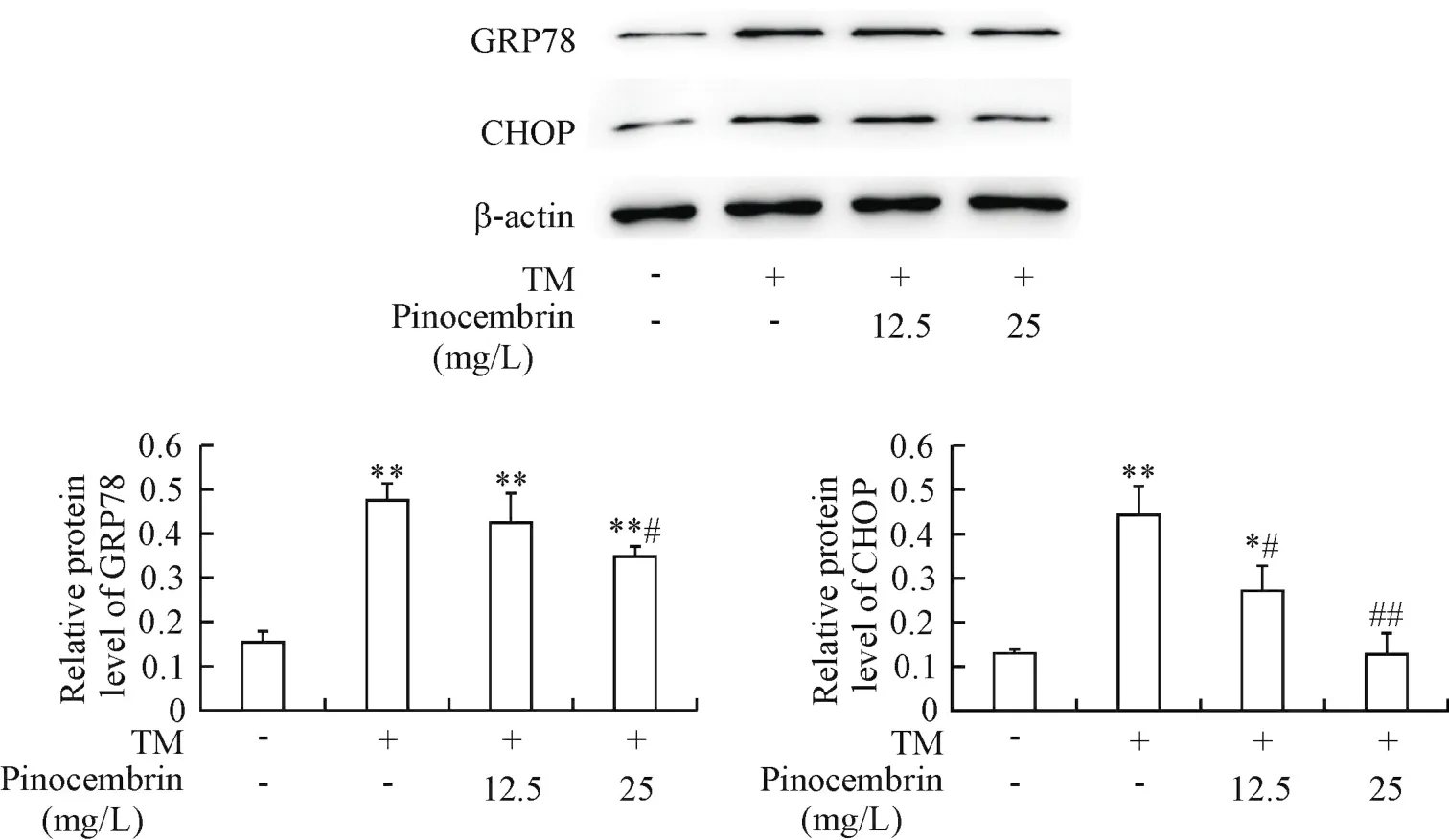
Figure 4.Effect of pinocembrin on the protein expression of GRP78 and CHOP in TM-treated HUVECs.The cells were treated as described in Figure 3.The protein expression levels of GRP78 and CHOP were detected by Western blot.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TM group.图4 乔松素对TM所致的HUVECs内GRP78和CHOP表达的影响
6 乔松素抑制TM所致的HUVECs内PERK和eIF2α磷酸化
与对照组相比,TM处理组p-PERK和p-eIF2α水平显著升高(P<0.01),而乔松素(12.5和25 mg/L)预处理可显著减轻PERK和eIF2α的磷酸化水平(P<0.05或P<0.01),见图6。
讨 论
血管内皮细胞损伤及功能紊乱是AS发生发展的始动环节,ox-LDL、晚期糖基化终产物(advanced glycation end products,AGEs)和异常血流剪切应力等多种病理性致AS因素均可诱导ERS介导的内皮细胞凋亡,因此减轻ERS介导的血管内皮细胞凋亡被认为是AS防治的重要措施[14-16]。既往对乔松素的研究表明,其具有抗氧化、抗炎和神经保护作用[17]。对于心血管疾病的研究表明乔松素可使ApoE-/-小鼠动脉粥样硬化斑块面积缩小,也可降低血清中和斑块内血管内皮生长因子及内皮素的水平,对斑块产生有抑制作用,同时还具有防止斑块破裂和稳定斑块的作用[3-4],但其具体细胞分子机制尚待进一步阐明。本研究结果显示,给予ERS诱导剂TM处理HUVECs 24 h,细胞活力显著降低,细胞膜损伤程度和凋亡率显著增加,与文献报道[12,18]一致。而给予乔松素预处理可显著抑制TM所诱导的HUVECs损伤,表现为细胞活力增加,细胞膜损伤程度和凋亡率降低,且呈浓度依赖性。这些结果提示乔松素可减轻HUVECs损伤,其机制可能与抑制ERS介导的凋亡途径有关。

Figure 5.Effect of pinocembrin on ATF6 nuclear translocation in HUVECs induced by TM.The cells were treated as described in Figure 3.Immunofluorescence experiments showed ATF6 visualized by Alexa Fluor 488(green)and nuclei stained with DAPI(blue).The representative fluorescence images were captured by a laser scanning confocal microscope(scale bar=20 μm).图5 乔松素对TM所致HUVECs内ATF6核转位的影响
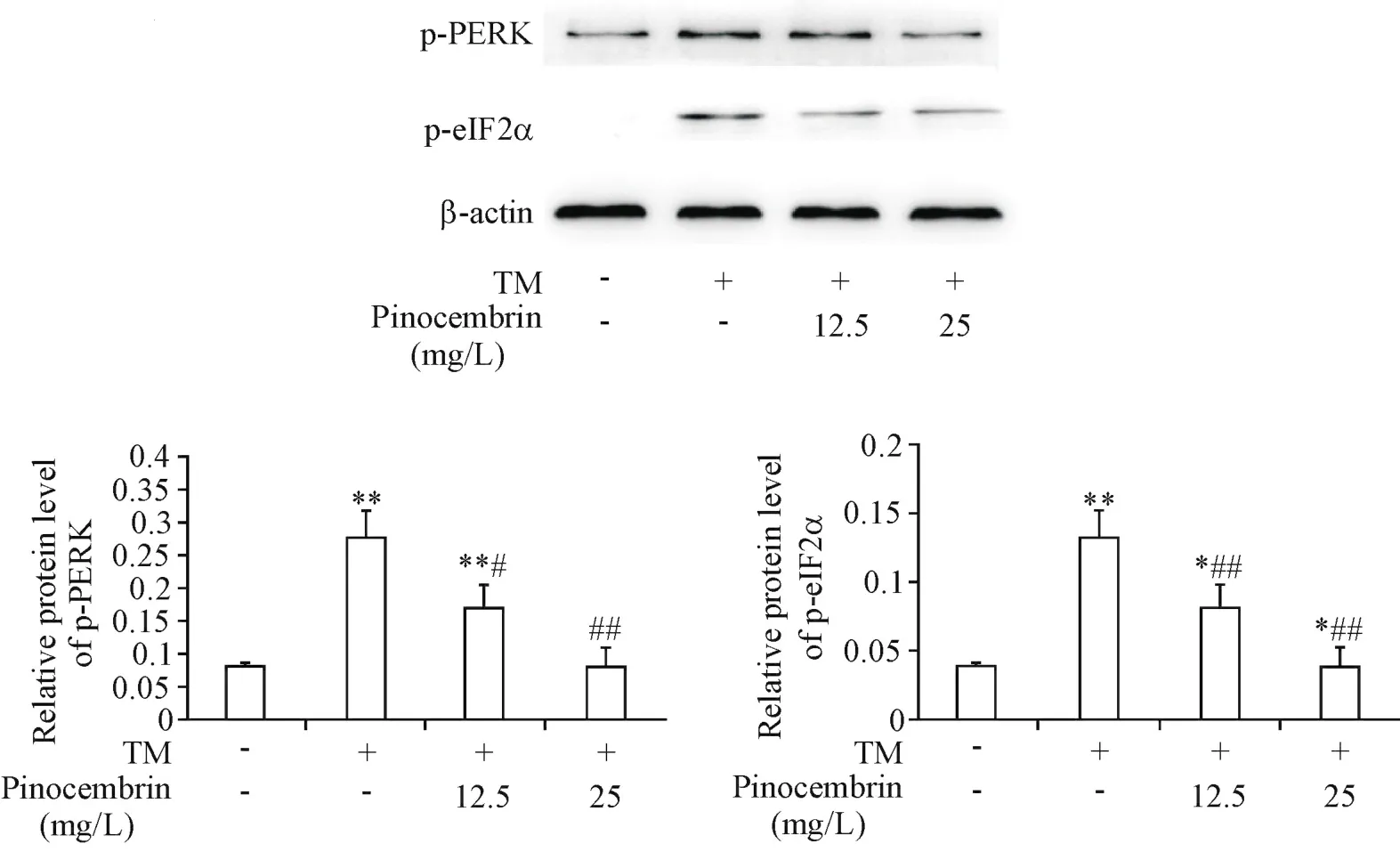
Figure 6.Influence of pinocembrin on the phosphorylation levels of PERK and eIF2α in TM-treated HUVECs.The cells were treated as described in Figure 3.The protein levels of p-PERK and p-eIF2α were detected by Western blot.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TM group.图6 乔松素对TM所致的HUVECs内PERK和eIF2α磷酸化水平的影响
既往研究证实,抑制炎症反应是乔松素发挥其细胞保护作用的重要机制。乔松素在脂多糖诱导的巨噬细胞炎症模型中可抑制核因子κB以及细胞外信号调节激酶1/2、c-Jun氨基末端激酶和p38丝裂原激活蛋白激酶的磷酸化,进而调节肿瘤坏死因子α、白细胞介素1β、白细胞介素6、白细胞介素10等细胞因子的分泌[19]。蜂胶醇提物和乔松素均可抑制脂多糖诱导的巨噬细胞凋亡和基质金属蛋白酶9基因表达及活性[20]。另有研究表明乔松素可通过抑制核因子κB和p38丝裂原激活蛋白激酶信号通路介导的炎症因子的释放减轻脂多糖和ox-LDL诱导的内皮细胞损伤和凋亡[5,21]。内质网也是损伤感知或凋亡信号整合的主要位点,且过度的ERS可介导细胞凋亡,在动脉粥样硬化发生发展中发挥着重要作用。CHOP又称生长停滞和DNA损伤蛋白153,是介导ERS相关凋亡途径的关键分子之一[22]。CHOP介导的巨噬细胞和血管内皮细胞凋亡参与AS进展尤其是不稳定AS粥样斑块的形成[23-24]。本课题组前期工作证实ox-LDL、氧化和糖基化高密度脂蛋白均可通过激活CHOP介导的ERS凋亡途径诱导巨噬细胞凋亡[25-27],而蜂胶提取物及其黄酮单体槲皮素可通过抑制氧化应激,下调CHOP表达从而减轻ox-LDL诱导的巨噬细胞和血管内皮细胞凋亡[11,28-29],这些结果表明CHOP介导的ERS凋亡途径参与AS发生发展,并可能成为AS防治靶点,但是乔松素对CHOP介导的血管内皮细胞凋亡是否具有抑制作用尚未见文献报道。本实验结果显示,ERS诱导剂TM可上调HUVECs内ERS标志分子GRP78和促凋亡蛋白CHOP的表达水平,而乔松素可显著拮抗两者的上调,表明乔松素可通过抑制CHOP信号通路减轻HUVECs凋亡。
CHOP主要受PERK-eIF2α-ATF4通路调控,也可被ATF6和肌醇需求酶1(inositol-requiring enzyme 1,IREl)上调转录水平[22]。本课题组前期工作证实PERK和ATF6可介导ox-LDL和氧化高密度脂蛋白所诱导的巨噬细胞凋亡[25,27],而蜂胶醇提物可通过抑制PERK-eIF2α-CHOP信号通路减轻ox-LDL和TM诱导的巨噬细胞凋亡[30]。本实验结果显示,TM处理组可上调PERK和eIF2α的磷酸化以及ATF6核转位,而乔松素则显著逆转TM所致的上述变化,并呈剂量依赖性,说明乔松素可以通过抑制PERK-eIF2α和ATF6这两条ERS信号通路的激活来降低CHOP的表达,从而减少TM所致的HUVECs凋亡。
综上所述,本研究显示乔松素可减轻ERS所介导的HUVECs凋亡,其机制可能与抑制PERK-eIF2α和ATF6信号通路,进而下调CHOP表达有关。但鉴于本工作是以HUVECs为研究对象的体外细胞水平实验,与临床人体疾病的复杂性有着很大的区别,因此有关乔松素等黄酮类化合物抗AS的临床研究还有待进一步开展。
