荧光标记DNA-磁性氧化石墨烯磁分离技术快速检测鸡肉中沙门氏菌
2020-07-06孟圆圆刘丽莉杨晓盼代晓凝陈珂
孟圆圆,刘丽莉,杨晓盼,代晓凝,陈珂
(河南科技大学 食品与生物工程学院,食品加工与安全国家级教学示范中心,河南 洛阳,471023)
沙门氏菌是一种在自然界中普遍存在,能在人和动物的肠道内寄生并引起人畜共患病和食物中毒,严重威胁人和动物生命健康的革兰氏阴性致病菌[1]。已知沙门氏菌有2 600多个血清型,具有菌种种类多、分布广且具有地域性、危害大等特点[2],该菌的传播媒介主要通过畜禽肉(尤其是鸡肉)、禽蛋、奶及海产品等营养丰富的食物进行传播,极易污染水源,每年由其所引起的细菌性食物中毒事件约占其他食源性病原菌的40%,在我国乃至世界全球范围内一直高居首位[3]。
目前,用于检测沙门氏菌的方法主要包括传统培养法、分子生物学方法和免疫学方法[4]。作为“金标准”的传统培养法,需要进行前增菌、分离、生化试验和血清学鉴定等处理,虽结果可靠性强,但操作步骤繁琐复杂且耗时耗力,一般需要4~7 d才能得出检测结果[5]。分子生物学方法如聚合酶链式反应[6]、基因芯片技术[7]、环介导等温扩增技术[8]、生物传感器技术[9]等具有特异性强、灵敏度高的优势,但对实验环境及技术人员要求较高且成本昂贵,难以在现场实现快速检测及在基层普及[10];免疫学方法如酶联免疫吸附法[11]、免疫磁珠分离法[12]、免疫试纸条法[13]等虽重现性较好,但检出限较高且易交叉污染,检测结果可能出现假阳性现象[14]。基于以上检测方法都存在不足之处,因此,开发一种快速、高效、灵敏度高且特异性强的沙门氏菌检测方法具有重要意义。
近年来,利用荧光标记与磁性纳米材料相结合的方法检测细菌因具有检测周期短、灵敏度及准确度高而成为当前国内外学者研究的热点。如车玉兰[15]分别对大肠杆菌和沙门氏菌的适配体进行荧光标记并与易操控的纳米磁富集结合,建立了检测细菌的高效分析方法及微流控芯片法。LI等[16]建立了一种不同磁性梯度的荧光-磁性纳米探针快速分离和检测多种病原菌的方法。YU等[17]利用基于磁性Fe3O4纳米粒子和杂交链反应的荧光级联放大法检测沙门氏菌,在生菜中检出限可达6.9×102CFU/g。HU等[18]实验采用比色-荧光-磁性纳米球的多模式平台检测沙门氏菌。以上研究主要基于磁性纳米粒子与荧光标记相结合的方法对细菌进行检测,但利用Fe3O4/GO纳米复合材料与荧光标记DNA相结合用于检测沙门氏菌的报道还未出现。
本文通过化学共沉淀法制备Fe3O4/GO,Fe3O4/GO除具有顺磁性外,还具备荧光猝灭作用及对单链DNA强烈的吸附能力,本研究充分利用Fe3O4/GO和荧光标记DNA探针的优点,采用荧光标记DNA-磁性氧化石墨烯磁分离技术对沙门氏菌目标DNA的检测条件进行了优化,在最优条件下,对人工模拟污染鸡肉样品中的沙门氏菌进行了检测,得出沙门氏菌菌落总数对数与相对荧光强度F/F0之间的定量关系,建立快速、选择性好、灵敏度高且特异性强的沙门氏菌检测新方法,旨在为沙门氏菌的检测提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
氧化石墨烯,南京先丰纳米材料科技有限公司;KH2PO4、Na2HPO4、KCl(分析纯),天津市德恩化学试剂有限公司;NaCl(分析纯),江苏强盛功能化学股份有限公司;胰蛋白胨、酵母浸膏(生化试剂),北京奥博星生物技术有限责任公司;沙门氏菌显色培养基,南通凯恒生物科技发展有限公司;FeCl3、FeCl2,天津市福晨化学试剂厂;氨水(分析纯),上海强顺化学试剂有限公司;沙门氏菌(ATCC 14028)、大肠杆菌(ATCC 25922)、金黄色葡萄球菌(CMCC 26003),微生物实验室老师友情馈赠;所有DNA序列,均由上海生工生物工程股份有限公司合成;细菌基因组DNA提取试剂盒,上海捷瑞生物工程有限公司。
1.2 仪器与设备
DY04-13-44-00型压力蒸汽灭菌锅,上海东亚压力容器制造有限公司;THZ-1038型恒温培养摇床,上海一恒科学仪器有限公司;DH-600型电热恒温培养箱,北京科伟永兴仪器有限公司;BBS-V800型洁净工作台,济南鑫贝西生物技术有限公司;BE-1100型四维旋转混匀器,海门市其林贝尔仪器有限公司; KQ2200型超声波清洗仪,昆山市超声波清洗仪;35172 BRUZ型拍击式均质机,法国AES Chemuex公司;DZKW-S-4型电热恒温水浴锅,北京市永光明医疗仪器有限公司;Cary eclpise型荧光分光光度计,美国安捷伦公司;
1.3 实验方法
1.3.1 Fe3O4/GO的制备
参考刘闯[19]的方法并改进。采用化学共沉淀法制备Fe3O4/GO,分别取2 g FeCl3和1 g FeCl2加入到100 mL灭菌超纯水中,超声处理2 h得溶液A;取 0.3 g GO加入到100 mL灭菌超纯水中,超声处理4 h得溶液B;将以上2种溶液进行混合,同时加入30%氨水将溶液pH调整为9~10,置于水浴锅中加热到90 ℃,同时搅拌至混合物颜色完全变黑,将其从水浴锅中取出自然冷却到室温,然后放入离心机中离心得到黑色固体,用灭菌超纯水和无水乙醇洗涤数次至混合物上清液的pH为7左右,再将黑色固体置于 70 ℃的真空干燥箱中烘干,即可制得Fe3O4/GO。
1.3.2 DNA序列设计
本实验参考相关文献,采用软件Primer Premier 5.0对3条DNA序列进行设计,并用Ribosomal Database Project Ⅱ和NCBI Blast 2数据库提供的Probe Match软件检测序列的特异性[5, 20]。设计的DNA序列如表1所示。
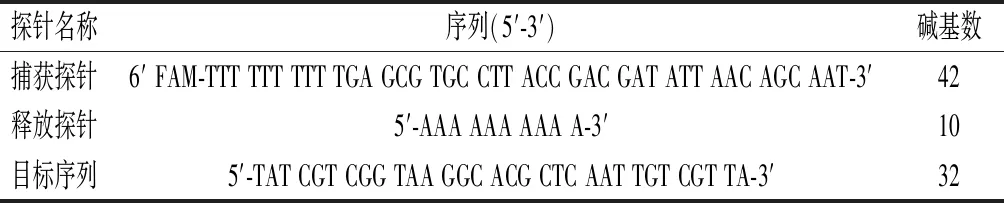
表1 探针碱基序列Table 1 Probe base sequence
1.3.3 沙门氏菌目标DNA检测条件的优化
分别考察Fe3O4/GO质量浓度(4×10-5、8×10-5、1.2×10-4、1.6×10-4、2.0×10-4、2.4×10-4、2.8×10-4、3.2×10-4、3.6×10-4g/mL)、Fe3O4/GO与捕获探针反应时间(0、3、9、21、24、27、42、60、80、100 min)及反应温度(31、34、37、40、43 ℃)对荧光猝灭作用的影响。考察DNA探针杂交时间(30、60、90、120、150 min)和富集倍数(1、3、5、7、9倍)对荧光强度的影响。
1.3.4 沙门氏菌目标DNA的检测
将Fe3O4/GO与捕获探针在最优条件下进行反应,得到Fe3O4/GO捕获探针复合物溶液,磁分离收集磁性颗粒,移除原溶液,并用PBS缓冲液清洗磁性颗粒以除去未反应的DNA。然后吸取PBS缓冲液配置的一系列浓度的沙门氏菌目标DNA溶液,以灭菌超纯水代替沙门氏菌目标DNA溶液为空白对照,分别加入到磁性颗粒中,在42 ℃条件下反应一定时间以完成部分杂交,然后置于磁场中磁分离10 min,收集磁性颗粒,移除原溶液,除去未反应的DNA。再吸取用PBS缓冲液稀释一定浓度的释放探针溶液加入到磁性颗粒中,并进行富集,在42 ℃条件下反应2 h,根据碱基互补配对原则完成杂交试验。完成杂交之后的DNA双链将脱离Fe3O4/GO表面,荧光恢复,再利用磁场磁性分离Fe3O4/GO,并将上清液置于荧光石英比色皿中,在激发波长为λex=495 nm,发射波长λem=517 nm,激发狭缝和发射狭缝均为10 nm条件下,采用荧光分光光度计进行测定,并扣除自身荧光背景吸收,即可对沙门氏菌进行定量分析。
1.3.5 沙门氏菌的培养
用移液抢吸取1 mL实验室保藏的沙门氏菌菌液于装有50 mL 灭菌LB营养肉汤培养基的锥形瓶中,置于37 ℃的恒温培养摇床上振荡培养过夜,使沙门氏菌菌种分散、活化,并用PBS溶液稀释至10-1~10-9浓度备用[15]。
1.3.6 人工模拟污染鸡肉中沙门氏菌DNA的提取与检测
人工模拟沙门氏菌污染鸡肉参考胡冰雪[21]的方法并加以改进,在无菌条件下,分别取25 g冰鲜鸡胸肉与225 mL灭菌营养肉汤培养基进行混合,置于无菌均质袋中37 ℃均质1 min,等量分装成10份,在离心机中3 000 r/min离心5 min,悬浮液用0.45 μm的滤膜进行过滤,将过滤后的肉汤置于-20 ℃条件下冷藏待用。
分别吸取上述稀释菌液100 μL于灭菌沙门氏菌显色培养基上,置于37 ℃的恒温培养箱中培养24 h,根据平板菌落划线法算得沙门氏菌数量为2.8×107CFU/mL。用PBS溶液将沙门氏菌的数量稀释为1.0×101~1.0×107CFU/mL的标准菌液,将所稀释的标准菌液分别加入到25 mL肉汤中,对照组中加入灭菌的营养肉汤培养基[21-22]。再向以上每份肉汤中加入25 mL灭菌后的营养肉汤培养基,摇匀后置于37 ℃的恒温振荡培养箱150 r/min振荡24 h,吸取1 mL各浓度梯度的菌液用GenerayTMBiotechnology公司生产的细菌基因组DNA提取试剂盒(GK1072)提取沙门氏菌的DNA,并置于95 ℃水浴锅中5 min,然后在0 ℃条件下冰浴5 min,以打开双链,制备出单链DNA作为沙门氏菌目标DNA[22],利用荧光标记DNA-磁性氧化石墨烯磁分离技术对人工模拟污染鸡肉中的沙门氏菌进行检测,得出其最低检出限及沙门氏菌菌落总数对数与相对荧光强度F/F0之间的定量关系,以此来判断本方法的准确性和可行性。
1.3.7 特异性分析
为考察所建立检测方法的特异性,以沙门氏菌为实验组,大肠杆菌和金黄色葡萄球菌为对照组,利用试剂盒提取其DNA,并进行荧光测定。
1.3.8 数据处理
每组试验重复3次取平均值,且所有的荧光光谱图均扣除其背景吸收,采用ChemDraw 18.0软件绘制示意图及Origin 8.5软件对试验数据进行统计分析并作图。
2 结果与分析
2.1 实验原理
当向Fe3O4/GO溶液中加入捕获探针溶液时,由于捕获探针单链DNA碱基上的C-N杂环与Fe3O4/GO碳六环结构之间存在π-π堆积及静电引力作用而吸附在Fe3O4/GO表面,此时,标记在捕获探针一端的6′-FAM荧光素能与Fe3O4/GO之间发生非辐射能量转移生成复合物而导致荧光猝灭,如图1-(a)所示。然后通过磁分离收集磁性颗粒,移除原溶液,除去未反应的DNA,再加入沙门氏菌目标DNA溶液,沙门氏菌目标DNA与捕获探针的一段DNA进行杂交形成部分双链并脱离Fe3O4/GO表面,如图1-(b)所示。再次进行磁分离收集磁性颗粒,移除原溶液,除去未反应的DNA,并向磁性颗粒中加入释放探针溶液,根据碱基互补配对原则完成杂交形成完整的DNA双链并脱离Fe3O4/GO表面,荧光恢复,利用磁场分离Fe3O4/GO,通过检测上清液荧光强度的变化即可实现对沙门氏菌的快速检测,如图1-(c)所示。

图1 基于荧光标记DNA-磁性氧化石墨烯磁分离技术检测 沙门氏菌DNA的示意图
Fig.1 Schematic diagram of rapid detection ofSalmonellatarget DNA based on fluorescently labeled DNA-magnetic graphene oxide magnetic separation technology
2.2 沙门氏菌目标DNA检测条件的优化
2.2.1 Fe3O4/GO质量浓度的优化
由图2可知,在未加入Fe3O4/GO之前,沙门氏菌捕获探针在495 nm激发波长下,其荧光发射峰在517 nm处,当沙门氏菌捕获探针浓度为50 nmol/L时,扣除Fe3O4/GO的背景吸收后,其荧光强度 ΔF=944.92(ΔF=F-FT,其中F为加入沙门氏菌捕获探针时的荧光强度,FT为未加入沙门氏菌捕获探针时的荧光强度),固定沙门氏菌捕获探针浓度不变,当向其溶液中加入不同质量浓度的Fe3O4/GO后,沙门氏菌捕获探针的荧光被猝灭,且随着Fe3O4/GO质量浓度的增加,其荧光强度逐渐减小,荧光猝灭率逐渐增大,当Fe3O4/GO浓度为3.2×10-4g/mL时,荧光猝灭率可达96.86%,表明Fe3O4/GO对沙门氏菌捕获探针有强烈的荧光猝灭作用。
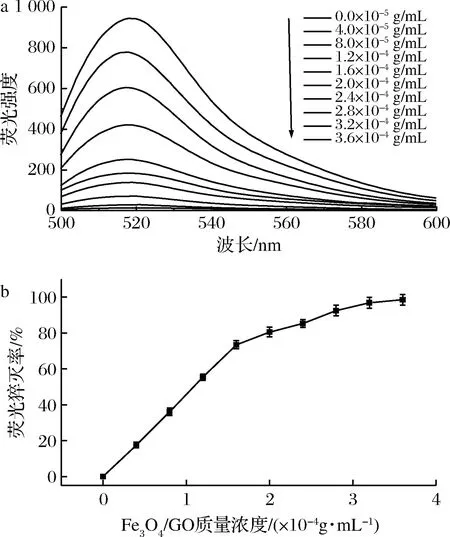
a-不同质量浓度Fe3O4/GO的荧光猝灭光谱图; b-不同质量浓度Fe3O4/GO的荧光猝灭率图
图2 不同质量浓度Fe3O4/GO的荧光猝灭光谱图 及荧光猝灭率图
Fig.2 Fluorescence quenching spectrum and fluorescence quenching rate of different mass concentrations of Fe3O4/GO
2.2.2 反应时间及温度对荧光猝灭作用的影响
由图3-a可知,反应时间在0~21 min时,其荧光强度迅速减小,荧光猝灭强度迅速增加,反应时间在60~100 min时,荧光强度几乎不变,因此Fe3O4/GO与沙门氏菌捕获探针最佳反应时间为60 min。
图3-b为反应温度对荧光猝灭作用的影响图,随着反应温度的增加,其荧光强度先减小后增加,即荧光猝灭强度先增大后减小,当反应温度为37 ℃时,荧光猝灭强度最大,反应温度为43 ℃时,荧光猝灭强度最小,说明反应温度的升高,不利于Fe3O4/GO与沙门氏菌捕获探针形成复合物,因此,Fe3O4/GO与沙门氏菌捕获探针最佳反应温度为37 ℃。
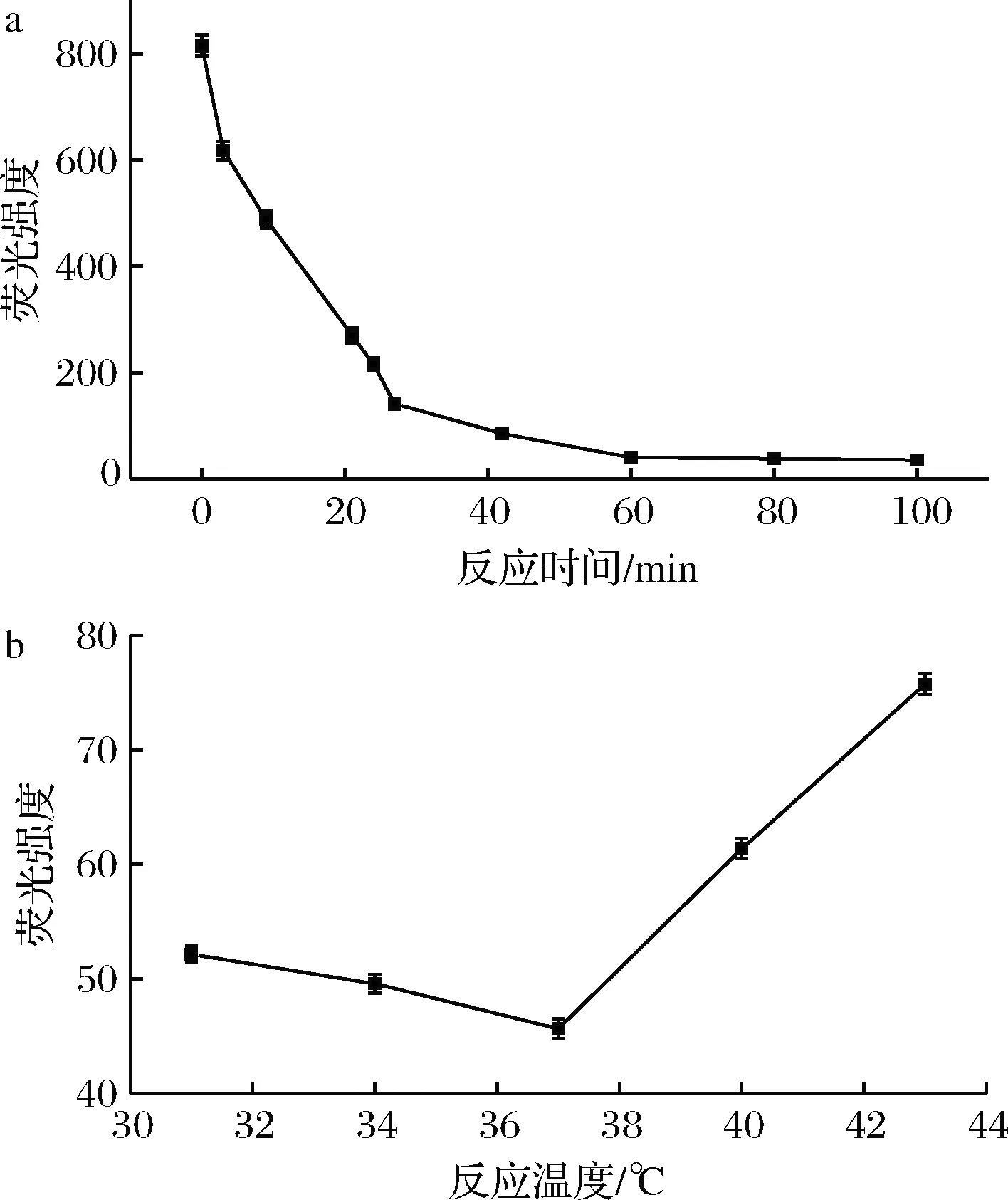
a-反应时间;b-反应温度
图3 反应时间及温度对荧光猝灭作用的影响
Fig.3 Effect of reaction time and temperature on fluorescence quenching
2.2.3 杂交时间的优化
杂交时间决定着DNA分子之间是否完全杂交,是影响杂交反应的因素之一[20]。本实验将1 pmol/L 沙门氏菌目标DNA与Fe3O4/GO捕获探针复合物在42 ℃条件下进行杂交,分别考察杂交时间30、60、90、120、150 min对荧光强度的影响。实验结果如图4所示,在30~120 min,荧光强度随反应时间的增加而增加,当反应时间>120 min时,荧光强度几乎不变,空白对照组中的荧光强度随反应时间的增加保持相对恒定,则最佳杂交时间为120 min。
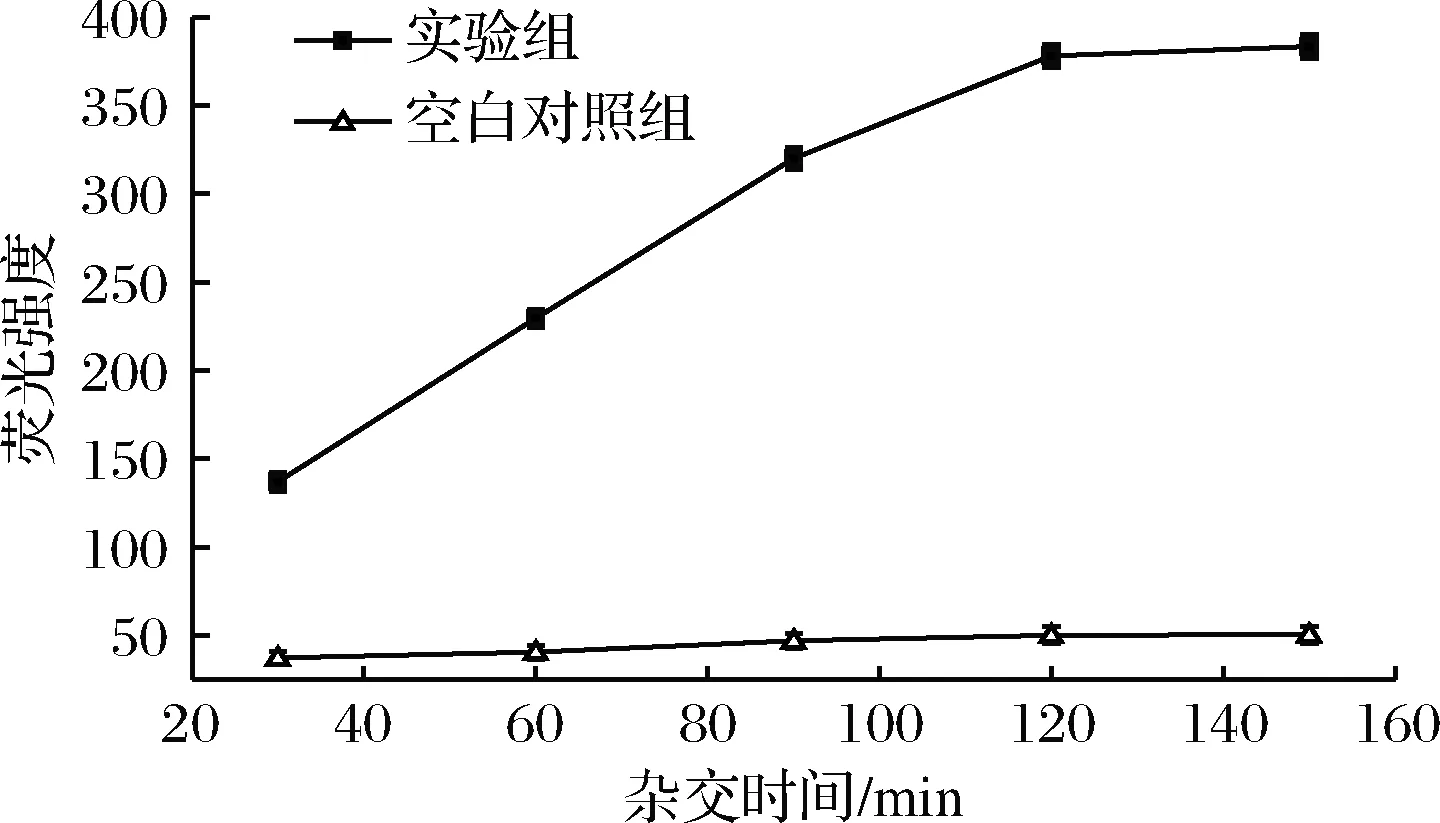
图4 杂交时间对荧光强度的影响
Fig.4 Effect of hybridization time on fluorescence intensity
2.2.4 富集倍数的优化
若待测目标物DNA含量过低,则很难对其进行检测,为保证Fe3O4/GO能将待测目标物DNA捕获并富集,通过对待测目标物DNA进行富集处理,可使荧光信号强度放大,进而提高检测灵敏度[20],故对富集倍数进行了优化。实验测定了富集1、3、5、7和9倍5组不同富集倍数下的荧光强度。图5为富集倍数随荧光强度及相对荧光强度变化的折线图。由图5-a可知,实验组和空白对照组的荧光强度均随富集倍数的增加而增加,而空白对照组的荧光强度增加较缓慢,其原因可能是待测液体积随富集倍数的增加而减少,导致背景荧光物质的浓度增加,所检测的空白对照组中的荧光强度也随之增加[20]。由图5-b可知,相对荧光强度F/F0(F为实验组荧光强度,F0为空白对照组荧光强度)随富集倍数的增加先增大后逐渐减小,富集5倍时的相对荧光强度F/F0最大。因此,Fe3O4/GO对待测目标物DNA的最优富集倍数为5倍。
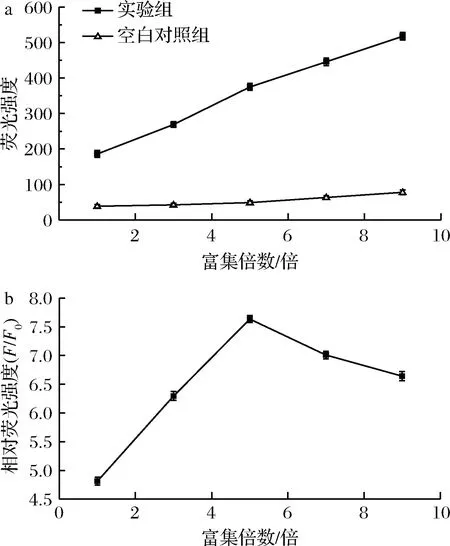
a-荧光强度随富集倍数的变化; b-相对荧光强度随富集倍数的变化
图5 荧光强度及相对荧光强度随富集倍数的变化
Fig.5 Fluorescence intensity and relative fluorescence intensity as a function of enrichment factor
2.2.5 沙门氏菌目标DNA的检测分析
在最优实验条件下,分别检测了不同浓度下的沙门氏菌目标DNA的荧光强度,图6-a为不同浓度沙门氏菌目标DNA的荧光光谱图,荧光强度随沙门氏菌目标DNA浓度的增加而增加;由图6-b可知,荧光强度与沙门氏菌目标DNA浓度在0.005~1 pmol/L呈良好的线性关系,线性回归方程y=7.065 9x+2.614 7,R2=0.998 1(x为沙门氏菌目标DNA浓度,y为相对荧光强度F/F0),检出下限为5 fmol/L(S/N=3)[23]。11次重复0.01 pmol/L沙门氏菌目标DNA浓度来评价该方法的精密度,其相对标准偏差为2.78%,说明所建立的检测方法具有较高的灵敏度和精密度。

a-不同浓度目标DNA的荧光光谱图;b-目标DNA浓度与 荧光强度的线性关系图
图6 不同浓度目标DNA的荧光光谱图和目标DNA 浓度与荧光强度的线性关系图
Fig.6 Fluorescence spectrum of target DNA at different concentrations and linear relationship between target DNA concentration and fluorescence intensity
2.3 鸡肉样品的检测及样本分析
2.3.1 鸡肉样品的检测
取购自超市的新鲜鸡胸肉,按照1.3.6中的方法进行预处理,以提取的沙门氏菌DNA为目标DNA,利用所建立的方法对其进行检测,将荧光分光光度计所测的荧光强度与沙门氏菌菌落总数进行统计分析处理,结果如图7所示,沙门氏菌菌落总数在102~106CFU/mL时,菌落总数对数与相对荧光强度具有良好的相关性,回归方程为y=0.700 4x+1.358 4,R2= 0.999 3(x为沙门氏菌总数对数,y为相对荧光强度F/F0),检出限为102CFU/mL(S/N=3)[23]。
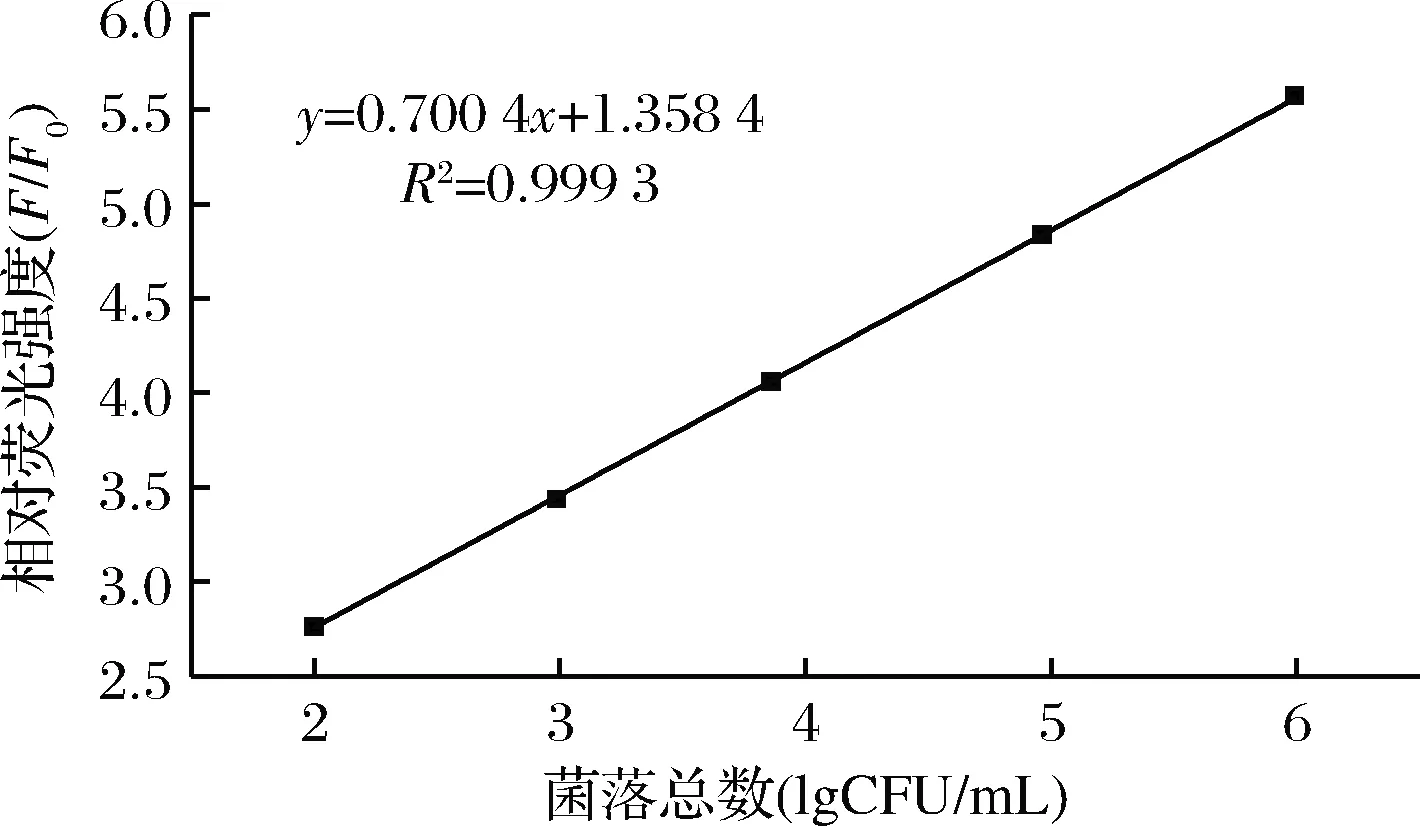
图7 相对荧光强度与菌落总数对数的线性关系
Fig.7 Linear relationship between relative fluorescence intensity and the total number of colonies
2.3.2 鸡肉样本分析
为了考察所建立检测方法的准确性和可靠性,分别将PBS溶液稀释的标准菌液加入到鸡肉样本中并进行预处理,用细菌基因组DNA提取试剂盒分别提取不同鸡肉样本中沙门氏菌的DNA,在沙门氏菌目标DNA最优检测条件下,对其进行荧光测定,将相对荧光强度F/F0带入2.3.1中的回归方程即可计算出其检测值,以实际检测沙门氏菌的数量与添加沙门氏菌数量的比值计算加标回收率。结果如表2所示,该方法在鸡肉样品中的加标回收率为96.8%~105.6%,RSD<4.52%,在不添加沙门氏菌标准菌液的鸡肉样本中未检测到沙门氏菌。结果表明该方法检测结果准确可靠,可用于实际鸡肉样本中沙门氏菌的检测。
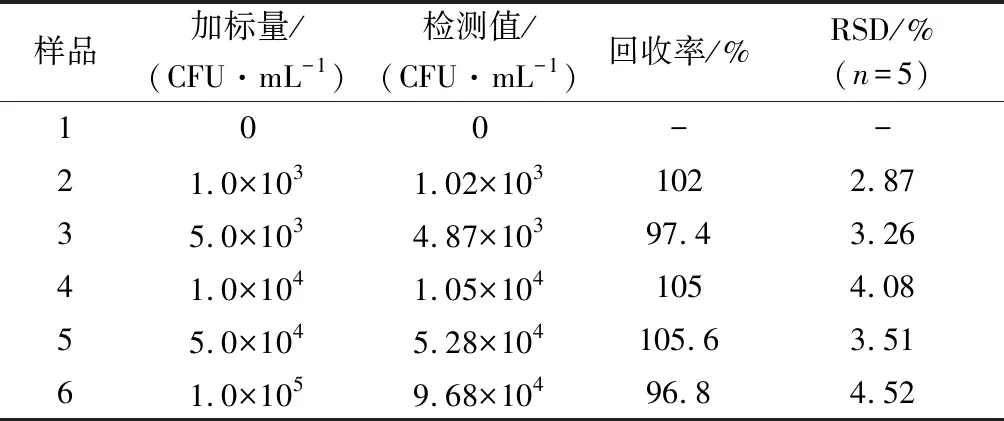
表2 鸡肉样本的回收率测定结果Table 2 Results of determination of recovery rate of chicken samples
注:-表示无
2.4 特异性检测
为了验证检测方法的特异性,用DNA提取试剂盒分别提取沙门氏菌、大肠杆菌、金黄色葡萄球菌的DNA,在相同条件下,分别对其进行荧光测定,并扣除其背景吸收,结果如图8所示,沙门氏菌DNA具有较强的荧光强度,大肠杆菌的荧光强度与金黄色葡萄球菌的荧光强度相接近,且明显低于沙门氏菌DNA的荧光强度,结果表明所建立检测沙门氏菌的方法特异性好且具有良好的选择性[15]。

图8 本方法对沙门氏菌检测的特异型分析
Fig.8 Analysis of the specificity of this method forSalmonelladetection
2.5 本方法与其他检测方法的比较
为了研究所建立检测沙门氏菌方法的优越性,将该方法与文献中其他检测沙门氏菌的方法进行了对比,对比结果如表3所示,该检测方法具有较低的检出限和较短的检测时间,检出限决定了检测方法的精密程度,因此,该方法能实现对沙门氏菌的快速检测。
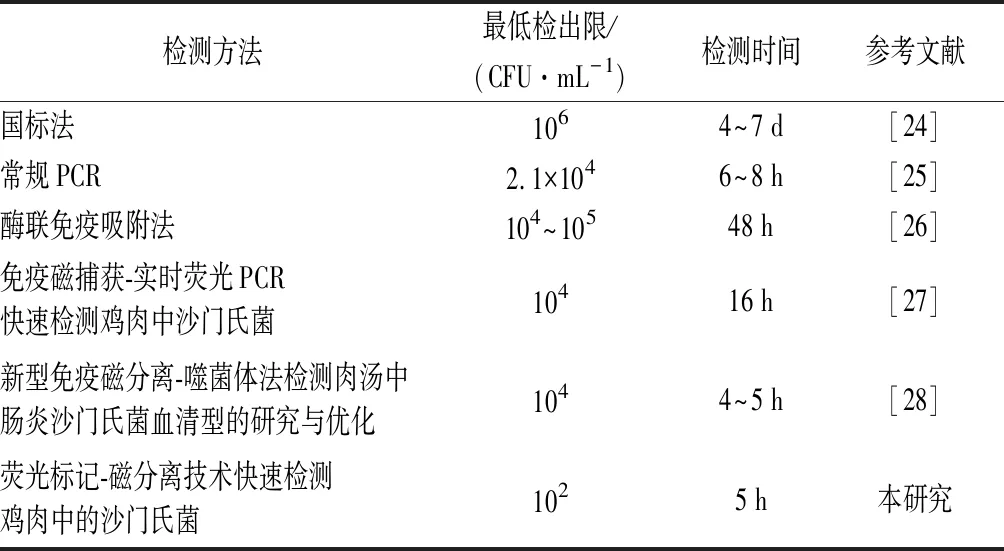
表3 本方法与其他文献报道的检测沙门氏菌方法的比较Table 3 Comparison of this method with other methods for detecting Salmonella
3 结论
本研究利用Fe3O4/GO能将带有荧光标记的单链捕获探针吸附在其表面并使其荧光猝灭,基于杂交互补反应,捕获探针分别与先后加入体系的沙门氏菌目标DNA和释放探针完成杂交,并从Fe3O4/GO表面释放出来,荧光恢复,利用磁场分离Fe3O4/GO,通过检测上清液荧光强度即可实现对沙门氏菌DNA的高灵敏检测。所建立的荧光标记DNA-磁性氧化石墨烯磁分离技术快速检测鸡肉中沙门氏菌的方法与其他检测方法相比,该方法具有较低的检出限和较短的检测时间,能够实现沙门氏菌的快速、高灵敏度和特异性检测,对其他致病菌的检测具有指导意义。
