小黄姜多糖的分离纯化及其结构特征及抗氧化活性研究
2020-07-06宋丽丽闻格霍姗浩胡晓龙彭惠
宋丽丽,闻格,霍姗浩,胡晓龙,3,彭惠
1(郑州轻工业大学 食品与生物工程学院,河南 郑州,450001)2(河南省人民医院,河南 郑州,450003) 3(河南仰韶酒业有限公司博士后创新实践基地,河南 三门峡,472000)
多糖是构成生命活动的基本物质之一,广泛存在于动物、植物及微生物细胞中,是一类由单糖通过α或β糖苷键连接而成的天然高分子多聚物[1]。天然多糖除了有免疫调节、抗肿瘤的生物学效应外,还有抗衰老、抗疲劳、抗氧化、降血糖、抗凝血等作用,且其对机体毒副作用小[2],在医药、发酵工业、食品工业等领域受到广泛关注。
生姜,是我国传统的香辛类蔬菜,作为卫生部首批公布的药食兼用植物资源,含有多种功能活性成分。生姜具有较好杀菌解毒、止吐、降血脂、抗炎、抗氧化、抑制肿瘤、保肝等保健功能,但其作用机理及对更多人类疾病的辅助治疗作用都还有待深入研究[3]。目前市场上对生姜的深入开发利用较少,开发具有自主知识产权的高附加值姜类产品将带来更大的社会效益和经济效益。生姜药用以小种姜为好,小种姜又名小黄姜。小黄姜中的化学成分达两百余种,其中含有多种对人体健康有益的成分,包括姜黄素、姜辣素、微量元素、姜糖蛋白和姜多糖等[4-6]。姜中含有的活性多糖是一种优质的功效成分资源。与普通生姜相比,云南小黄姜个头小、肉质紧实,姜辣素和姜精油含量更高,因此有“御姜”、“药姜”和“月子姜”的美誉,具有潜在的药用价值[7]。目前对小黄姜多糖的研究仅限于提取工艺的优化,而对多糖结构和生理功能的解析较少[8]。
本研究以云南小黄姜作为原料,以复合酶解结合水提醇沉法提取小黄姜多糖,研究其理化性质及结构特征,进一步考察其体外抗氧化活性,为小黄姜多糖活性成分的深入研究及药用功能的发挥奠定研究基础,为小黄姜资源的深入开发利用提供方向。
1 材料与方法
1.1 材料与试剂
(1)实验材料:新鲜小黄姜购于云南当地菜市场,烘干,粉碎,待用。
(2)实验试剂:DEAE 纤维素-52,美国Whatman公司;Sephadex G-100,美国Pharmacia公司;KBr(光谱纯)、单糖标准品、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、纤维素酶、1,1-二苯基-2-三硝基苯肼(DPPH)、刚果红,美国Sigma-Aldrich公司;木瓜蛋白酶、NaCl、正丁醇、氯仿、苯酚、三氟乙酸、邻苯三酚、邻二氮菲、无水乙醇、FeSO4和H2O2等,天津市富宇精细化工有限公司。
1.2 仪器与设备
FW 100高速万能粉碎机,天津市泰斯特仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;电热恒温水浴锅、电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;ME204/02电子天平,上海舜宇恒平科学仪器有限公司;DHL-B电脑恒流泵、DBS-100电脑全自动部分收集仪,上海青浦沪西仪器厂;LPS-1280B真空冷冻干燥机,无锡莱浦仪器设备有限公司;UV-1800紫外可见分光光度计,上海美谱达仪器有限公司;Vertex 70v傅里叶变换红外光谱仪,德国布鲁克仪器公司;高效液相色谱仪1260,美国安捷伦公司;Diamond TG/DTA综合热分析仪,美国Perkin Elmer公司;DAWNHELEOS Ⅱ 多角度激光散射凝胶色谱系统,美国怀雅特公司。
1.3 实验方法
1.3.1 小黄姜多糖的提取和精制
1.3.1.1 小黄姜粗多糖的提取
称取50 g小黄姜粉,加入1 L蒸馏水(固液比为1∶20),浸泡过夜后加入5 g/L纤维素酶,50 ℃水浴搅拌反应3.5 h,再加入0.5 g/L木瓜蛋白酶反应45 min后,转移到90 ℃的水浴中保温搅拌4 h。过滤,滤液减压浓缩至1/5体积,加等体积的Sevage试剂[V(正丁醇)∶V(氯仿)=4∶1],混合液离心15 min,保留上清液。将四倍量的乙醇缓慢加入并不断搅拌,离心收集沉淀。少量蒸馏水溶解多糖沉淀物,将多糖溶液转移至透析袋中流动水透析24 h,真空冷冻干燥得到小黄姜粗多糖样品。
1.3.1.2 小黄姜多糖的纯化
称取100 mg小黄姜粗多糖样品溶于20 mL去离子水中,用0.22 μm孔径的滤膜过滤后,加入已平衡好的DEAE纤维素-52色谱柱中。用0、0.01、0.02、0.03、0.04 mol/L的NaCl溶液依次进行梯度洗脱,每梯度收集20管,每管5 mL,苯酚-硫酸法检测波长490 nm的吸光度,绘制洗脱曲线,收集同一组分多糖,旋转蒸发浓缩后用透析袋透析并冷冻干燥。
将DEAE纤维素-52柱层析收集的冻干组分配置成5 mg/mL的多糖溶液,通过Sephadex G-100柱层析。调整恒流泵使洗脱液流速为0.5 mL/min,每管5 mL收集。用苯酚硫酸法于490 nm处检测多糖含量,以管数为横坐标,吸光度值为纵坐标,绘制多糖纯化曲线。收集主峰洗脱液,旋转蒸发浓缩后用透析袋透析并冷冻干燥,得到精制小黄姜多糖。
1.3.1.3 小黄姜多糖含量和提取率的测定
多糖含量及提取率测定:多糖含量即多糖的质量分数(%)采用苯酚‐硫酸法测定[9]。多糖提取率(得率)的计算如公式(1):

(1)
1.3.2 单糖的组分成分分析[10]
样品前处理:称取20 mg小黄姜多糖,加入15 mL 2 mol/L的三氟乙酸置于耐高温的试管中,121 ℃油浴4 h,反应结束后用旋转蒸发仪蒸干,加入4 mL甲醇复溶再蒸干,重复2次。样品用2 mL去离子水充分溶解,0.22 μm滤膜过滤,HPLC检测。
制作标样:分别配制1 mg/mL的木糖、葡萄糖、阿拉伯糖、甘露糖、葡萄糖醛酸、鼠李糖溶液,0.22 μm滤膜过滤,HPLC检测。
HPLC条件:Aminex HPX-87H色谱柱(Biorad),流动相为50 mmol/L H2SO4溶液,流速0.6 mL/min,采用示差折光检测器,柱温80 ℃,检测器35 ℃,进样量10 μL。
1.3.3 红外光谱分析
称取1~2 mg多糖样品和200 mg KBr充分研磨,压制成均匀透明的圆形薄片。采用VERTEX 70v 红外光谱仪进行测定,设置分辨率4 cm-1,扫描范围为400~4 000 cm-1。
1.3.4 刚果红实验[11]
配制不同浓度(0、0.1、0.2、0.3、0.4、0.6、0.8 mol/L)的NaOH溶液。取2 mg/mL多糖溶液1.0 mL,加入3.0 mL上述各浓度的NaOH溶液,并加入0.5 mL蒸馏水和1.5 mL 0.2 mmol/L刚果红溶液,充分混匀,静置1 h后对反应液进行200~800 nm全波长扫描,记录各NaOH浓度时反应体系的最大吸收波长,空白对照组以蒸馏水替代多糖溶液。
1.3.5 小黄姜多糖分子质量的测定
利用尺寸排阻色谱、多角度激光光散射检测器及示差折光检测器联用技术测定小黄姜多糖的绝对分子质量及分子构象。将小黄姜多糖配制成质量浓度为1 mg/mL多糖样品溶液,0.22 μm滤膜过滤。分析条件:流动相为50 mmol/L NaNO3和3 mmol/L NaN3溶液,流速0.5 mL/min,进样量100 μL,样品的比折光指数增量值设置为0.14[12]。数据的采集和计算使用ASTRA软件。
1.3.6 多糖的热稳定分析
用热重分析法(thermogravimetric,TG)对小黄姜多糖进行热稳定性分析。用N2作载气,从室温升至500 ℃,升温速率为10 ℃/min。
1.3.7 多糖的抗氧化活性分析
1.3.7.1 羟自由基清除率的测定
参考李顺峰等[13]的方法并进行了调整。取不同浓度的多糖溶液、8.9 mmol/L FeSO4和8.9 mmol/L水杨酸-乙醇溶液各1 mL,混合均匀,再加入1 mL 8.7 mmol/L的H2O2溶液启动反应,35 ℃水浴保温35 min,在波长510 nm测吸光度。样品对照管为蒸馏水替代样品,样品本底管以蒸馏水代替H2O2,按公式(2)计算多糖溶液对羟自由基清除率:
(2)
式中:Ax为样品吸光度;A0为空白管吸光度;Ax0为样品本底吸光度。
1.3.7.2 超氧阴离子基清除率的测定
采用邻苯三酚自氧化法测定[14]。取50 mmol/L Tris-Hcl缓冲溶液(pH=8.2)4.5 mL,分别加1 mL不同浓度的多糖样品溶液,加入0.2 mL 5 mmol/L 邻苯三酚溶液于试管中混合,于325 nm处每隔30 s测量吸光度,共记录300 s,空白对照以同体积蒸馏水代替多糖样品。多糖对超氧阴离子自由基清除率计算如公式(3):
(3)
式中:ΔA0为邻苯三酚自氧化速率,ΔAx为加入多糖溶液后的邻苯三酚氧化速率。
1.3.7.3 ABTS自由基清除率的测定[15]
ABTS+工作液:于200 mL蒸馏水中加0.385 g ABTS和0.135 g K2S2O4并混匀,于避光处静置15 h后,用95%的乙醇将ABTS溶液稀释至734 nm下吸光度为0.70±0.01。
取4 mL ABTS+工作液和1 mL多糖样品溶液混合均匀,避光反应16 min,在734 nm下测吸光度;样品本底对照为95%的乙醇替换ABTS+工作液;空白对照用95%乙醇替换样品溶液。多糖对ABTS自由基清除率计算如公式(4):
(4)
式中:A为多糖反应管吸光度;A0为本底对照吸光度;Ax为空白对照吸光度。
1.3.7.4 DPPH自由基清除率的测定[16]
DPPH工作液的配制:准确称取9.86 mg DPPH固体粉末,溶于100 mL无水乙醇中,4 ℃避光保存。
取不同浓度的多糖溶液1 mL于试管中,加入1 mL DPPH工作液,混合均匀后,避光反应30 min,在517 nm波长下分别测其吸光度;空白对照为用无水乙醇代替样品代替样品溶液,样品对照用无水乙醇代替DPPH溶液,小黄姜多糖对DPPH自由基清除率计算如公式(5):
(5)
式中:A为多糖反应管吸光度;A0为本底对照吸光度;Ax为空白对照吸光度。
1.4 实验数据处理
实验数据重复3次取平均值,采用Excel 2010软件进行数据处理、Origin Pro 2017软件作图。
2 结果与分析
2.1 小黄姜粗多糖柱纯化结果
小黄姜粗多糖经DEAE纤维素-52柱层析洗脱纯化时有3个峰,即3个组分,如图1-a所示。组分1和2含量较低,鉴于其含量的多少,以组分3作为主要研究对象。将得率较高的0.2 mol/L NaCl洗脱组分进一步经Sephadex G-100柱层析纯化,得到均一组分(图1-b),经透析、冷冻干燥得到精制小黄姜多糖。

a-DEAE-52纤维素柱层析;b-Sephadex G-100柱层析
图1 小黄姜多糖柱洗脱曲线
Fig.1 Elution profile ofZingiberofficinalepolysaccharide
2.2 小黄姜多糖的基本性质
经纯化后得到的小黄姜多糖,易溶于热水,不溶于高浓度乙醇、丙酮等有机试剂。苯酚-硫酸法测定总糖含量为(90.0±6.2)%,提取效率为(2.83±0.19),ZHANG等[17]研究姜多糖的提取率为(2.50±4.32)%,与本研究中小黄姜多糖的提取率较为接近。如图2所示,经Sevage法除蛋白后,紫外扫峰在260 nm和280 nm处均无吸收峰,说明多糖中基本不含有核酸和蛋白质。经酸水解、高效液相色谱分析其单糖成分,小黄姜多糖由葡萄糖、甘露糖和阿拉伯糖组成,其含量百分比分别为(81.7±2.1)%、(12.3±1.3)%和(6.0±0.2)%。
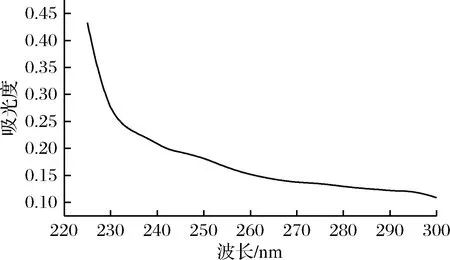
图2 小黄姜多糖紫外扫描图谱
Fig.2 UV spectrum ofZingiberofficinalepolysaccharide
2.3 小黄姜多糖红外光谱分析
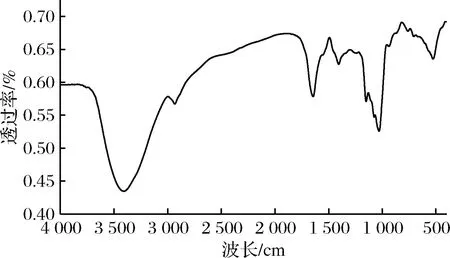
图3 小黄姜多糖红外光谱图
Fig.3 FT-IR spectrum ofZingiberofficinalepolysaccharide
2.4 小黄姜多糖空间构象分析
刚果红能和具有三股螺旋结构的多糖发生络合反应,形成的络合物的最大吸收波长会与刚果红相比发生红移[24]。由图4可知,水对照组的最大吸收波长,随NaOH浓度增大而降低。而含有多糖溶液实验组的最大吸收波长,在稀碱浓度范围内产生的明显的红移现象。说明小黄姜多糖与刚果红形成了络合物,具有3股螺旋结构。在碱的作用下,小黄姜多糖的3股螺旋结构开始发生构象转变,形成单股螺旋,因此与刚果红复合物的λmax发生了红移[25],并随NaOH浓度的提高而红移增加,在NaOH浓度为0.4 mL时趋于稳定,增加NaOH浓度,最大吸收波下降,说明随着NaOH浓度的增加,多糖的3股螺旋结构被破坏,形成自由弯曲结构。

图4 小黄姜多糖与刚果红复合物在不同浓度NaOH 溶液中的λmax变化
Fig.4 Changes in the absorption maximum(λmax) ofZingiberofficinalepolysaccharide vatious concentrations of sodilum hydrolysis complexed with Congo red
2.5 小黄姜多糖分子质量测定
采用1.3.5方法,测量小黄姜多糖的重均分子质量(Mw)、均方根旋转半径(Rn)和多分散系数(Mw/Mn)。结果如表1所示,小黄姜多糖的重均分子质量为(3.72±0.23)×105Da,均方根旋转半径为(40.0±1.4) nm。多分散系数为1.50,表明多糖的分子质量分布较窄,分子结构较为均一。通过软件ASTRA 6.1模拟均方根半径与分子量的双对数曲线的斜率,可以判断水溶液中多糖分子的构象,一般v值为0.33、0.50~0.60或1.0时分别代表聚合物分子构象为球形、柔顺线团状或刚性杆状[26-27]。计算可得,小黄姜多糖的双对数曲线斜率为0.31,约为1/3,可知其在水溶液中均以球形构象存在,是一种高度紧密且具有分支结构的多糖聚合体。
2.6 小黄姜多糖热稳定性分析
多糖的热反应性质与其组成、含水量以及聚集态结构有关[28]。由TG-DTG曲线求TG-DTG可得DTG(derivative thermogtavimetric)曲线,根据导反应曲线及表2可知,小黄姜多糖热解反应在50~140 ℃为第一阶段,这一阶段的质量损失主要是多糖失去了物理吸附的水分。140~220 ℃为第二反应阶段,这一阶段主要是发生的是多糖中的小分子挥发性热解反应,在220~500 ℃为第三阶段,这一阶段的质量损失主要是多糖分子发生剧烈的热分解,多糖降解成单糖并伴随着C—O键和C—C键的断裂,随后单糖进一步分解成水蒸气和CO2。这个过程最大热分解温度为307.5 ℃,最大热解速率为0.53%/℃,最后多糖的残留质量为33.89%。分析可知,多糖样品虽然经过冷冻干燥,但仍有一定的水分,这表明多糖会吸附部分水分,这与鸡骨草多糖的TG曲线相似[29]。相较于大粒车前子多糖和苦丁茶冬青叶多糖的最大热分解温度分别为281.7 ℃和290 ℃[30-31],小黄姜多糖最大热分解温度为307.5 ℃,具有较好的热稳定性。

表1 小黄姜多糖分子质量参数Table 1 The molecular weight parameters of Zingiber officinale polysaccharide
注:Mn、Mw和Mz分别指数均分子质量、重均分子质量和平均分子质量;Mw/Mn指多分散系数;Rn、Rw和Rz分别指数学均方旋转半径、重量均方旋转半径和均方旋转半径的均值;v为均方根半径对分子质量的双对数曲线的斜率
2.7 小黄姜多糖抗氧化活性分析
2.7.1 羟自由基清除率
羟自由基普遍存在在生物体内,是由机体新陈代谢产生的一类活性氧自由基,导致机体衰老与氧化损伤[32]。小黄姜多糖对羟自由基的清除率存在明显浓度依赖性,由图6-a可知,在0.1~5 mg/mL时小黄姜多糖对羟自由基有一定的清除作用,且清除效率随浓度的增大而提高。当多糖质量浓度为5 mg/mL时,羟自由基清除率为(65±2)%,但低于VC的羟自由基清除率效果。李顺峰等[13]对真姬菇多糖研究表明,在质量浓度为10 mg/mL时对羟自由基的清除率为62%,说明小黄姜多糖在较低浓度下即可达到与食用菌多糖同等的羟自由基清除效果。
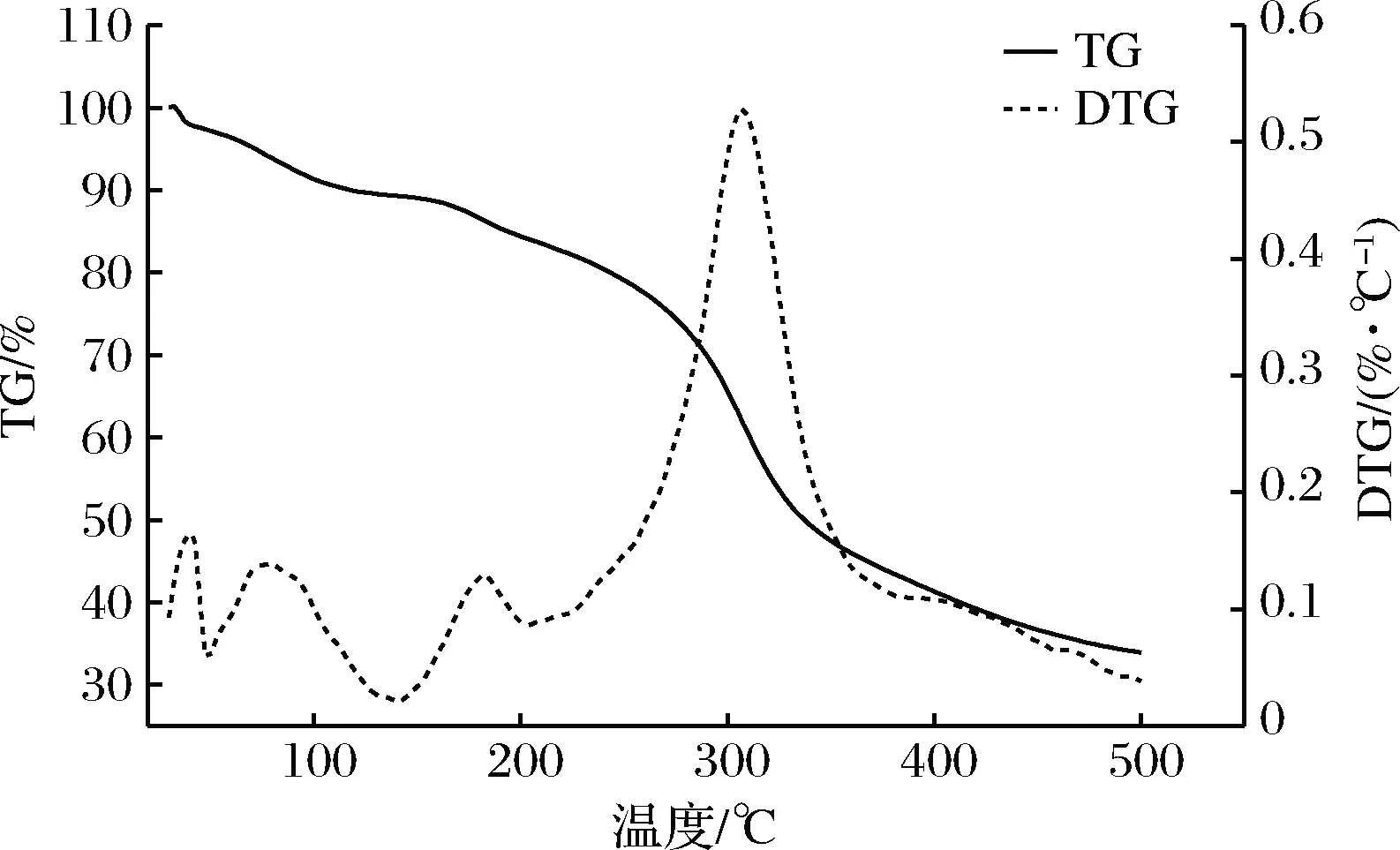
图5 小黄姜多糖的TG-DTG图
Fig.5 TG/DTG curve ofZingiberofficinalepolysaccharide
表2 小黄姜多糖不同阶段热反应参数
Table 2 The thermogravimetric parameters ofZingiberofficinalepolysaccharide during different reaction stages
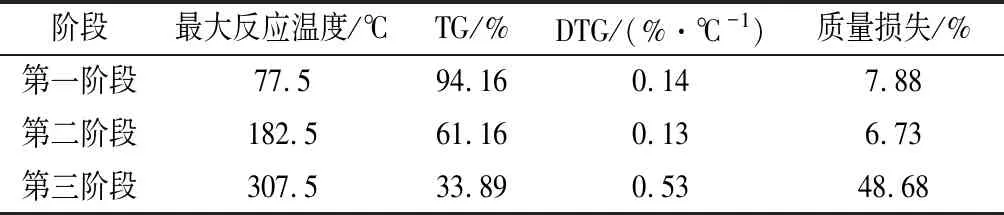
阶段最大反应温度/℃TG/%DTG/(%·℃-1)质量损失/%第一阶段77.594.160.147.88第二阶段182.561.160.136.73第三阶段307.533.890.5348.68
2.7.2 超氧阴离子自由基清除率
由图6-b可以看出小黄姜多糖对超氧阴离子自由基清除率较低,在多糖质量浓度为5 mg/mL时,自由基清除率仅为(37±3)%,而许女等研究鸡腿菇多糖在质量浓度为8 mg/mL时对超氧阴离子自由基的清除率只有21%[33]。研究表明超氧阴离子自由基清除能力与其羟基数量有关,由于多糖的立体空间构型,使羟基被束缚在内部,不能与外周的超氧阴离子自由基反应,导致自由基清除率较低[34]。
2.7.3 ABTS自由基清除率
如图6-c所示,小黄姜多糖对ABTS自由基的清除率较强,当多糖质量浓度为1 mg/mL时,ABTS自由基清除率达到(96±4)%,与VC的效果相当。经线性拟合计算多糖半抑制浓度IC50为0.30 mg/mL,优于牛肝菌多糖的抗氧化效果[35]。
2.7.4 DPPH自由基清除率
小黄姜对DPPH自由基清除能力如图6-d所示,可以看出小黄姜多糖对 DPPH自由基的清除能力随样品浓度的提高而明显提高,当多糖质量浓度为2 mg/mL时,自由基清除率达(83±3)%,继续增加多糖浓度,则自由基清除能力趋于平缓,经计算其IC50为0.57 mg/mL,ZHANG等[17]的研究表明生姜多糖对DPPH自由基的IC50为0.34~0.87 mg/mL,与本研究结果一致。
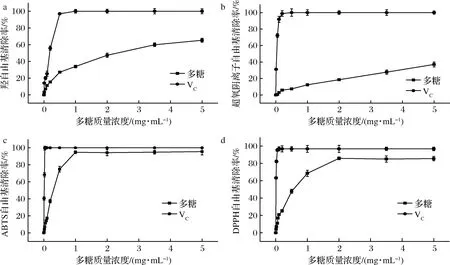
a-羟自由基清除率;b-超氧阴离子自由基清除率;c-ABTS自由基清除率;d-DPPH自由基清除率
图6 小黄姜多糖抗氧化活性
Fig.6 Antioxidation activity ofZingiberofficinalepolysaccharide
通过对比小黄姜多糖对4种自由基清除能力可知,小黄姜多糖具有一定的体外抗氧化活性,其中对ABTS自由基和DPPH自由基的清除能力较强。可能受其空间构型的影响,超氧阴离子自由基清除能力较弱,研究发现含有β-构型比α-构型的多糖抗氧化能力更强,具有抗氧化活性的多糖大多数都具有β-(1→3)-D-葡聚糖的主链结构[24,27],本研究中小黄姜多糖为β-吡喃糖构型,且具有3股螺旋结构,具有较高的体外抗氧化活性。
3 结论
本研究以小黄姜为原料,采用复合酶解结合水提醇沉法提取多糖组分,小黄姜多糖中总糖含量为(90.0±6.2)%,主要由葡萄糖、甘露糖和阿拉伯糖组成,含量百分比分别为(81.7±2.1)%、(12.3±1.3)%和(6.0±0.2)%。结构分析表明小黄姜多糖为β-吡喃型多糖,具有三股螺旋结构;多糖的重均分子质量为(3.72±0.23)×105Da,水溶液中多糖分子的构象为高度紧密的球形聚合体;小黄姜多糖具有较高的热稳定性,最大热分解温度为307.5 ℃,最大热解速率为0.53%/℃;体外抗氧化活性表明小黄姜多糖对ABTS和DPPH自由基具有较强的清除能力,最大清除率分别为(96±4)%和(83±3)%,IC50分别为0.30 mg/mL和 0.57 mg/mL,具有较高的体外抗氧化活力。本研究为小黄姜多糖资源的深度开发利用提供了理论基础。
