不动杆菌来源L-天冬氨酸-β-脱羧酶的表达与酶学性质分析
2020-07-06于佳印赵庭刘中美周丽周哲敏
于佳印,赵庭,刘中美,周丽,周哲敏
(江南大学 生物工程学院,江苏 无锡,214122)
L-天冬氨酸-β-脱羧酶(L-aspartate-β-decarboxylase, EC 4.1.1.12 Asd)又称L-天冬氨酸-4-脱羧酶,以5′-磷酸吡哆醛(pyridoxal5-phosphatemonohydrate,PLP)为辅酶因子[1-2],是目前为止自然界中发现的唯一的氨基酸-β-脱羧酶,可以催化底物L-天冬氨酸脱去β位羧基生成L-丙氨酸和CO2,α-酮戊二酸对其脱羧反应具有激活作用[3]。同时,L-天冬氨酸-β-脱羧酶是一个多功能酶,具有较低的转氨活性以及β-消除活性[4]。L-天冬氨酸-β-脱羧酶一般以同型十二聚体形式存在,单亚基分子质量均为60 kDa左右[5]。已有研究报道,L-天冬氨酸-β-脱羧酶存在于哺乳动物细胞[6]以及多种微生物中,如假单胞菌[7]、粪产碱菌[8]、粪肠球菌[9]、放线菌[10]以及真菌[11],目前已用来生产L-丙氨酸和拆分DL-天冬氨酸生产D-天冬氨酸[12]。关于L-天冬氨酸-β-脱羧酶来源与性质的研究始于20世纪50年代,主要集中在20世纪70年代至21世纪初。
L-丙氨酸具有重要的生理功能,如参与糖代谢、在转氨反应中提供氨基,并且参与体内氨基酸循环、氨基酸与糖原转换等过程。同时,L-丙氨酸在日化、医药、食品等领域均有广泛用途[13]。在日化领域,L-丙氨酸是合成氨基酸表面活性剂的原料[14];在医药应用方面,L-丙氨酸是合成VB6和L-氨基丙醇[15](盐酸左氧氟沙星合成前体)的主要原料;同时,L-丙氨酸是复合氨基酸注射液和输液的主要成分,也是心肌功能增强剂。它可以用于配制组织培养基和生化试剂,也可用于肝功能检测。在食品领域,L-丙氨酸具有甜味和鲜味,能与谷氨酸钠制成混合调味品,可调制并明显改善食品风味,而不破坏食品原有的风格[16]。
目前,L-丙氨酸的制备方法主要包括化学合成法、蛋白质水解法、发酵生产法与酶转化法。酶促反应具有催化效率高、反应条件温和、立体选择性强、绿色环保节能减排等优点,已经被投入到了大规模的工业生产当中,是如今工业生产上应用最广泛的合成L-丙氨酸的工艺[17]。2000年,CHEN等[8]首次克隆了AlcaligenesfaecalisCCRC 11585来源的Asd酶,并在大肠杆菌中实现异源表达,在45 ℃、pH 5.0条件下该酶具有最高比酶活力215 U/mg。2006年,WANG等[7]克隆并异源表达了Pseudomonassp.来源的Asd酶,测得其最适反应温度为45 ℃,40 ℃保温40 min酶活力剩余为92%,最适反应pH值4.5,在pH 4.0~7.0有较好的稳定性,比酶活为280 U/mg;2015年,吴四平等[18]对Alcaligenesfaecalis来源Asd酶在大肠杆菌中进行重组表达,测得其最适反应温度为45 ℃,在35、40 ℃稳定性较好,保温3 h酶活力几乎没有损失;最适反应pH值为6.0,同时在pH 6.0条件下稳定性最好。2018年,汪芳[19]将Pseudomonasdacunhae中编码Asd酶的基因克隆至大肠杆菌中进行异源表达,针对该酶在低pH条件下酶活力降低的情况进行改造,获得稳定性提高的突变体N34D/L484M,比酶活力为116.27 U/mg,比野生型提高76.3%。本文在大肠杆菌中首次重组表达了不动杆菌来源的Asd酶,对其酶学性质进行了研究,扩充了Asd酶家族,同时也为生物转化生产L-丙氨酸的工业应用提供了参考。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
菌株E.coliBL21 (DE3)、E.coliJM109与质粒pMD 19-T、pET-28a(+),安徽通用生物系统有限公司;菌株Acinetobacterradioresistens,本实验室保藏。
1.1.2 试剂及培养基
L-天冬氨酸钠、L-丙氨酸、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、卡那霉素,上海生工生物工程有限公司;PrimeSTAR®Max DNA 聚合酶、限制性内切酶EcoRⅠ、XhoⅠ和T4 DNA连接酶,TaKaRa宝日医生物技术有限公司;细菌基因组DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒和PCR产物纯化试剂盒,Axygen产品;其他试剂均为国产分析纯。
E.coli的种子培养基为Luria-Bertani(LB)培养基,诱导蛋白表达培养基为Terrific-Broth(TB)培养基。
1.1.3 引物设计及合成
根据GenBank检索所得的不动杆菌(Acinetobacterradioresistens)的L-天冬氨酸-β-脱羧酶基因序列(GeneBank登录号为AP019740.1)设计引物,分别在引物5′和3′端加入EcoRⅠ、XhoⅠ酶切位点及保护碱基。引物序列如表1所示。

表1 本研究所用引物序列Table 1 Primers used in this study
注:下划线部分为限制性内切酶酶切位点
1.2 实验方法
1.2.1 不动杆菌Acinetobacterradioresistens基因组提取
Acinetobacterradioresistens基因组提取方法参考细菌基因组DNA提取试剂盒的使用说明。
1.2.2 基因工程菌E.coliBL21/pET28a(+)-ArAsd构建
以Acinetobacterradioresistens基因组为模板,以上述引物进行PCR扩增。将获得带有限制性酶切位点的目的基因ArAsd连接载体pMD19T,获得pMD19T-ArAsd。提取pMD19T-ArAsd用EcoRⅠ、XhoⅠ双酶切,经琼脂糖凝胶电泳鉴定、回收、纯化后,用T4 DNA连接酶连接到同样经过EcoRⅠ、XhoⅠ双酶切的pET-28a(+)载体上,获得重组质粒pET28a-ArAsd。将重组质粒转化到E.coliBL21 (DE3)感受态细胞中,选取含有卡那抗性平板上阳性转化子提取质粒酶切验证,得到重组菌E.coliBL21/pET28a(+)-ArAsd,并保存于甘油管中。
1.2.3 重组ArAsd蛋白诱导表达
将保存于甘油管中的重组菌划线于带有卡那抗性的LB平板上,于37 ℃培养12 h;在平板上挑取单菌落接种于5 mL含100 μg/L卡那霉素的LB培养基中,37 ℃、200 r/min培养8 h,以1%接种量转接至含有50 mL TB培养基的250 mL三角瓶中,培养基中加入终质量浓度为100 μg/L的卡那霉素,37 ℃、200 r/min摇床培养至菌体OD600为0.6~0.8,添加终质量浓度为0.2 mmol/L的IPTG,30 ℃诱导培养12 h。诱导结束后,6 000 r/min离心10 min收集菌体,超声破碎,通过聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析鉴定重组蛋白表达情况。
1.2.4 重组ArAsd蛋白纯化
用结合缓冲液A(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、10 mmol/L 咪唑、pH 7.4)悬浮诱导表达后的菌体,冰浴超声破碎(功率300 W,破碎3 s,间歇7 s,破碎30 min),12 000 r/min离心20 min,取上清,用0.22 μm滤膜过滤,即粗酶液。Sepharose His Trap HP用5倍柱体积结合缓冲液A平衡后,取10 mL上样,继续平衡洗去杂蛋白。使用洗脱缓冲液B(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L 咪唑、pH 7.4)梯度洗脱,收集的洗脱液即为纯化得到的纯酶液,用SDS-PAGE方法分析纯化情况,采用Bradford法测定纯化所得蛋白浓度。
1.2.5 Asd酶活力的测定方法
酶活力定义为在37 ℃,pH 4.5条件下,1 min转化底物生成1 μmolL-丙氨酸所需的酶量为一个酶活力单位U。
酶活力检测反应体系:1 mL反应体系中,将适量Asd酶液与磷酸缓冲液(50 mmol/L,pH 4.5)混合,并加入终浓度为0.5 mmol/L的PLP、终浓度为1 mmol/L的α-酮戊二酸,混匀后于37 ℃预热10 min,后加入终浓度为40 mmol/L的底物L-天冬氨酸钠激活反应,于37 ℃水浴反应20 min后,煮沸10 min灭活反应。
液相检测方法[20]:反应液于12 000 r/min离心10 min后,取上清通过0.22 μm滤膜过滤,随后采用异硫腈酸苯酯(phenyl isothiocyanate,PITC)衍生,具体步骤为:取500 μL反应液于2 mL离心管中,加入250 μL 1mol/L三乙胺乙腈溶液与250 μL 0.1 mol/L PITC乙腈溶液,充分均匀混合,于室温避光反应衍生45~60 min,加入750 mL正己烷溶液终止反应,涡旋振荡1 min后静置10 min待溶液分层,吸取下层溶液,经0.22 μm有机滤膜过滤。使用高效液相色谱法检测衍生后L-丙氨酸含量。
1.2.6 Asd酶学性质研究
最适反应温度测定:分别在35、40、45、50、55、60、65、70 ℃条件下测定Asd的酶活力,将最高酶活力定义为100%,检测结果以Asd相对酶活力对温度作图呈现。
最适反应pH测定:保持其他反应条件不变,反应体系中加入相同体积的pH值为3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0、9.0的缓冲液,于37 ℃条件下反应10 min后灭活,检测结果以Asd相对酶活力对pH作图呈现。pH值3.0~8.0采用磷酸氢二钠-柠檬酸缓冲溶液,pH值7.0~9.0采用Tris缓冲溶液。
热稳定性测定:取等量纯酶液置于0、40、45、50 ℃水浴锅中温育,每隔30 min取样,于冰上冷却5 min,保持其他反应条件不变,按照1.2.4所述方法检测酶活力,检测结果以不同温度下相对酶活力对处理时间作图呈现。
pH稳定性检测:取等量纯酶液用相同体积的pH值为3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、的缓冲溶液悬浮,于冰上放置12 h,保持其他反应条件不变,随后按照1.2.4所述方法检测酶活力,检测结果以不同pH下相对酶活力对处理时间作图呈现。
动力学常数测定:1 mL反应体系中,将适量Asd酶液与磷酸缓冲液(50 mmol/L,pH 4.5)混合,并加入终浓度为0.5 mmol/L的PLP、终浓度为1 mmol/L的α-酮戊二酸,混匀后于37 ℃预热10 min,后加入终浓度为5、10、15、20、30、40 mmol/L的底物L-天冬氨酸钠,于37 ℃水浴反应2 min后,煮沸10 min灭活反应。检测L-丙氨酸产量,测定初始反应速率。采用GraphPad Prism拟合曲线,测定酶的Km,kcat,Vmax,kcat/Km。
1.2.7 底物与产物对重组菌的影响
将重组菌悬浮于50 mmol/L的;磷酸氢二钠-柠檬酸缓冲液(pH 4.5)中,菌体OD600调至10,加入终浓度为0.3、0.5、1 mol/L的底物或产物,于37 ℃处理1 h后,离心收集菌体并使用去离子水洗涤2遍,然后测定菌体的剩余酶活力。对照组底物、产物的浓度为0 mol/L。
2 结果与分析
2.1 基因工程菌BL21/pET28a-ArAsd的构建
以不动杆菌(Acinetobacterradioresistens)的基因组为模版,通过PCR扩增,获得大小约为1 602 bp的核酸条带,与Asd基因理论大小相符,如图1所示。重组质粒pET28a-ArAsd使用EcoRⅠ和XhoⅠ限制性内切酶对重组质粒进行双酶切,经琼脂糖凝胶电泳,结果如图1泳道3所示,获得大小约为5 500 bp和1 602 bp的条带,长度分别与pET-28a载体和ArAsd基因大小相符,重组质粒中的Asd基因以pET28a载体通用引物进行测序,结果与Acinetobacterradioresistens的Asd基因大小一致。上述结果表明ArAsd基因已成功连接到pET28a载体质粒上。

M-marker;1-目的基因;2-EcoRⅠ酶切载体pET-28a;EcoRⅠ和XhoⅠ双酶切重组质粒
图1 重组载体pET28a-ArAsd酶切验证
Fig.1 The enzymic digestion of pET28a-ArAsd
2.2 重组Asd酶的诱导表达与纯化
将重组大肠杆菌BL21/pET28a-ArAsd于LB培养基中活化后,以1%的接种量接种于TB液体培养基培养至OD600约为0.8,加入终浓度为0.2 mmol/L的IPTG诱导表达12 h,收集细胞进行超声破碎,破碎上清液经SDS-PAGE电泳验证(图2)。电泳图谱显示在44.3 kDa与66.4 kDa之间有特异性表达条带,与理论相对分子质量60 kDa相符。破碎上清液经His Trap HP镍柱纯化,获得电泳纯的目的蛋白(图2),可用于进一步蛋白性质研究。
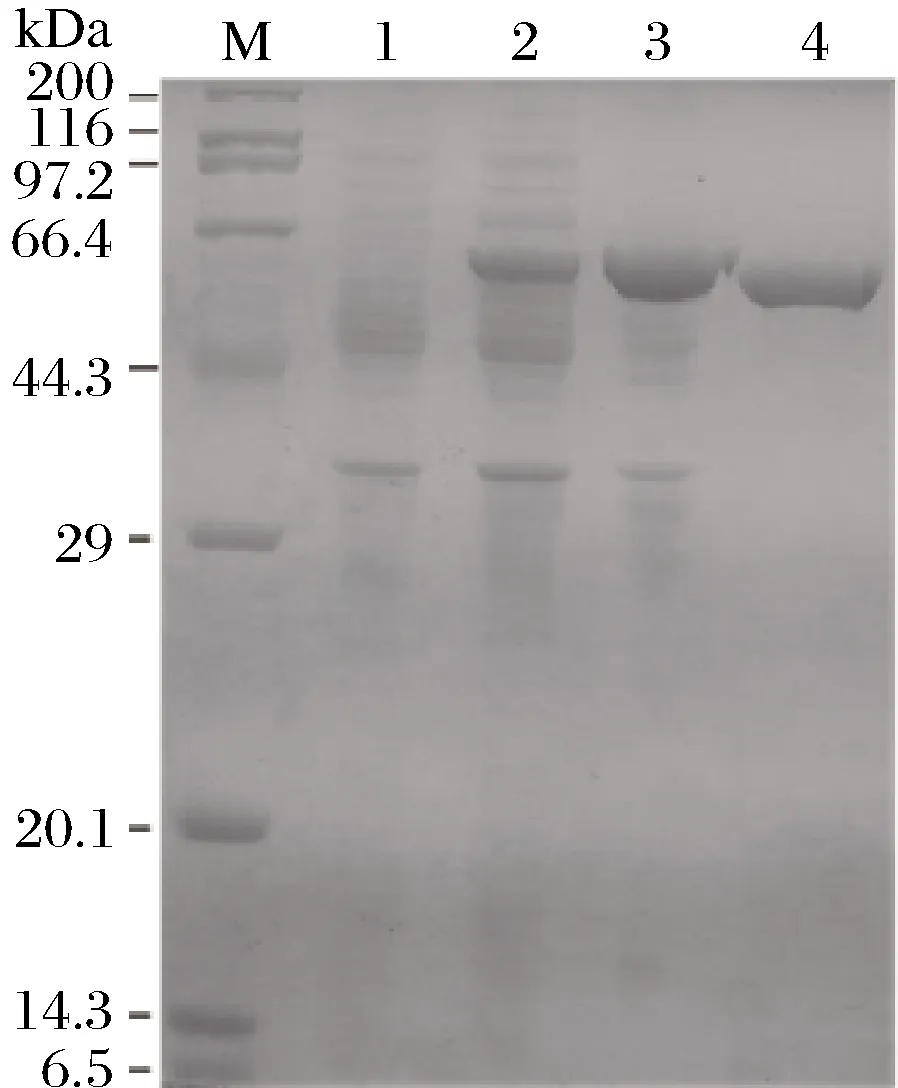
M-标准蛋白Marker;1-未诱导全细胞;2-诱导后破碎上清; 3-诱导后破碎沉淀;4-纯化后ArAsd
图2 重组菌BL21/pET28a-ArAsd表达产物的 SDS-PAGE电泳分析
Fig.2 The SDS-PAGE analysis of expression products in recombinant strain(BL21/PET28a-ArAsd)
2.3 重组Asd酶最适温度及温度稳定性
酶促反应过程中存在酶蛋白热变性累积效应,表现为前期温度较高时酶催化效率较高,后期由于蛋白质发生变性,有效酶分子数量减少,酶促反应效率降低。温度对ArAsd的酶活力影响如图3-a所示,其在50 ℃时达到最高酶活力。随着温度的升高,ArAsd酶活力呈现先升高后降低的趋势。从重组Asd酶的热稳定性实验结果(图3-b)可以看出,酶在设定的温度下放置3 h,酶活力均有一定程度损失,温度越高酶活力损失越快。40~45 ℃放置3 h,ArAsd较稳定,酶活力剩余70%以上, 50 ℃处理3 h酶活力剩余约为20%。
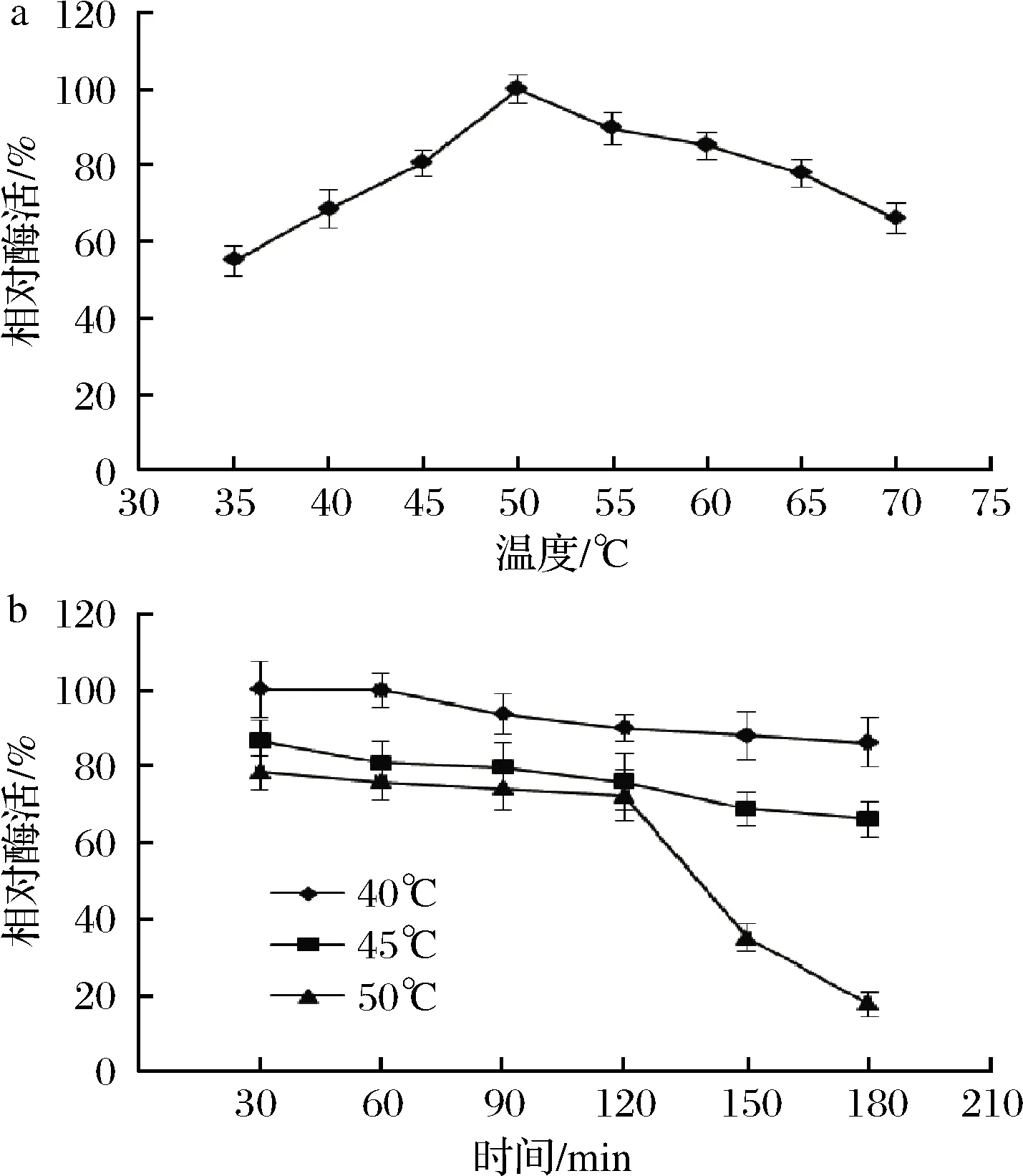
a-酶活;b-热稳定性
图3 温度对ArAsd酶活力的影响及酶的热稳定性
Fig.3 Effect of reaction temperature on ArAsd activity and thermal stability of the enzyme
2.4 重组Asd酶最适pH及pH稳定性
ArAsd的最适pH和pH稳定性实验结果如图4所示,随着pH的增加,其酶活力呈现先增高后降低的趋势,且在pH 4.5条件下具有最高酶活力;ArAsd在pH 6.0~7.0有较好的稳定性。
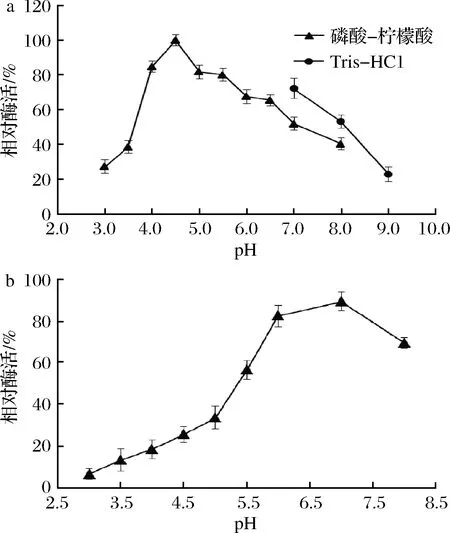
a-酶活;b-稳定性
图4 pH对ArAsd酶活力的影响及酶的pH稳定性
Fig.4 Effect of reaction pH on ArAsd activity and pH stability of the enzyme
2.5 动力学常数
重组纯酶ArAsd在常规测定条件下(37 ℃,pH 4.5)比酶活力为753 U/mg,较已有报道Pseudomonassp.[7]来源的Asd比酶活力高1.7倍,较Alcaligenesfaecalis[8]来源的Asd酶高2.5倍。ArAsd酶动力学常数如表2所示,其Km值较Pseudomonassp.[7]来源Asd酶低8.57 mmol/L,较Alcaligenesfaecalis[8]来源的Asd酶低5.95 mol/L,更易于与底物结合;同时,kcat值为Alcaligenesfaecalis[8]来源的Asd酶的2倍,表明其分子活力更高。较高的kcat/Km说明ArAsd具有更高的催化效率。
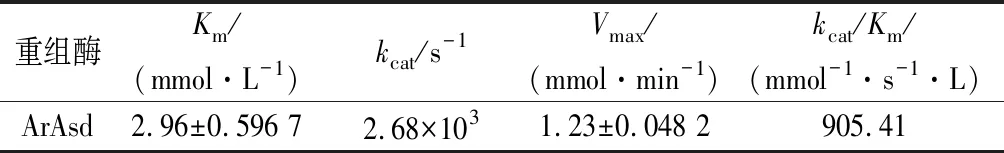
表2 重组酶ArAsd的动力学参数Table 2 the kinetic parameters of ArAsd
2.6 底物与产物对重组菌活性的影响
工业生产常利用全细胞作为催化剂进行生产,因此,测定重组菌对底物与产物浓度的耐受性对其应用的方法选择有重要影响。其结果如图5所示,高浓度底物L-天冬氨酸钠对全细胞的酶活力有促进作用,产物L-丙氨酸浓度高于0.5 mol/L时会对全细胞催化活性产生抑制作用。
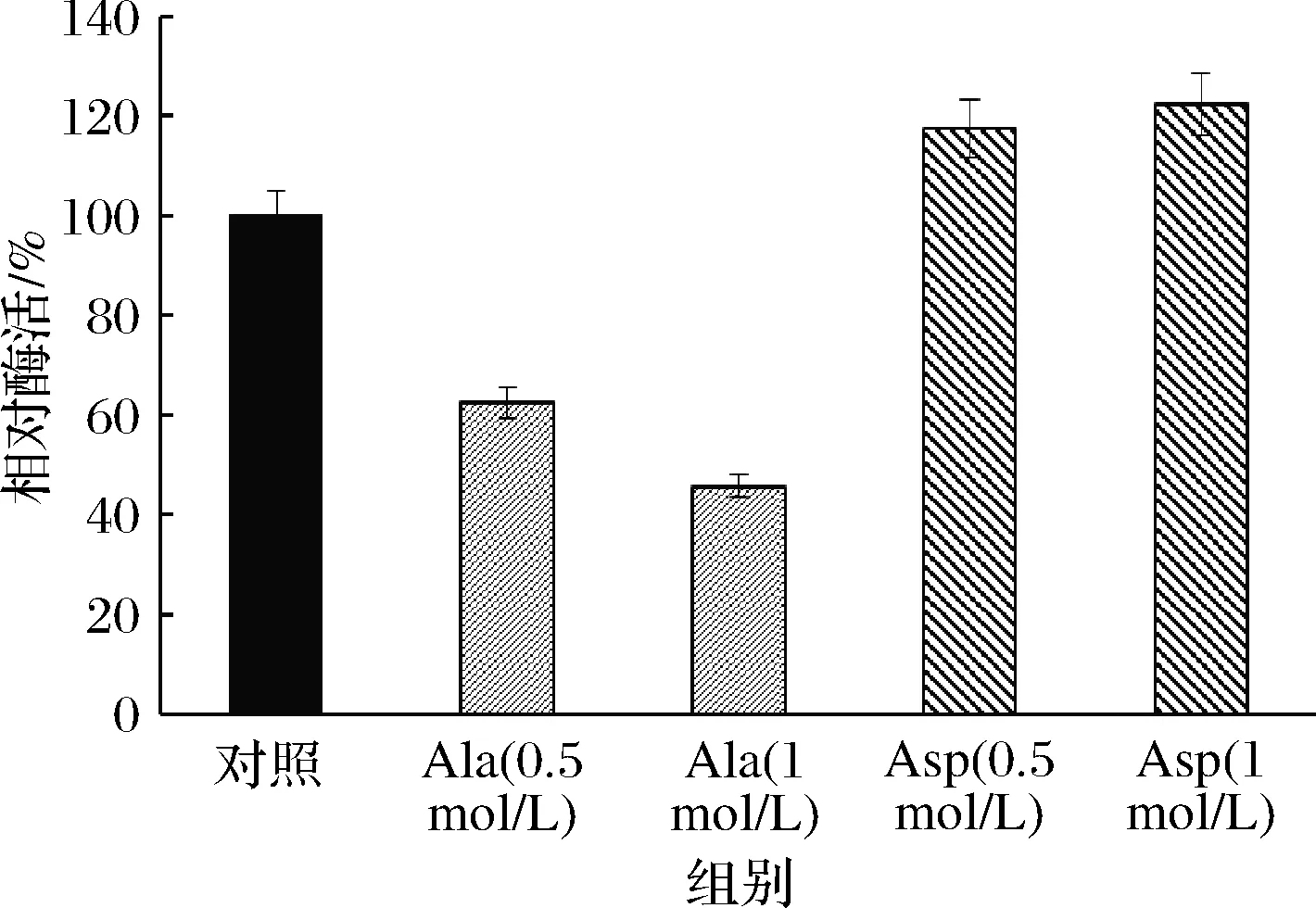
图5 重组菌对底物与产物的耐受性
Fig.5 Tolerance of recombinant cell to substrate and product concentrations
3 结论
Asd酶是工业上催化L-天冬氨酸生产L-丙氨酸的关键性酶,筛选具有高酶活力、高稳定性的Asd酶对工业生产L-丙氨酸具有重要意义。本文以pET28a为载体,在大肠杆菌细胞中重组表达了不动杆菌(Acinetobacterradioresistens)来源的Asd酶,SDS-PAGE电泳图显示Asd蛋白成功表达。对其进行酶学性质测定,结果显示其在50 ℃、pH 4.5时具有最高比酶活力753 U/mg,50 ℃处理2 h酶活力剩余70%左右,在pH 4.5条件下稳定性较差,处理12 h酶活力剩余20%左右。测定重组全细胞对底物与产物浓度的耐受性,结果显示高浓度底物L-天冬氨酸钠对全细胞催化活性有促进作用,产物L-丙氨酸浓度高于0.5 mol/L时会对全细胞催化活性产生抑制作用。
