中频电刺激对大鼠咬肌神经营养因子3 表达的影响
2020-07-06刘珍巧陈青青王豫蓉
刘珍巧,陈青青,王豫蓉
重庆医科大学附属口腔医院,口腔疾病与生物医学重庆市重点实验室,重庆市高校市级口腔生物医学工程重点实验室, 重庆 401147
中频电刺激是应用频率为1 ~100 kHz 的脉冲电流治疗疾病的一种物理方法,具有锻炼肌肉的作用,现已在康复医学领域得到广泛应用,其在颌面部的面瘫、吞咽功能障碍等疾病中的疗效也得到了肯定[2-3]。神经营养因子3 (neurotrophin-3,NT-3)是神经营养因子家族中的一员。有资料[4-6]显示:运动可以增强NT-3 表达,促进神经 - 肌肉接头(neuromuscular junction,NMJ)成熟,且主要集中在发育的早期;随着肌细胞成熟,NT-3 表达逐渐降低。
本实验使用颊车穴位中频电刺激作用于功能矫治大鼠咬肌,旨在了解NT-3 在中频电刺激诱导的咬肌神经肌肉改建中的作用,探讨功能矫治联合颊车穴位中频电刺激作为一种新的功能矫治器应用于临床的可能性。
1 材料与方法
1.1 实验动物与分组
选取4 周龄健康雄性SD 大鼠60 只[购自重庆医科大学实验动物中心,动物生产许可证号为SCXK(渝)2018-0003,动物使用许可证号为SYXK(渝)2018-0003]。所有动物均于重庆医科大学附属口腔医院实验室SPF 级环境喂养,实验前自由饮水、摄食。饲养环境:室温22 ~25 ℃,平均相对湿度为30%~40%。按随机分组原则分为3 组:空白对照组、条件对照组(戴用矫治器,不进行中频电刺激)、实验组(进行中频电刺激,同时戴用下颌前导矫治器),每组20 只。
1.2 仪器及试剂
在前期实验[7]中已证实下颌前伸模型的有效性。参照相关文献[8]改良导下颌向前装置,装置由甲基丙烯酸甲酯材料的斜面导板和富士Ⅰ型玻璃离子粘固剂制成。
中频电治疗仪ZM-CIA 购自中国HLIFE 公司,Z233MK-2 低温离心机购自德国HERMLE 公司,显微病理图文分析系统购自日本Olympus 公司,C-1000 荧光定量PCR 仪购自美国BIO-Rad 公司。兔抗大鼠NT-3 抗体购自美国Immunoway 公司,苏木精-伊红(H-E)染色试剂盒与SABC 试剂盒均购自美国Solarbio 公司,TRIGene 总RNA 提取试剂盒与反转录试剂盒StarScript Ⅱ Green Two-Step qRT-PCR Synthesis Kit 均购自中国GenStar 公司。
1.3 实验动物模型建立
大鼠经腹腔注射10%水合氯醛(3 mL/kg)麻醉后,利用玻璃离子粘固剂将上颌斜面导板粘固于大鼠上切牙;辅以防护颈圈,防止大鼠前爪破坏矫治器及抓伤面部,全天佩戴。有文献[9]报道,通过针刺颊车穴可出现神经、肌肉功能改善。因此,本实验选取双侧颊车穴,对实验组大鼠进行中频电刺激。穴位定位根据《大鼠穴位图谱的研制》[10]及《实验大鼠针灸俞穴图谱及针刺手法》[11]并比较解剖学原理,参照人体经穴定穴,“颊车穴”位于下颌角前上方咬肌最丰隆处中点。使用组织剪剪去咬肌处及其周围毛发,敷以甘油,以防止大鼠皮肤干燥损伤。电刺激前,于大鼠咬肌处涂抹生理盐水加强导电性,中频电治疗仪连接电极片,极片置于大鼠颊车穴,选择处方9(锻炼肌肉处方),频率为4 kHz,波形为正弦波,调整刺激强度,使其略高于肌肉收缩阈值,使面部肌肉轻微颤动,持续时间为15 min,每日1 次。
1.4 标本制备
分别在第3、7、14、21 日每组随机选取5 只SD 大鼠断颈处死。对各组大鼠进行解剖。取左侧咬肌中段置于冻存管中,迅速转移至液氮中,于NT-3 的PCR 检测备用。取右侧咬肌中段置于现配的4%多聚甲醛中固定12 h,脱水、透明、石蜡包埋。为观察肌肉纤维形态及组织变化,每块组织做连续纵切片,以备进行H-E 染色及免疫组织化学染色。
1.5 H-E 染色
取上述切片依次行常规脱蜡、复水、H-E 染色、脱水、透明、封片,显微镜下观察,采集图像并分析。
1.6 SABC 法免疫组织化学染色
取上述切片依次行脱蜡,复水,灭活内源性酶,热修复抗原,5% BSA 封闭,一抗4 ℃过夜,二抗37 ℃孵育,DAB 显色,复染细胞核及脱水封片,显微镜下观察,采集图像并分析。
1.7 实时荧光定量PCR
取一定量的液氮冻存咬肌标本于研磨专用管,加入研磨用小钢珠以及1 mL TRIzol,行组织块研磨、匀浆;按照TRIzol 试剂盒操作说明提取总RNA。用紫外分光光度计检测RNA 的浓度及纯度[D (260 nm)/D (280 nm)达到1.8 ~2.0],反转录合成cDNA。实时荧光定量PCR(qPCR)反应条件为95 ℃ 90 s、95 ℃ 5 s、60 ℃ 34 s,共计40 个循环。结果分析采用2-△△CT法。引物(表1)的合成及设计由Invitrogen 公司完成。

表1 qPCR 引物序列Tab 1 Primer sequences for qPCR
1.8 统计学分析
2 结果
2.1 咬肌再生性改变
空白对照组、条件对照组及实验组在第7 日的H-E染色结果见图1。观察细胞核和肌纤维在肌肉组织中的位置和数量,可见条件对照组和实验组均出现细胞核从边缘向中心移动的现象;实验组细胞核数量明显增多;各组肌纤维数量基本稳定;在条件对照组和实验组中,咬肌纤维并未出现断裂和退行性变,表现为再生而非 变性。

图1 H-E 染色观察咬肌再生性改变(×400)Fig 1 Regeneration of masseter muscle observed by H-E staining (×400)
2.2 咬肌中NT-3 蛋白的表达变化
NT-3 免疫组织化学染色阳性结果为细胞核蓝染,细胞质呈棕褐色(图2)。对其灰度值[积分光密度(integral optical density,IOD)]进行分析,结果显示(图3):与空白对照组比较,条件对照组在第3 日、第7 日NT-3 蛋白的表达未见明显变化(均P>0.05),在第14 日、第21日 NT-3 蛋白的表达明显上升(均P<0.05);实验组第3日 NT-3 蛋白的表达水平与其他2 组比较,差异均无统计学意义(均P>0.05);与空白对照组比较,实验组第7日、第14 日NT-3 蛋白的表达明显上升(均P<0.05);与条件对照组相比较,实验组第7 日NT-3 蛋白表达水平显著升高(P<0.05),而在第14 日、第21 日2 组差异无统计学意义(P>0.05)。进一步分析发现,条件对照组第21日出现NT-3 蛋白表达降低,而实验组在第14 日、第21日NT-3 蛋白的表达呈逐步降低的趋势。
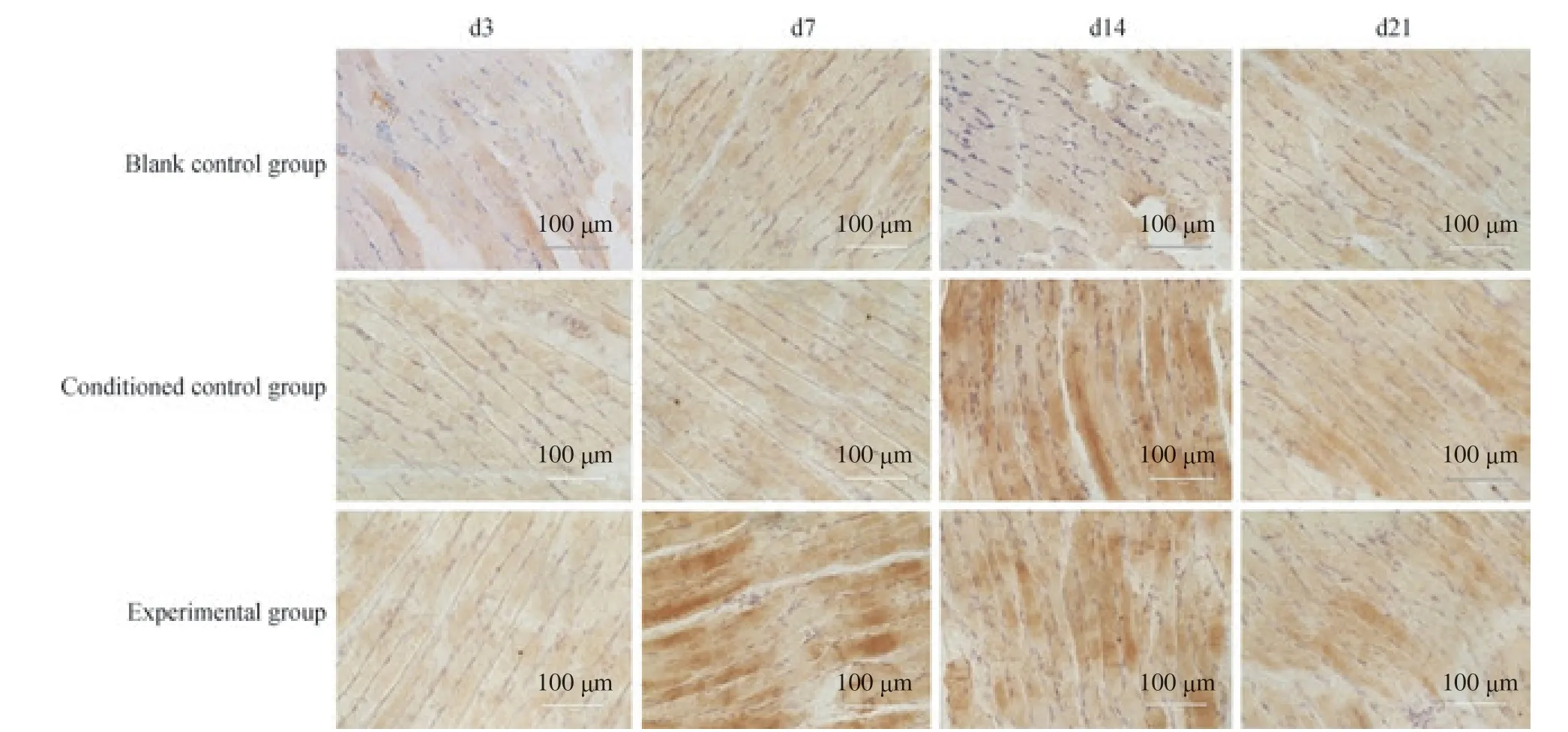
图2 SABC 免疫染色观察咬肌中NT-3 蛋白的表达变化(×400)Fig 2 Changes of expression of NT-3 protein in masseter muscle by SABC staining (×400)

图3 各组大鼠咬肌中NT-3 蛋白表达水平的比较Fig 3 Comparison of NT-3 protein expression in masseter muscle of rats among the groups
2.3 咬肌中NT-3 mRNA 的表达变化
将空白对照组第3 日 NT-3 mRNA 作为校准品,计算2-△△CT值。结果显示(图4),与空白对照组比较,条件对照组在第3 日、第7 日尚未出现明显的NT-3 mRNA 表达的差异(P>0.05),第14 日、第21 日NT-3 mRNA 表达明显上升(P<0.05);与空白对照组比较,实验组第3 日NT-3 mRNA 表达无明显变化(P>0.05),在第7 日、第14日 NT-3 mRNA 表达明显上升(P<0.05)。与条件对照组比较,第7 日实验组NT-3 mRNA 表达明显上升(P<0.05)。由图4 可见,随着时间的延长,条件对照组在第14 日出现NT-3 mRNA 表达的明显上升,在第21 日降低;而实验组在第7 日即出现NT-3 mRNA 表达的明显上升,而后逐渐降低,并基本恢复至空白对照组的水平。

图4 各组大鼠咬肌中NT-3 mRNA 表达水平的比较Fig 4 Comparison of NT-3 mRNA expression in masseter muscle of rats among the groups
3 讨论
中频电刺激可增强骨骼肌收缩,通过骨骼肌改建产生康复作用。骨骼肌改建又反过来刺激突触前运动神经末梢,促进了NMJ 的成熟,形成一个正向强化模型,从而加强骨骼肌的神经肌肉改建[12]。本实验中对功能矫治大鼠进行颊车穴位中频电刺激后,咬肌细胞中NT-3 蛋白的变化与NT-3 mRNA 的表达变化趋势基本一致,证实NT-3 mRNA 的突触活动依赖性表达,使大鼠咬肌出现NT-3 蛋白的释放增加[13]。其他相关研究[14-15]也显示,骨骼肌进行主动训练后,NT-3 表达显著上升。NT-3 可促进突触前运动神经元轴突的生长[6],并调节胶质细胞活性,影响施万细胞与运动神经元的相互作用,促进突触成熟[16]。另有研究[17]显示电刺激促进轴突出芽生长,显著增加运动神经元的数量,推测功能矫治联合颊车穴位中频电刺激对大鼠咬肌神经的改建有正向作用。
神经营养因子家族在神经肌肉改建的不同阶段发挥作用,其中NT-3 表达一般在突触成熟的早期上升,在后期逐渐降低[18]。在实验初期,空白对照组、条件对照组以及实验组大鼠咬肌NT-3 蛋白及mRNA 的表达在第3 日时的差异无统计学意义。有研究[19]显示,主动锻炼大鼠的骨骼肌中NT-3 mRNA 的表达在第5 日上升。因此,推测条件对照组和实验组大鼠的咬肌在第3 日可能并未产生神经肌肉改建。实验第7 日,中频电刺激组大鼠已经出现明显的NT-3蛋白及mRNA 的表达上升。NT-3 蛋白增多,作用于突触前神经末梢的酪氨酸激酶C 受体,使突触前神经末梢释放更多乙酰胆碱,肌细胞膜上的乙酰胆碱受体结合位点增加,触发更强的突触后反应和化学反应,增强肌肉功能,同时突触活性增强使NT-3 mRNA 表达上升,形成正向强化模型,提高神经肌肉改建的效率[20-21]。接受中频电刺激的大鼠可能在戴用下颌功能矫治器的早期即出现了活跃的神经肌肉改建,而条件对照组大鼠咬肌在第14 日才开始出现NT-3 蛋白及mRNA 表达的上升。仅戴用功能矫治器的大鼠,其咬肌神经肌肉的改建可能相对于接受中频电刺激的大鼠有所滞后。
研究[22]显示,在发育完成的突触中NT-3 表达保持在低水平。本实验中功能矫治大鼠NT-3 蛋白及mRNA 的表达变化整体呈现先增高后降低的趋势,条件对照组大鼠第21 日NT-3 蛋白及mRNA 的表达与空白对照组仍有差异,NMJ 的发育可能尚未完成,仅戴用功能矫治器的大鼠咬肌可能仍处于神经肌肉的改建期;而实验组在第21 日大鼠咬肌NT-3 蛋白及mRNA 的表达水平基本恢复至矫治前,可能此时NMJ 已发育成熟,神经肌肉改建在第21 日已基本完成。综上,颊车穴位中频电刺激可能缩短了功能矫治大鼠的神经肌肉改建时间,使下颌适应新的形态位,快速实现神经肌肉改建的稳定。
本研究结果表明,功能矫治联合咬肌颊车穴位中频电刺激,可导致大鼠早期出现NT-3 蛋白及mRNA 表达的上升,提高突触成熟速率,增强肌肉功能,促进神经肌肉改建,提前达到下颌前伸矫治结果的稳定。功能矫治联合咬肌颊车穴位中频电刺激有望作为一种新的主动训练型功能矫治器应用于临床,但其临床诊疗的具体参数及作用机制还有待进一步研究。
参·考·文·献
[1] 李志华. 周期性牵张应力作用下大鼠成肌细胞形态改变力学响应机制的研究[D]. 成都: 四川大学, 2004.
[2] 李冰洁, 张通, 李芳. 神经肌肉电刺激对卒中后吞咽障碍治疗作用的研究[J]. 中国卒中杂志, 2017, 12(3): 207-213.
[3] Kletzien H, Russell JA, Leverson G, et al. Effect of neuromuscular electrical stimulation frequency on muscles of the tongue[J]. Muscle Nerve, 2018, 58(3): 441-448.
[4] Chung JY, Kim MW, Im W, et al. Expression of neurotrophin-3 and trkC following focal cerebral ischemia in adult rat brain with treadmill exercise[J]. Biomed Res Int, 2017, 2017: 1-6.
[5] Li Y, Xia B, Li R, et al. Expression of brain-derived neurotrophic factors, neurotrophin-3, and neurotrophin-4 in the nucleus accumbens during heroin dependency and withdrawal[J]. Neuroreport, 2017, 28(11): 654-660.
[6] Sheard PW, Bewick GS, Woolley AG, et al. Investigation of neuromuscular abnormalities in neurotrophin-3-deficient mice[J]. Eur J Neurosci, 2010, 31(1): 29-41.
[7] 尹灵芝, 王强, 王豫蓉, 等. 穴位电针对功能矫治大鼠咀嚼肌基质金属蛋白酶-9 表达的影响[J]. 重庆医科大学学报, 2013, 38(7): 751-754.
[8] 崔佳, 刘学聪, 刘昕, 等. 下颌功能性前伸后髁突部RANKL、MMP-2、MMP-9 及VEGF 水平变化的实验研究[J]. 中国临床研究, 2019, 32(4): 433-438.
[9] 李英南, 王健, 周鸿飞, 等. 不同深度针刺地仓、颊车穴对周围性面瘫患者生活质量及面神经功能的影响[J]. 中医杂志, 2019, 60(2): 57-60.
[10] 华兴邦, 周浩良. 大鼠穴位图谱的研制[J]. 实验动物与动物实验, 1991(1): 1-5.
[11] 方宗畴. 实验大鼠针灸俞穴图谱及针刺手法[J]. 南京铁道医学院学报, 1993, 12(1): 19-21.
[12] Qi YC, Niu XL, Gao YR, et al. Therapeutic effect evaluation of neuromuscular electrical stimulation with or without strengthening exercise on spastic cerebral palsy[J]. Clin Pediatr, 2018, 57(5): 580-583.
[13] Xie K, Wang T, Olafsson P, et al. Activity-dependent expression of NT-3 in muscle cells in culture: implications in the development of neuromuscular junctions[J]. J Neurosci, 1997, 17(9): 2947-2958.
[14] Ying Z, Roy RR, Edgerton VR, et al. Voluntary exercise increases neurotrophin-3 and its receptor TrkC in the spinal cord[J]. Brain Res, 2003, 987(1): 93-99.
[15] Akyol O, Sherchan P, Yilmaz G, et al. Neurotrophin-3 provides neuroprotection via TrkC receptor dependent pErk5 activation in a rat surgical brain injury model[J]. Exp Neurol, 2018, 307: 82-89.
[16] 杨海红, 吴海涛. 神经肌肉接头突触发育信号机制研究进展[J]. 生命科学, 2017, 29(3): 277-291.
[17] Thomas HH. Clinical strategies to enhance nerve regeneration[J]. Neural Regen Res, 2015, 10(1): 22-24.
[18] Guo Y, Su ZJ, Chen YK, et al. Brain-derived neurotrophic factor/neurotrophin 3 regulate axon initial segment location and affect neuronal excitability in cultured hippocampal neurons[J]. J Neurochem, 2017, 142(2): 260-271.
[19] Gómez-Pinilla F, Ying Z, Opazo P, et al. Differential regulation by exercise of BDNF and NT-3 in rat spinal cord and skeletal muscle[J]. Eur J Neurosci, 2001, 13(6): 1078-1084.
[20] Todd KJ, Auld DS, Robitaille R, et al. Neurotrophins modulate neuron-glia interactions at a vertebrate synapse[J]. Eur J Neurosci, 2007, 25(5): 1287-1296.
[21] Li H, Lin S, Qin T, et al. Senegenin exerts anti-depression effect in mice induced by chronic un-predictable mild stress via inhibition of NF-κB regulating NLRP3 signal pathway[J]. Int Immunopharmacol, 2017, 53: 24- 32.
[22] Zhang YT, Jin H, Wang JH, et al. Tail nerve electrical stimulation and electroacupuncture can protect spinal motor neurons and alleviate muscle atrophy after spinal cord transection in rats[J]. Neural Plast, 2017, 2017: 7351238.
