僵蚕抗凝成分仿生提取液的氨基酸序列分析
2020-07-06张琳李玥张玉娟
张琳,李玥,张玉娟
(山东中医药大学附属医院,山东 济南 250014)
僵蚕,别名天虫、姜蚕,又名白僵蚕,为蚕蛾科昆虫家蚕(BombyxmoriL.)4~5龄的幼虫感染(或人工接种)白僵菌[Beauveriabassiana(Bals.)Vuill ant]而致死的干燥体。僵蚕具熄风解痉、化痰散结、祛风止痛、活血通络等多种功效,目前多用于治疗癫痫、顽固性头痛等疾病。现代药理实验证实,其水提取液有较强的抗凝、抗血栓、促纤溶等作用,其主要活性成分可能为草酸铵、蛋白质(或多肽)或氨基酸等[1-5]。有文献报道[6-7],白僵蚕水解后含有 17种氨基酸,甘氨酸Gly最高,其次为丙氨酸Ala、丝氨酸Ser和苏氨酸Tyr,而精氨酸Arg最低;另有报道称,僵蚕水解液中共有15种氨基酸残基,其中谷氨酸Glu残基最高,其次为精氨酸Arg、丙氨酸Ala和甘氨酸Gly,而蛋氨酸Met含量最低。
20世纪90年代,仿生提取法既已用于天然药物以及中药的辅助提取。在已有的动物药提取工艺研究中,水蛭仿生酶提取法与水提法相比,其提取液的抗凝活性更强;土鳖虫仿生酶解技术提取更充分,提取物活性更强;僵蚕粉末仿生胃液中化学成分的溶出性能优于煎液[8-11]。为进一步探究僵蚕的抗凝活性成分,本研究以抗凝活性为指标,通过试验筛选出提取僵蚕的最佳工艺流程,然后采用高效液相色谱-串联质谱(HPLC-MS/MS)平台对僵蚕仿生提取液的抗凝成分结构进行初步分析,为僵蚕抗凝活性成分的进一步研究提供基础。
1 实验材料
1.1 药材 僵蚕,市售,经山东中医药大学药学院张学顺教授鉴定为蚕蛾科昆虫家蚕(BombyxmoriL.)4~5龄的幼虫感染白僵菌而致死的干燥体。
1.2 仪器 液相质谱联用系统(美国Thermo Fisher UltiMate 3000液相色谱系统和Thermo Fisher Q Exactive高分辨率质谱);电子天平(01193-YP601N 型,上海精密科学仪器有限公司);高速离心机(d-37520,Thermo Electron LED GmbH Osterode);pH计(PB-10,Sartorius);磁力加热搅拌器(78-1型,金坛市杰瑞尔电器有限公司);水浴恒温振荡器(SHZ-82型,北京市永光明医疗仪器有限公司);电热恒温水浴锅(北京市永光明医疗仪器有限公司)。
1.3 试剂 胃蛋白酶(1∶1200,国药集团化学试剂有限公司,批号20130913);甲酸、乙腈为色谱纯;其他试剂均为分析纯,水为超纯水。
2 方法
2.1 僵蚕提取方法 精密称取僵蚕粉末5 g,胃蛋白酶0.667 g ,加水150 mL(加盐酸调节至pH 2.0),于(47±1)℃水浴提取2 h,滤过、浓缩至生药量100 mg·mL-1。浓缩后提取液以3 000 rpm转速离心15 min,取上清液用超纯水定容至50 mL,即得僵蚕胃蛋白酶提取液。
2.2 HPLC-MS/MS分析测定
2.2.1 供试品的制备 按照“2.1”项下胃蛋白酶提取法得僵蚕提取液,超滤后得相对分子量为500~1 000的样品,0.22 μm滤膜、过滤,即得供试品溶液。
2.2.2 色谱条件 色谱柱Halo C18柱(2.1 mm×100 mm,2.7 μm);流速0.3 mL·min-1;柱温45 ℃,进样室:4 ℃;流动相(A:0.05%甲酸-水溶液;B:0.05%甲酸-乙腈溶液)。线性梯度洗脱条件:0~25 min:5%B~20%B;25~40 min:20% B~50% B;40~41 min:50%B~99%B;41~45 min:99%B;45~45.01 min:99%B~5%B;45.01~55 min:5%B。
2.2.3 质谱条件 电喷雾离子源(electrosprayionization,ESI)正离子模式全扫描检测,喷雾电压:3.0 kV;鞘气流速:45 arb;辅助气流速:10 arb;;辅助气耐热温度:30 ℃;离子传输管温度:275 ℃;质谱分辨率:70 000 FWHM(m/z 200);自动增益控制AGC:3e6;最大注入时间IT:200 ms;全扫描质量范围为100~1 200;二级质谱碰撞能为30%。
3 僵蚕胃蛋白酶提取液液相色谱质谱分析
图1A和图1B分别为僵蚕酶解液的总离子流TIC和蛋白多肽图,由图可知,僵蚕提取液的酶解多肽类成分主要分布在42~47 min。
现对总离子流图中42.82 min(Ⅰ)、43.22 min(Ⅱ)、44.34 min(Ⅲ)、46.33 min(Ⅳ)4个色谱峰进行氨基酸序列解析。根据精确质量数扫描结果,图2~5一级质谱图中离子m/z 1 012、m/z 1 155、m/z 969.2、m/z 1 180均为单电荷离子。根据氮律及氨基酸残基分子量推断,多肽Ⅰ为相对分子质量为1 011的九肽,多肽Ⅱ为相对分子质量为1 154的十肽,多肽Ⅲ为相对分子质量为968.2的八肽,多肽Ⅳ为相对分子质量为1 179的十肽[6~9]。
根据多肽Ⅰ的一级质谱和二级质谱叠加图(见图2)中的特异性碎片离子m/z 1 012、m/z 638.6、m/z 466.7、m/z 187.9,推断Ⅰa离子有5种情况:一分子甘氨酸Gly(75 Da)、一分子丙氨酸Ala(89 Da)、两分子天冬酰胺Asn(132 Da);一分子甘氨酸Gly(75 Da)、一分子丙氨酸Ala(89 Da)、一分子缬氨酸Val(117 Da)、一分子谷氨酸Glu(147 Da);一分子甘氨酸Gly(75 Da)、一分子丙氨酸Ala(89 Da)、一分子亮氨酸Leu(131 Da)或异亮氨酸Ile(131 Da)、一分子天冬氨酸Asp(133 Da);两分子甘氨酸Gly(75 Da)、一分子亮氨酸Leu(131 Da)或异亮氨酸Ile(131 Da)、一分子谷氨酸Glu(147 Da);两分子甘氨酸Gly(75 Da)、一分子赖氨酸Lys(146 Da)或谷氨酰胺Gln(146 Da)、一分子天冬酰胺Asn(132 Da)。Ⅰb离子为一分子脯氨酸Pro(115 Da)、一分子甘氨酸Gly(75 Da)组成。Ⅰc离子有3种情况:一分子丙氨酸Ala(89 Da)、一分子丝氨酸Ser(105 Da)、一分子半胱氨酸Cys(121 Da);一分子甘氨酸Gly(75 Da)、一分子苏氨酸Thr(119 Da)、一分子半胱氨酸Cys(121 Da);三分子丝氨酸Ser(105 Da)。
综上所述,采用同样的方法根据图3~5对多肽Ⅱ、多肽Ⅲ、多肽Ⅳ进行肽链结构分析,结果见表1。
4 结论和讨论
4.1 近几年来,由1~10个氨基酸组成的寡肽已经引起了广泛的研究和重视,寡肽可直接参与组织蛋白的合成,具有免疫、抗氧化、抗病毒、抗肿瘤、诱导细胞凋亡等多种药理作用,而且人体各脏器也可完整的利用寡肽。通过对僵蚕胃蛋白酶提取液的LC-MS/MS检测,根据所得的质谱图,我们对僵蚕酶解多肽的一级结构进行了初步的推断,认为僵蚕胃蛋白酶提取液中主要的抗凝活性成分为氨基酸数低于10的寡肽。
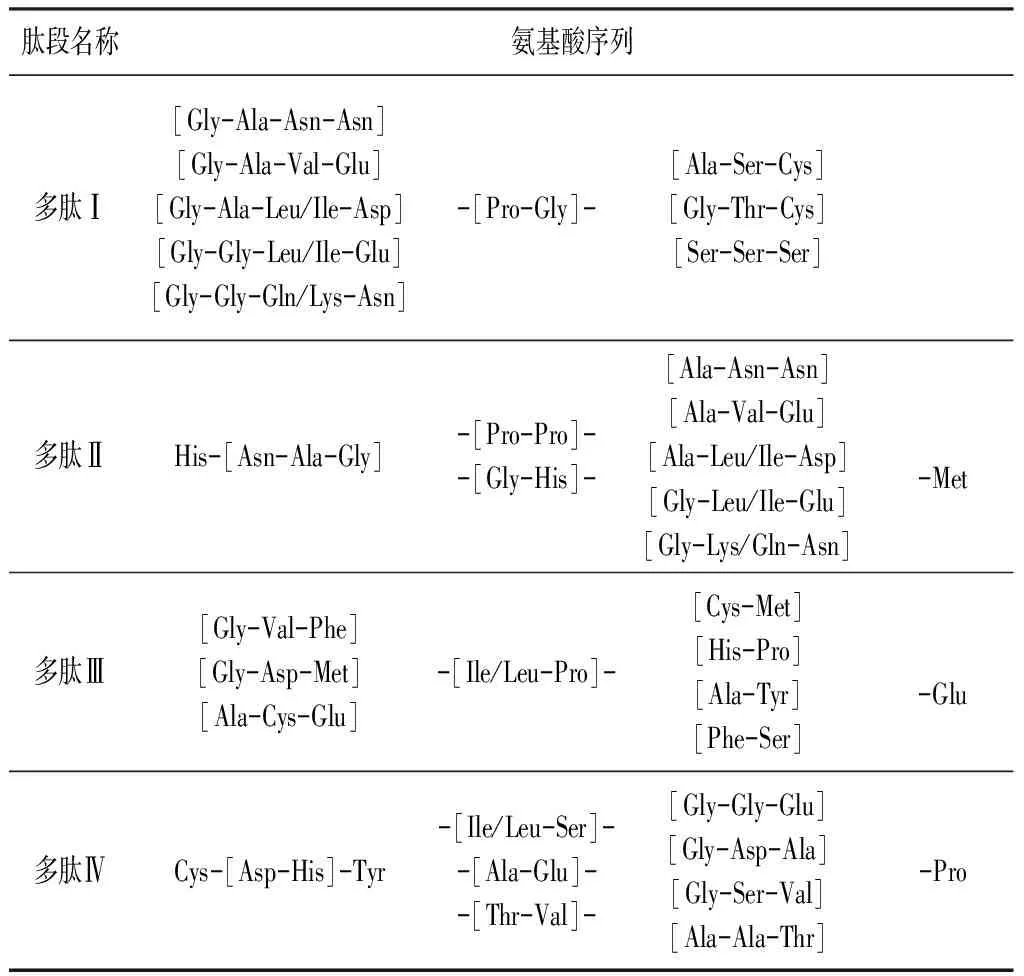
表1 酶解多肽的氨基酸序列分析
4.2 本研究在氨基酸序列推断中发现,僵蚕胃蛋白酶提取液中可以确定含有的氨基酸有Gly、His、Asn、Ala、Met、Pro、Ile/Leu、Glu、Cys、Asp、Tyr,这与文献报道的僵蚕水提液氨基酸组成存在一定的差异性[6-7]。课题组已通过体内外药理实验证实僵蚕仿生酶提取液比水提液具有更高的抗凝活性,其中胃蛋白酶提取法最优。因此推测胃蛋白酶提取液与水提液抗凝活性差异不仅是因为溶出增多,同时也因为酶解作用产生了新的活性多肽。
4.3 目前串联质谱法已成为多肽类药物氨基酸序列测定的主要工具,但高分辨准确质量的碎片离子峰是测序的关键,多肽样品的稳定是测序的前提。本研究在采用串联质谱手动分析法进行多肽氨基酸的测序过程中,由于离子信息的不完整,存在无法鉴别的碎片离子峰,同时也可能由于多肽的不稳定性,导致多肽样品氨基酸序列未能最终确定。随着相关测序软件的完善及质谱技术的不断发展,串联质谱法在多肽结构分析中将发挥更大的作用,我们也将采用新的技术对活性多肽的结构进行更加深入的分析。
