线粒体丙酮酸载体在肝细胞癌中的表达及临床意义
2020-07-05马向明侯婧悦付庆江曹立瀛
马向明 侯婧悦 付庆江 曹立瀛
肝细胞癌(hepatocellular carcinoma, HCC)是致死率最高的恶性肿瘤之一[1,2]。HCC同时存在糖酵解代谢的增强和糖异生功能的减弱,促进糖异生可以拮抗糖酵解并有效的抑制HCC的生长[3]。线粒体丙酮酸载体(mitochondrial pyruvate carriers, MPC)在细胞代谢过程中负责丙酮酸自细胞质向线粒体基质内转运的作用,因此,在HCC的发生和发展过程中可能起到关键的作用[4]。本研究分析了MPC在HCC及癌旁组织中的表达及其对预后影响。为MPC功能障碍或缺失分子机制的研究提供理论依据。
资料与方法
一、病例选择
收集天津医科大学肿瘤医院2011年1月至2012年12月经手术切除同时病理学证实为HCC的85例患者的临床及病理学资料。选择标准:①HCC手术根治性切除;②无肝外或远处转移;③术前未行介入、放疗、无水酒精注射等治疗。一般资料包括:性别、年龄;临床数据包括: ALT、AST、AFP、TBil、Alb、凝血酶原时间(PT)、PLT、巴塞罗那分期(BCLC);病理学资料包括:肿瘤大小、肿瘤数量、肿瘤分化程度、微血管侵润情况、微小转移情况。所有患者标本的获取都经天津医科大学肿瘤医院伦理委员会同意,手术前取得患者的同意并签署知情同意书。
二、随访
随访截止日期为2015年11月。从手术当天开始计算生存时间和至复发时间。通过门诊、电话、查阅病历资料等方式进行随访。术后随访复发时间和死亡时间。
三、免疫组化分析
将85例患者的肝癌和癌旁组织分别进行MPC1和MPC2的免疫组化分析后,在正置显微镜下观察并拍照。每张免疫组化的显微照片均通过Image-Pro Plus软件进行扫描,获得累积吸光度(A)和面积(area)。通过计算得出平均吸光度(density mean),平均吸光度为累积吸光度和累积面积比值(density mean = IA sum/areasum)。得出的平均吸光度与目标蛋白量成正比,因此可反映出目标蛋白的表达量[5]。
四、统计学分析
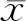
结 果
一、肝癌组织中MPC1和MPC2的表达
免疫组织化学法分析85例患者术后的癌组织和癌旁组织病理学切片,结果显示:癌组织中的MPC1和MPC2表达水平均显著低于癌旁组织。见图1。
二、肝癌组织中MPC1及MPC2的表达水平与病理学指标的相关性
将MPC1和MPC2高低表达组的临床病理学指标进行了统计学分析。结果显示:肝癌组织中MPC1及MPC2的蛋白表达水平与患者性别、年龄、ALT、AST、AFP、TBil、Alb、PT、PLT、巴塞罗那(BCLC)分期、肿瘤大小、肿瘤数量、肿瘤分化程度、微血管侵润、微小转移等因素均无相关性(均P>0.05)。见表1。
三、肝癌组织中MPC1表达降低是肝癌患者术后复发的独立危险因素
在单因素分析中,巴塞罗那分期、肿瘤最大直径>5 cm、微血管侵润和MPC1低表达为肝细胞肝癌术后复发的危险因素。多因素分析结果显示,微血管侵润和MPC1为肝细胞肝癌术后复发的独立危险因素;而MPC2表达水平与患者术后复发无相关性。见表2。
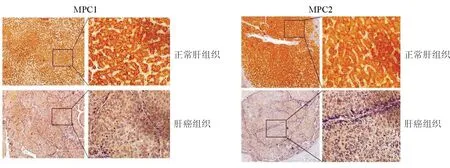
图1 肝细胞肝癌患者肝组织中的线粒体丙酮酸载体(MPC1)和(MPC2)的表达显著降低免疫组织化学
表1 肝癌组织中MPC1及MPC2的表达水平与临床病理学指标的相关性

指标MPC1高表达(n=43)低表达(n=42)P值MPC2高表达(n=43)低表达(n=42)P值年龄(岁,x±s) 54.8±9.554.7±11.20.42655.7±10.953.9±9.80.386性别(男/女,例)33/1037/50.25533/937/60.407ALT(U/L, x±s)37.4±25.537.0±19.00.13134.1±21.737.2±23.10.626AST(U/L, x±s)40.6±27.137.6±27.00.86439.5±32.137.8±21.40.507TBil(μmol/L, x±s)17.0±10.019.6±12.90.99919.6±14.217.2±8.20.120Alb(g/L, x±s)46.3±4.143.5±6.60.18744.0±6.645.8±4.40.431PT (s, x±s)11.2±1.111.8±3.10.29611.7±3.211.4±1.20.441PLT(×109/L, x±s)158.0±69.8167.9±48.90.473162.6±80.4163.6±69.10.411AFP(ng/mL) >200 16151714 ≤200 27271.00025290.504BCLC 分期 0~A23151820 B~C20270.12824230.828肿瘤数量 135393638 >1 830.195650.757最大直径(cm) >516212017 ≤5 27210.27822260.515最小直径(cm) >319242221 ≤3 24180.28120220.829分化程度 低16131415 中、高 27290.64928281.000微血管侵润 有23252325 无20170.66319180.828微小转移 有14181716 无29240.37526270.824
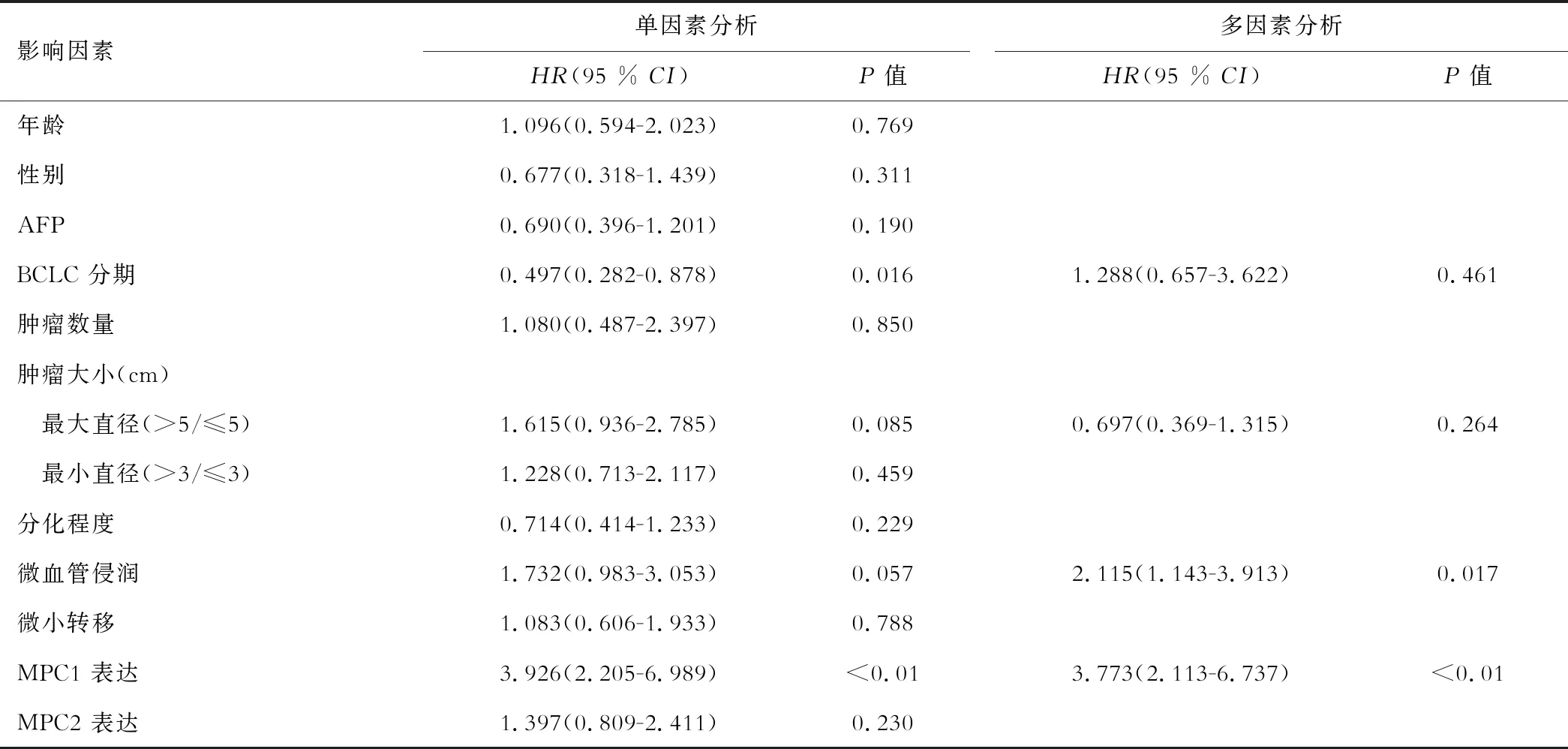
表2 单因素及多因素分析肝癌术后复发的危险因素
四、肝癌组织中MPC1表达水平与患者预后的相关性
将高表达MPC1组和低表达MPC1组患者的随访结果进行Kaplan-Meier生存分析,结果显示:MPC1表达水平降低明显增加了HCC患者术后复发的可能性,在MPC1的高表达组与低表达组中,3年无瘤生存率分别为55.8%和21.4%;在MPC1的高表达组与低表达组中,3年总体生存率分别为78.6%和41.9%。见图2。
五、肝癌组织中MPC2蛋白表达水平与肝癌患者预后的相关性
Kaplan-Meier生存分析结果显示:在MPC2的高表达组与低表达组中,MPC2的蛋白表达水平与肝细胞肝癌患者术后3年无瘤生存率及术后3年总体生存率均差异无统计学意义,P值分别为0.254和0.452。见图3。

图2 MPC1表达水平与肝细胞肝癌患者术后无瘤生存率及总体生存率的关系
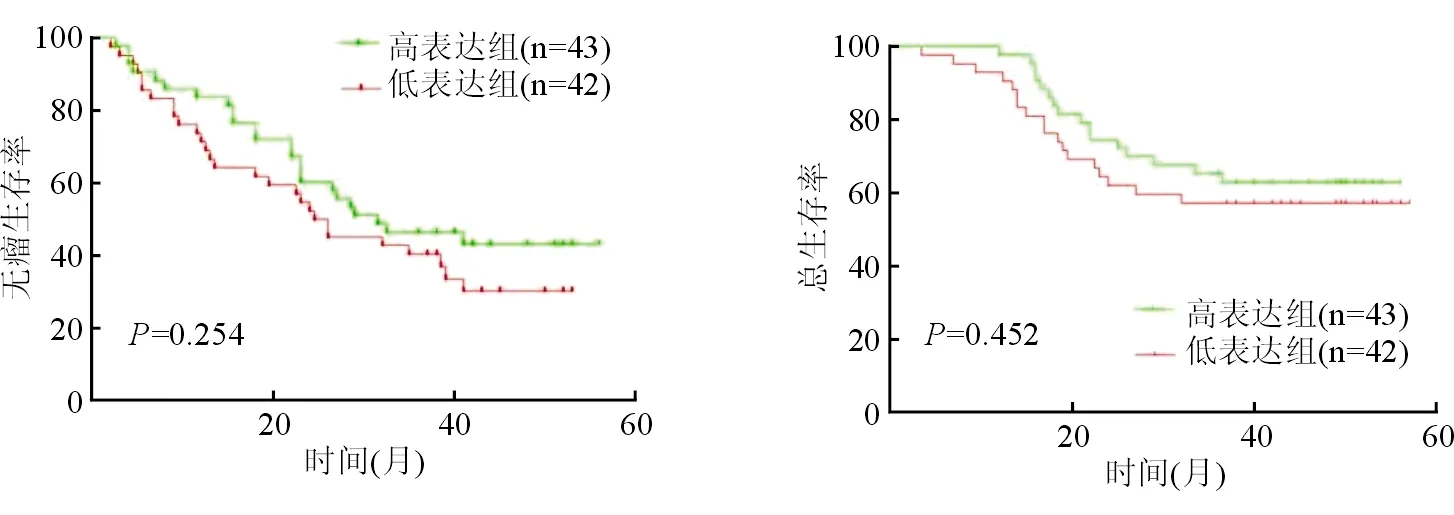
图3 MPC2表达水平与肝细胞肝癌患者术后无瘤生存率及总体生存率的关系
讨 论
癌细胞代谢的改变对肿瘤的生长至关重要,而其他的肿瘤生物学特征都与线粒体的代谢作用存在联系[6]。丙酮酸代谢异常是肿瘤细胞能量代谢的关键,MPC位于糖酵解和线粒体丙酮酸代谢的交叉点,因此,MPC在肿瘤细胞的代谢改变方面发挥着重要作用[7-11]。
在MPC的蛋白组成和身份被鉴定出来后,发现MPC1、MPC2在多数肿瘤中的表达不一致[12-14]。最近的研究结果显示,MPC1和MPC2在前列腺癌中均表现为低表达,且都与预后呈正相关,其表达的缺失会导致肿瘤细胞更具有侵略性[15]。本研究结果显示,在肝癌组织中MPC1及MPC2的表达水平均显著低于癌旁组织,揭示了癌组织内MPC功能障碍可能与HCC糖异生功能下降及糖酵解代谢增强有关。通过进一步的分析发现,MPC1的蛋白表达水平对HCC患者的预后有重要影响,即MPC1表达水平低的HCC患者术后复发率升高且总体生存时间缩短。单因素及多因素分析也显示MPC1表达水平下降是HCC患者术后复发的独立危险因素。而MPC2的蛋白表达水平虽然和MPC1同比例下降,但并不能判断患者的预后。因此,MPC1蛋白的表达水平可作为评价HCC患者预后的指标。分析MPC1和MPC2的表达水平与临床病理学指标的相关性发现,MPC1和MPC2的蛋白表达水平与这些指标均无明显相关性,可能与以下因素有关:①纳入的病例数少(仅85例);②选择的临床病理学指标和肿瘤细胞的能量代谢无关;③一些可能有关的临床病理学指标本并未纳入。由于对MPC的分子身份认识较晚,目前对于MPC在恶性肿瘤发生发展中的重要性及其调控机制方面的研究较少,仍需要进一步深入研究[7]。
综上所述,肝细胞线粒体含量最丰富的细胞之一,同时负责肝脏糖异生功能。基于MPC功能障碍或缺失在恶性肿瘤中的普遍性及其在调节细胞内丙酮酸代谢过程和调控能量代谢的关键作用,进一步的积极探索和研究肿瘤细胞能量代谢异常中调控MPC活性的相关分子机制,并寻找有效的解决方案,将为抑制恶性肿瘤的转移和复发的抗癌药物研发提供新的思路。
