A 群轮状病毒一步法RT-ddPCR 方法的建立
2020-07-04徐蕾蕊魏咏新魏海燕张西萌付溥博赵晓娟
徐蕾蕊,马 丹,魏咏新,李 丹,魏海燕,刘 莉,张西萌,汪 琦,付溥博,赵晓娟,曾 静*
(北京海关技术中心,北京 100026)
20世纪70年代之后,各国学者相继发现诺如病毒(norovirus,NoV)、轮状病毒(rotavirus,RV)、人星状病毒(human astrovirus,HAstV)、腺病毒、札如病毒等是引起儿童、老年人以及免疫力低下人群急性水样腹泻和重症腹泻的主要病原体[1-4]。其中,RV是世界范围内引起儿童急性腹泻和儿童重症腹泻的最常见病毒,全球每年约有1.14亿儿童发生RV腹泻,最近监测显示全国范围内因腹泻入院的5 岁以下儿童中RV检测阳性率高达47.8%[5-6]。
R V是一种R N A病毒,属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavrus)。RV基因组由11 条双链RNA组成,共编码11 种蛋白质,包括6 种结构蛋白(VP1~4、VP6和VP7)和5 种非结构蛋白(NSP1~5)[7-8]。根据抗原蛋白VP6不同,RV可分为A~H八个群,只有A、B、C和H群RV能感染人类,A群RV是婴幼儿腹泻的主要病原体[9-10]。非结构蛋白NSP3编码基因序列具有高度保守性[11-12],参与RV侵染宿主细胞过程,具有转录调节作用[13-14]。本研究根据NSP3基因序列特征,建立检测A群RV一步法逆转录微滴式数字聚合酶链式反应(reverse transcriptase droplet digital polymerase chain reaction,RT-ddPCR)方法,该方法不需要建立标准曲线可实现A群RV的精准定量,旨在为开展A群RV的流行病学调查及感染水平的定量分析提供新的技术手段和数据基础。
1 材料与方法
1.1 材料与试剂
蛏子、胡萝卜、生食蔬菜(生菜)、冷冻桑葚 市购。
A群RV阳性粪便样本(2003—2004年收集自北京儿童医院)均为本室分离、鉴定和保存;NoV(基因型GI、GII)、HAstV、甲肝病毒RNA由本实验室保存。
焦碳酸二乙酯(diethyl paracabonate,DEPC)处理水北京天根生化科技有限公司;Trizol、质粒载体pcDNAII、SuperScript®III Platinum®One-Step Quantitative RT-PCR System 美国Invitrogen公司;QIAamp Viral RNA Mini Kit 德国Qiagen公司;Dynabeads®mRNA Purification Kit 美国Life Technology公司;One-step RT-ddPCR advanced kit for probes 美国Bio-Rad公司。
1.2 仪器与设备
7900HT Fast RT-PCR仪、Veriti 96-Well Thermal Cycler 美国ABI公司; QX200 Droplet Digital PCR System 美国Bio-Rad公司;CP413电子天平 奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 A群RV RNA标准物质制备
应用QIAamp Viral RNA Mini Kit从A群RV阳性的生物粪便样品中提取RNA,采用针对A群RV NSP3基因的特异性引物ATG CTC AAG ATG GAG TCT ACTC/GGT CAC ATA ACG CCCC TAT AG扩增NSP3基因全长,长度1 049 bp。将该特定基因片段与pcDNAII连接构建重组质粒pcDNAII-RV,转化到Top10感受态细胞内,构建含有重组质粒的大肠杆菌,通过大肠杆菌的增殖,大量制备提取pcDNAII-RV;采用BamHI限制性内切酶将pcDNAIIRV单酶切;以酶切后的线性化pcDNAII-RV为模板,通过T7启动子体外转录合成获得A群RV NSP3基因RNA片段,经测序验证符合实验预期后,根据ISO指南35∶2006[15]要求,制备A群RV RNA标准物质,确定该标准物质的特性值为(5.8±1.5)×107拷贝/μL,置于-80 ℃保存备用。
1.3.2 引物探针设计和筛选
根据A群RV VP6和NSP3基因序列,通过NCBI在线工具进行序列分析和比对,利用Prime Express软件V4.0(ABI, Foster City, CA, USA)设计出4 组引物和探针组合,用提取的A群RV RNA和SuperScript®III Platinum®One-Step Quantitative RT-PCR System对设计的引物探针进行筛选。反应参数:50 ℃反转录15 min,95 ℃热启动2 min;95 ℃变性15 s,60 ℃退火及延伸1 min,40 个循环。
1.3.3 一步法RT-ddPCR验证筛选的引物探针的特异性
应用提取的A群RV RNA和NoV(基因型GI、GII)、HAstV、甲肝病毒等其他常见食源性病毒RNA进行一步法RT-ddPCR方法扩增,验证筛选的引物探针的特异性。参考One-step RT-ddPCR advanced kit for probes试剂盒说明书配制反应体系和生成微滴。将微滴置于Veriti 96-Well Thermal Cycler中按以下条件进行反应:60 ℃反转录30 min,95 ℃热启动5 min;94 ℃变性30 s,60 ℃退火延伸1 min,40 个循环;98 ℃酶灭活10 min;4 ℃ Hold。升降温速不低于2.5 ℃/s。反应结束后,用QX200微滴读取仪检测得到20 μL反应体系中RNA的拷贝浓度。按照下式计算模板RNA拷贝浓度:

1.3.4 一步法RT-ddPCR扩增温度优化
按One-step RT-ddPCR advanced kit for probes试剂盒说明书配制反应体系和进行一步法RT-ddPCR检测,以出现最高的阳性微滴簇为标准,对退火温度(52.5~62.5 ℃)进行优化。
1.3.5 A群RV一步法RT-ddPCR方法学考察
1.3.5.1 定量限和准确度分析
将制备的A群RV RNA标准物质分别按稀释倍数102、103、104、105、106、2×106、4×106和107稀释,每个稀释倍数各取2 μL作为模板,按One-step RT-ddPCR advanced kit for probes试剂盒说明书配制反应体系和进行一步法RT-ddPCR检测。每个梯度进行4 个重复检测,计算各检测梯度的相对偏差,确定各ddPCR检测方法的定量限,分析各ddPCR检测体系的检测值与理论值之间的关系,验证其检测准确度。
1.3.5.2 重复性和复现性分析
将制备的A群RV RNA标准物质10 倍梯度稀释,取高、低两个梯度各2 μL,按One-step RT-ddPCR advanced kit for probes试剂盒说明书配制反应体系和进行一步法RT-ddPCR检测。取3 个标准物质平行样品管进行稀释,每个样品每个梯度重复检测3 次,同时设置1 个空白对照(以DEPC水代替模板RNA)。每隔1 周复检1 次,连续监测3 次。计算组内变异系数和组间变异系数,分析检测方法的重复性和复现性。
1.3.6 不同食品基质中的A群RV一步法RT-ddPCR检测
采用本实验室保存的A群RV阳性粪便制备染毒样品。将该阳性粪便样品充分混匀后,表层、中层、底层3 个不同取样点吸取100 μL样品溶液,经Trizol充分提取RNA后,用建立的A群RV一步法RT-ddPCR方法检测,每个采样点重复检测5 次,采用单因素方差分析方法比较不同采样点的检测值,确定该阳性粪便样品中A群RV浓度,梯度稀释制备成从高到低4 个浓度A群RV染毒液。
1.3.6.1 食品样品类型及染毒
选取有代表性的4 种食品基质:贝类(蛏子)、硬表面食品(胡萝卜)、生食蔬菜(生菜)和软质水果(冷冻桑葚)。染毒前先检查牡蛎样品的外壳是否完整,提取消化腺后匀浆,分装为2 g/份;胡萝卜分装为若干份,生菜和冷冻桑葚分装为25 g/份。分别取各浓度染毒液100 μL加入分装好的蛏子消化腺,点涂到胡萝卜表面(点涂面积≤100 cm2),添加到分装好的生菜和冷冻桑葚表面,室温吸附30 min,每种食品类型的每个染毒梯度均添加3 个样品,每个样品重复检测3 次。
1.3.6.2 染毒样品前处理及核酸提取
参照欧盟CEN ISO/TS 15216:2013[16]对染毒的食品样品进行病毒洗脱和浓缩,然后采用Trizol提取病毒RNA溶于100 μL DEPC水,再进行一步法RT-ddPCR检测。
1.3.6.3 回收率计算
不同浓度染毒样品经前处理、核酸提取、一步法RT-ddPCR检测得到的检出值与染毒液中A群RV理论含量的比值即为回收率,当回收率高于1%时,认为人工染毒样品中模拟病毒的回收和提取有效。
1.4 统计分析
采用SPSS 17.0统计软件分析,组间均数比较采用t检验和F检验,检验水准α=0.05。
2 结果与分析
2.1 特异性引物探针
根据A群RV的VP6和NSP3基因序列,设计出4 组引物和探针组合。筛选结果表明:仅VP6-F2/R2/P2(序列未给出)未扩增出靶基因(图1)。特异性验证结果说明,扩增强度最大的NSP3-F1/R1/P1(序列见表1)特异性较好(图2),故选取该组引物探针建立A群RV一步法RT-ddPCR方法。
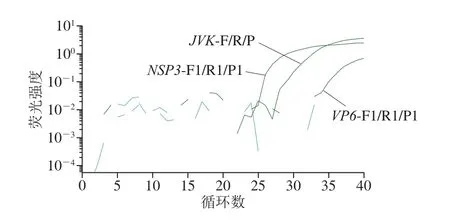
图1 荧光PCR方法筛选A群RV引物探针Fig. 1 Screening of primers and probes by fluorescence PCR method for RV group A strains
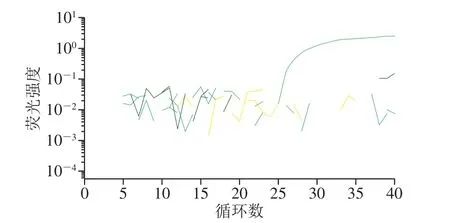
图2 荧光PCR方法验证NSP3-F1/R1/P1特异性Fig. 2 Speci ficity veri fication of NSP3-F1/R1/P1 by fluorescence PCR method
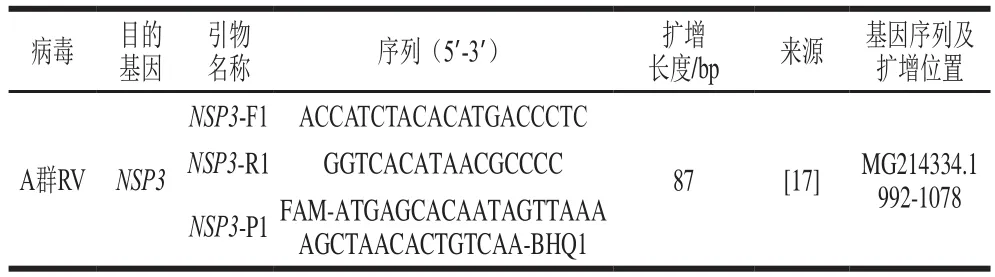
表1 一步法RT-ddPCR引物和探针序列Table 1 Primer and probe sequences used for RT-ddPCR
2.2 A群RV一步法RT-ddPCR检测方法的建立及退火温度优化
2.2.1 一步法RT-ddPCR检测方法
应用筛选的引物探针NSP3-F1/R1/P1,建立A群RV一步法RT-ddPCR检测方法。该法仅能检出A群RV RNA,出现阳性扩增的微滴,其余病毒RNA均呈阴性微滴,证明该检测方法具有良好的特异性(图3)。

图3 A群RV一步法RT-ddPCR体系特异性Fig. 3 Specificity of RT-ddPCR for assay of RV group A strains
2.2.2 退火温度的优化
退火温度55 ℃和60 ℃均可出现比较明显的阳性微滴簇,且在55 ℃扩增的荧光信号略高于60 ℃,因此,将55 ℃作为最佳退火温度(图4)。
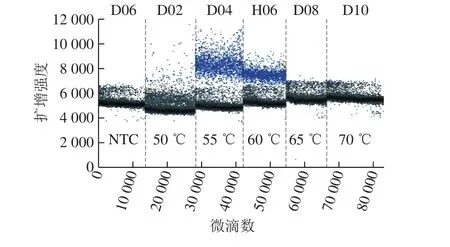
图4 A群RV一步法RT-ddPCR体系退火温度优化Fig. 4 Optimization of annealing temperature for RT-ddPCR assay of RV group A strains
2.3 A群RV一步法RT-ddPCR检测方法的定量限和准确度
将制备的A群RV RNA标准物质分别按稀释倍数102、103、104、105、106、2×106、4×106和107稀释,每个稀释倍数的理论浓度分别为580 000.00、58 000.00、5 800.00、580.00、58.00、29.00、14.50、5.80 拷贝/μL。结果表明,理论浓度为580 000.00 拷贝/μL的溶液超过了一步法RT-ddPCR的检测范围,其他稀释梯度的检测相对标准偏差(relative standard deviation,RSD)为3.6%~16.0%,且理论浓度与检测浓度之间呈线性关系,方程:Y=1.029X-11.444,R2=0.998 7,P<0.000 1,说明A群RV一步法RT-ddPCR检测方法可准确定量检测A群RV RNA浓度(表2,图5)。当A群RV RNA标准物质稀释至5 拷贝/μL左右时,理论值与检测体系检测的实际值仍然接近,4 次重复的RSD均小于25%,表明该检测体系定量限可达5 拷贝/μL。
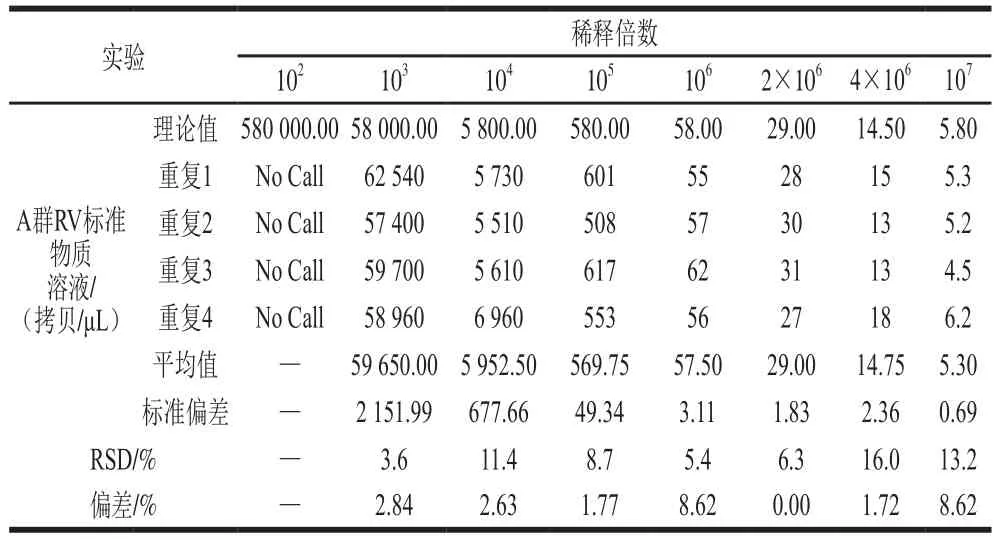
表2 A群RV一步法RT-ddPCR检测方法的定量限和准确度Table 2 Limit of quanti fication and accuracy of RT-ddPCR
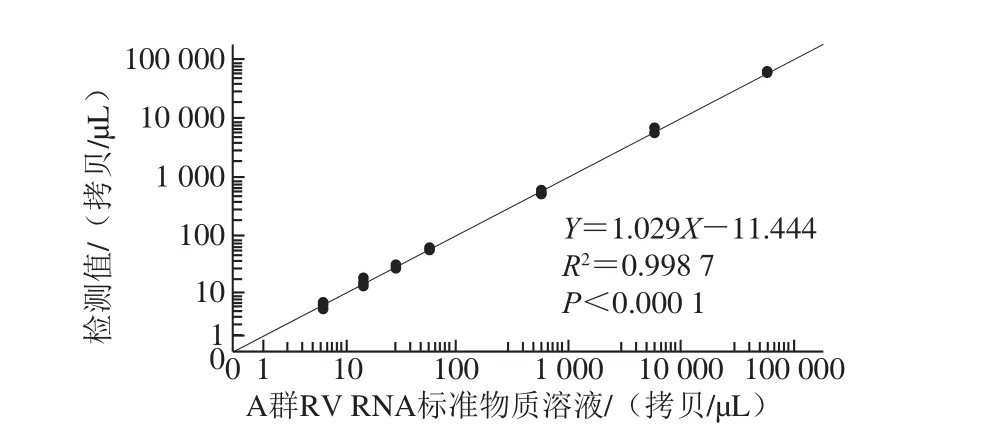
图5 A群RV一步法RT-ddPCR检测方法的线性关系Fig. 5 Linearity of RT-ddPCR
2.4 A群RV一步法RT-ddPCR检测方法的重复性和复现性
对于浓度5.8×103拷贝/μL,组内RSD为5.79%、6.27%和5.70%,与理论值的偏差分别为0.17%、0.43%和2.68%;浓度5.8 拷贝/μL,组内RSD分别为10.40%、12.09%和6.01%,与理论值的偏差分别为0.52%、5.86%和3.28%(表3)。单因素方差分析发现,2 个浓度的3 次重复检测值之间差异不显著(P>0.05),说明A群RV一步法RT-ddPCR检测方法具有良好的重复性和复现性。
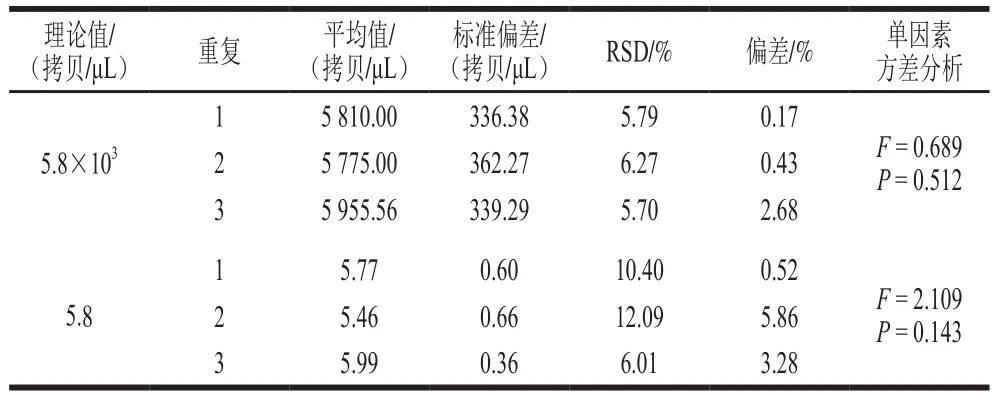
表3 A群RV一步法RT-ddPCR检测方法的重复性(n=9)Table 3 Repeatability of RT-ddPCR (n= 9)
2.5 A群RV阳性粪便样品一步法RT-ddPCR定量结果
不同取样部位的一步法RT-ddPCR检测平均值相近,单因素方差分析表明,差异没有统计学意义(P=0.122),Tukey多重比较分析发现,不同取样点定量结果之间没有显著差异(P>0.05),同一取样点的5 次重复取样检测RSD均小于15%(表4)。将不同采样点检测值的平均值作为A群RV阳性粪便样品的浓度,为1.579×1 06拷贝/μ L,染毒液浓度分别为1.5 7 9×1 04、1.579×103、1.579×102拷贝/μL和1.579×101拷贝/μL。
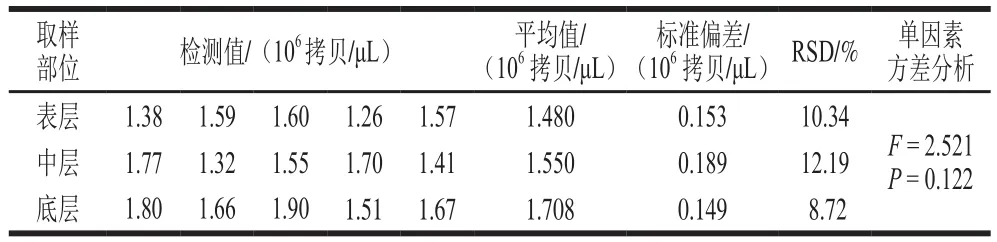
表4 A群RV阳性粪便样品一步法RT-ddPCR定量检测结果Table 4 Quantitative results of RV group A strains in positive fecal samples by RT-ddPCR
2.6 不同食品基质中A群RV一步法RT-ddPCR检测结果
分别以蛏子、胡萝卜、生菜和冷冻桑葚为代表的4 种食品基质(贝类消化腺、硬表面食品、生食蔬菜和软质水果)的回收率分别为27.82%~53.82%、23.08%~38.27%、2.37%~7.63%和1.15%~2.73%。单因素方差分析结果表明,各染毒量中不同食品基质的A群RV检出量和回收率差异显著(P<0.001),蛏子和胡萝卜的检出量和回收率明显高于生菜和冷冻桑葚。冷冻桑葚中各染毒量的回收率均小于3%,而当实际染毒量为1 579 拷贝时,从生菜和冷冻桑葚染毒样品检出量的RSD大于25%,有的染毒样品不能检出A群RV RNA,说明提取的RNA溶液浓度低于一步法RT-ddPCR的检测限(表5)。进一步进行Tukey多重比较发现,各染毒剂量下,不同食品基质之间差异均有统计学意义上的显著性(P<0.05)。
3 讨 论
dPCR可将PCR扩增产生的荧光信号由经典指数形式转换为单分子信号,将检测灵敏度提高到单分子水平[18-19]。目前,ddPCR是常见的dPCR系统之一,采用油包水的方式分割PCR体系为微滴,PCR后,微滴逐一通过检测器,有荧光信号的微滴记为“1”(存在PCR扩增产物),无荧光信号的微滴记为“0”(不存在PCR扩增产物),从而产生“数字”的概念[20-21]。按照泊松分布原理,根据阳性微滴的数量,计算反应体系内的模板拷贝数浓度,实现核酸的精准定量[21-24]。因此,ddPCR不依赖标准曲线和扩增循环阈值,可直接定量检测核酸,属于终点检测,某些程度上,扩增不会造成定量的偏倚,对PCR抑制剂更为耐受,在改善定量分析准确性和变异性上有较大优势[25-26]。本研究发现,A群RV一步法RT-ddPCR定量检测值与标准物质溶液理论浓度相符,相关系数为0.998 7,定量范围包括104~100拷贝/μL 5 个数量级,定量限可达5 拷贝/μL,检测方法具有良好的重复性和复现性。
不同的食品基质A群RV的污染方式不同[27]:贝类通过滤食将水体中的A群RV浓缩到消化腺内,水果(包括硬表面水果和软质水果)和生食蔬菜等通过浇灌含有A群RV的肥料和灌溉水被污染;此外,食品中蛋白质、多糖等某些大分子物质,能直接影响病毒洗脱、RNA提取及分子检测过程,影响定量检测结果,因此不同的食品基质需要采用针对性的前处理方法以洗脱和浓缩病毒颗粒。本研究参照欧盟的CEN ISO/TS 15216:2013[16]对染毒的食品样品进行洗脱和浓缩。通过计算检出量和回收率发现,不同食品基质中存在显著差异(P<0.001),且蛏子和胡萝卜明显高于生菜和冷冻桑葚,而低染毒量时,部分生菜和冷冻桑葚染毒样品未检出A群RV RNA,说明食品基质对A群RV一步法RT-ddPCR定量检测量有较大影响。
贝类中病毒洗脱和浓缩主要通过将贝类消化腺撕裂后,采用蛋白酶K和65 ℃高温处理相结合的方法破坏消化腺组织,释放病毒颗粒[28],再超速离心浓缩病毒颗粒,直接提取RNA。该方法已成功在0.15 g牡蛎消化组织中检测出诺如病毒[29-30],相对于采用异硫氰酸酯/苯酚为主的试剂直接提取食品中的食源性病毒RNA方法回收率更高[31-32]。洗脱液的pH值对软质水果与生食蔬菜中食源性病毒颗粒的洗脱效果影响比较大,通常采用碱性缓冲液(pH≥9)洗脱此类食品表面的食源性病毒[33]。同时采用牛肉膏和甘氨酸减少病毒颗粒对食品基质的非特异性吸附,可分别使此类样品中的食源性病毒回收率提高数倍[34]。草莓、桑葚等软质水果含有的果胶会影响洗脱效果,需要采用果胶酶破坏这些果胶分子,保证这类软质水果的洗脱效率。硬表面食品的范围可包括坚果、苹果、胡萝卜等多种食品类型,它们的共同点是表面比较坚硬,可通过棉拭子擦拭法将食品表面吸附的病毒颗粒擦拭下来,操作简便,具有相当的回收率。
定量食品中的A群RV需要将病毒与食品基质分离、浓缩,得到病毒悬液,提取RNA后,用A群RV一步法RT-ddPCR进行检测。在不考虑病毒分离、浓缩效率和RNA核酸提取效率时,本研究建立的A群RV一步法RT-ddPCR定量检测方法的检测限可达到5 拷贝/μL。但病毒浓缩、RNA提取的过程中存在回收率和RNA提取效率未知等不确定因素,很难检测到食品中可能存在的全部病毒核酸,因此利用一步法RT-ddPCR方法检测的病毒核酸含量不等于实际样品中食源性病毒的实际载量。后续研究中,需要建立一种简便可操作性强的过程控制程序监控病毒浓缩、核酸提取过程,反映实际样品中A群RV回收率,并且通过回收率计算样品中A群RV的实际载量。
