PSMB8在人绒毛膜滋养层细胞中对细胞凋亡和自噬的影响
2020-07-03栾晓瑾颜一丹陈万银郑倩雯
栾晓瑾 颜一丹 陈 霞 王 敏 陈万银 郑倩雯 谢 冰 于 骏 方 杰
稽留流产是指胚胎停止发育后仍滞留于宫腔内无法自行排出,是早期妊娠的并发症之一[1]。近年来稽留流产发生率逐渐攀升,高达15%~20%[2]。稽留流产的发病机制尚不明确,其病因主要涉及染色体异常、感染和自身免疫性疾病、内分泌失调等方面[3]。稽留流产严重威胁了女性的健康,死亡的胚胎及病变的胎盘组织滞留于宫腔中释放凝血活酶,易引发凝血功能紊乱[4]。清宫所导致的子宫内膜损伤会诱发宫腔粘连及不孕,给患者带来巨大的心理伤害,故探索稽留流产的发病机制显得尤为重要。
胎盘是在母体系统和胎儿系统之间运输营养物质、呼吸气体和废物的重要器官。胎盘的早期发育依赖于囊胚腔外围的绒毛滋养细胞对子宫内膜的植入和侵袭[5]。有证据表明,稽留流产患者绒毛和蜕膜组织中凋亡及自噬的相关蛋白均有异常表达。肝素结合表皮生长因子(HB-EGF)和叉头转录因子3α(FOXO3α)在稽留流产患者绒毛及蜕膜组织中均表达上调,提示滋养细胞凋亡受到抑制,导致宫腔内的死胎无法及时排除[6,7]。自噬过程关键因子Beclin-1蛋白、LC3Ⅱ/LC3Ⅰ比值在稽留流产患者绒毛及蜕膜组织中均上调,提示滋养细胞自噬增强参与了稽留流产的发生[8]。然而,由于滋养细胞凋亡和自噬功能异常而导致稽留流产发病的具体机制尚未明确。有研究者对稽留流产患者和正常妊娠女性绒毛组织进行蛋白质组学研究和生物信息学分析,得到了51个差异表达的蛋白,其中免疫蛋白酶体亚基PSMB8(proteasome subunit beta 8)差异有统计学意义(FC=1.37,P<0.05),可能是诱导稽留流产发生、发展的关键因子[9]。
PSMB8,又称大型多功能蛋白酶7(large multifunctional protease 7,LMP7),编码蛋白酶体的β5i亚基[10]。细胞内普遍存在的蛋白酶体是26S标准型蛋白酶体,由一个核心的20S蛋白酶体和两个具有调节作用的19S蛋白酶体组成,水解大多数蛋白质[11]。当受到氧化应激、炎性反应等刺激诱导时,20S蛋白酶体的β1、β2、β5亚基可相应被β1i、β2i、β5i取代,并且与两个11S调节亚基PA28组装成免疫型蛋白酶体,增强蛋白酶体与主要组织相容性抗原(MHC-1)相结合多肽的能力[12]。对于清除细胞内有害的蛋白质,维持细胞稳态具有重要作用。研究表明,PSMB8对免疫型蛋白酶体的加工极为重要,它是β1i 和β2i 前肽翻译后加工必不可少的[13]。目前,尚未有文献报道其在稽留流产中的作用。本研究旨在探讨PSMB8对人绒毛膜滋养细胞HTR-8/Svneo(简称HTR-8)凋亡及自噬能力的影响,初步探讨PSMB8导致稽留流产可能的机制,以期为稽留流产发病机制的研究提供新的思路。
材料与方法
1.材料与试剂:HTR-8细胞系购自美国ATCC细胞库、1640培养液及Opti-Mem培养液购自美国Gibco公司,胎牛血清及胰酶购自以色列Bioind公司,Oligo-fectamineTM 2000试剂购自美国Invitrogen公司,PSMB8 siRNA质粒及NC siRNA质粒设计并购自中国吉玛基因公司,TUNEL凋亡细胞检测试剂盒及CCK-8细胞增殖试剂盒购自中国诺唯赞公司,Annexin Ⅴ Alexa Flμor647/PI凋亡检测试剂盒购自中国福麦斯生物有限公司,caspase-3(cleaved)及LC3一抗购自美国Cell Signaling Technology公司,488标记抗兔IgG(H+L)荧光二抗购自美国Jackson公司,反转录试剂盒及qRT-PCR用SYBRGreen染料购自日本TaKaRa公司,qRT-PCR引物购自中国生工生物公司,Real-timePCR仪QuantStudio®5购自美国Thermo公司,荧光显微镜购自日本Olympus公司。
2.细胞培养:HTR-8细胞采用含10%胎牛血清、青霉素(100nmol/ml)、链霉素(100μmol/ml)的1640培养基,在37℃、含有5%CO2培养箱内进行孵育,细胞呈贴壁生长。
3.PSMB8基因沉默处理:将HTR-8细胞按1.5×105个细胞/毫升接种于6孔板,待细胞生长至80%进行转染,操作按脂质体Oligo-fectamineTM 2000试剂说明书进行。分别用Opti-MEM培养基稀释不同体积的siRNA和转染试剂,设置25、50、100 nmol/L浓度进行转染。每次转染均设对照组,转染无义空白链(NC) siRNA。转染6h后换为完全培养基,48h后行qRT-PCR观察结果以筛选出干涉效率较高的siRNA序列进行后续实验。siRNA信息描述详见表1。

表1 siRNA序列
4.CCK8检测细胞增殖:将HTR-8细胞用不含EDTA的胰酶消化后接种于96孔板中,每孔细胞数为2.5×103个,待细胞贴壁后按材料与方法3进行细胞转染,分别于转染后0、24、48h这3个时间点加入10μl CCK-8溶液并置于孵箱内避光孵育1h,用酶标仪测定450nm处吸光度值,每个样本做3个副孔。
5.TUNEL法检测细胞凋亡:将转染24h后的HTR-8细胞,接种于放置有圆形玻片的24孔板内,继续培养24h后进行TUNEL检测。根据试剂盒操作说明进行试验操作,于荧光显微镜下观察细胞凋亡数并拍照。用Image J记录凋亡细胞数,根据凋亡细胞数对结果进行统计分析。
6.流式细胞术分析细胞凋亡情况:用不含EDTA的胰酶收集6孔板中转染24h后的细胞,4℃预冷的PBS洗细胞2次后,用300μl结合缓冲液重悬,调节其浓度为1×106/ml,每管加入2.5μl Annexin Ⅴ/Alexa Flμor 647 和5μl PI溶液染色,室温避光孵育15min后用流式细胞仪进行分析。该实验重复3次。
7.免疫荧光检测caspase-3 (cleaved)和LC3蛋白的表达:将转染24h后的HTR-8细胞,接种于放置有圆形玻片的24孔板内,继续培养24h后进行免疫荧光实验。用4%多聚甲醛固定20min,用含0.1% 聚乙二醇辛基苯基醚(TritonX-100)的PBS清洗3次,每次10min,用5%的牛血清白蛋白(bovine serum albumin,BSA)封闭30min,分别加入caspase-3(cleaved)和LC3一抗于室温孵育1h后再用含0.1% TritonX-100的PBS清洗3遍。再用二抗于室温孵育1h,最后用含0.1% TritonX-100的PBS清洗,去除多余的二抗,用100μl 1.0mg/ml的Hoechst33342染DNA 15min后,用防荧光淬灭剂封片。HTR-8细胞免疫荧光图片通过荧光显微镜采集,每幅图像取3个不同视野,并根据阳性细胞率进行分析。
8.qRT-PCR检测PSMB8及自噬相关基因mRNA表达水平:将培养48h的两组HTR-8细胞采用TRIzol法提取总RNA,紫外分光光度计测量RNA浓度。采用反转录试剂盒合成cDNA。SYBR荧光染料、cDNA、引物用来配制PCR反应体系。反应条件为95℃预变性2min;95℃变性15s,60℃退火20s,共40个循环。Ct值应用2-ΔΔCt方法处理,每个基因的相对表达量按照内参的表达量进行标准化处理。每个样本有3个副孔,该实验重复3次。详细的引物序列见表2。
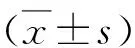
结 果
1.PSMB8 siRNA干涉效率验证:与对照组比较,各siRNA转染组PSMB8 mRNA相对表达水平均有不同程度的下调,在100nmol/L siRNA的浓度下,PSMB8 siRNA-1的转染效率最高,可下调约70%。因此,本研究选择在HTR-8细胞中转染100nmol/L PSMB8 siRNA-1进行后续的功能研究实验(图1A)。

表2 qRT-PCR引物
2.PSMB8 siRNA抑制HTR-8细胞增殖:在HTR-8细胞内沉默PSMB8基因后,与对照组比较,PSMB8 siRNA-1组细胞增殖能力减弱,两组细胞450nm处吸光度值24h及48h之间的差异均有统计学意义(P<0.05,图1B)。
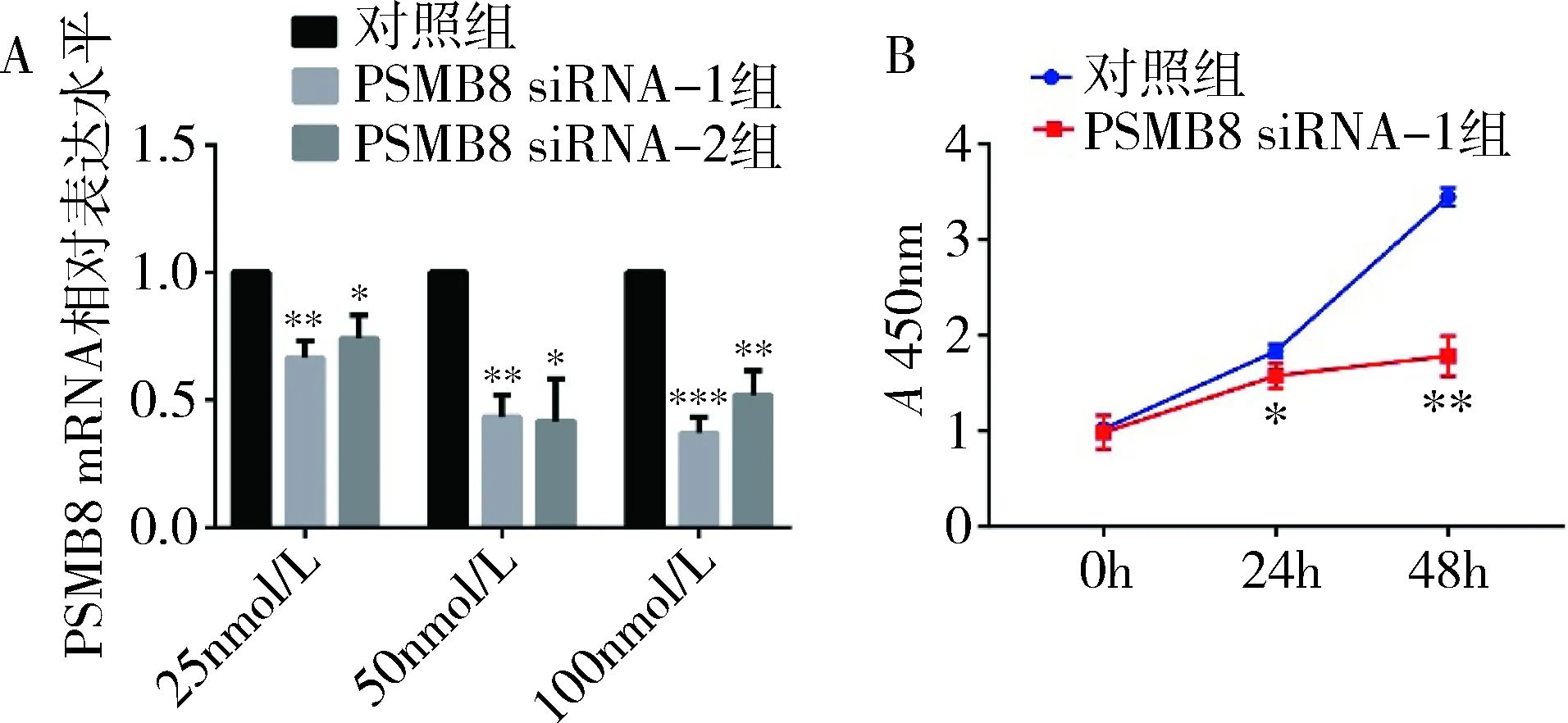
图1 PSMB8 siRNA干涉效率验证及对HTR-8细胞增殖的影响A.对照组和PSMB8 siRNA组细胞中PSMB8 mRNA的相对表达水平;B.PSMB8表达下调对细胞增殖能力的影响;与对照组比较,*P<0.05,**P<0.01,***P=0.000
3.PSMB8 siRNA促进HTR-8细胞凋亡:TUNEL法检测PSMB8 siRNA对HTR-8细胞凋亡效应的影响,与对照组比较,PSMB8 siRNA-1组的TUNEL阳性细胞比例增多(15.05±2.62 vs 33.40±2.44,P=0.000,图2A、图2C)。使用免疫荧光染色检测细胞内凋亡关键蛋白caspase-3(cleaved)表达情况,与对照组比较,PSMB8 siRNA-1组中caspase-3(cleaved)蛋白阳性细胞比例增多(21.70±5.87 vs 53.29±10.29,P<0.01,图2B、图2D)。应用流式细胞术检测细胞凋亡,与对照组比较,PSMB8 siRNA-1组中存活细胞明显减少(89.10±0.78 vs 77.00±1.68,P=0.000),早期凋亡和晚期凋亡细胞所占比例增高(9.09±0.65 vs 10.71±0.61,P<0.05),坏死细胞所占比例也增高(2.49±0.73 vs 12.49±2.02,P<0.01,图3)。
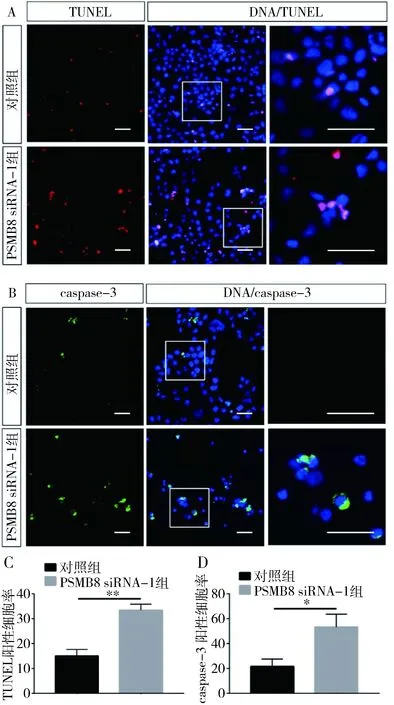
图2 PSMB8 siRNA导致HTR-8细胞内凋亡细胞增多A.对照组和PSMB8 siRNA-1组进行TUNEL检测(×400),TUNEL(红色),DNA(蓝色),标尺50μm; B.对照组和PSMB8 siRNA-1组进行免疫荧光染色(×400),caspase-3(cleaved)(绿色),DNA(蓝色),标尺50μm; C.对照组和PSMB8 siRNA-1组中TUNEL阳性细胞率柱状图;D.对照组和PSMB8 siRNA-1组中caspase-3(cleaved)阳性细胞率柱状图; *P<0.01,**P=0.000
图3 流式检测PSMB8 siRNA对HTR-8细胞凋亡的影响A.对照组和PSMB8 siRNA-1组流式细胞术检测凋亡分布情况;B.细胞凋亡情况数据统计柱状图; *P<0.05,**P<0.01,***P=0.000
4.PSMB8 siRNA诱导HTR-8细胞自噬:使用免疫荧光染色检测细胞内自噬标志蛋白LC3的表达情况,与对照组比较,PSMB8 siRNA-1组中产生LC3蛋白荧光的细胞数量增加(19.02±3.78 vs 31.90±4.87,P<0.05)。qRT-PCR检测自噬相关基因ULK1、Atg14、Atg5、Atg12、Atg3、Atg7 mRNA转录水平,与对照组比较,PSMB8 siRNA-1组中各基因mRNA表达均上调,且差异有统计学意义(P<0.05,图4)。
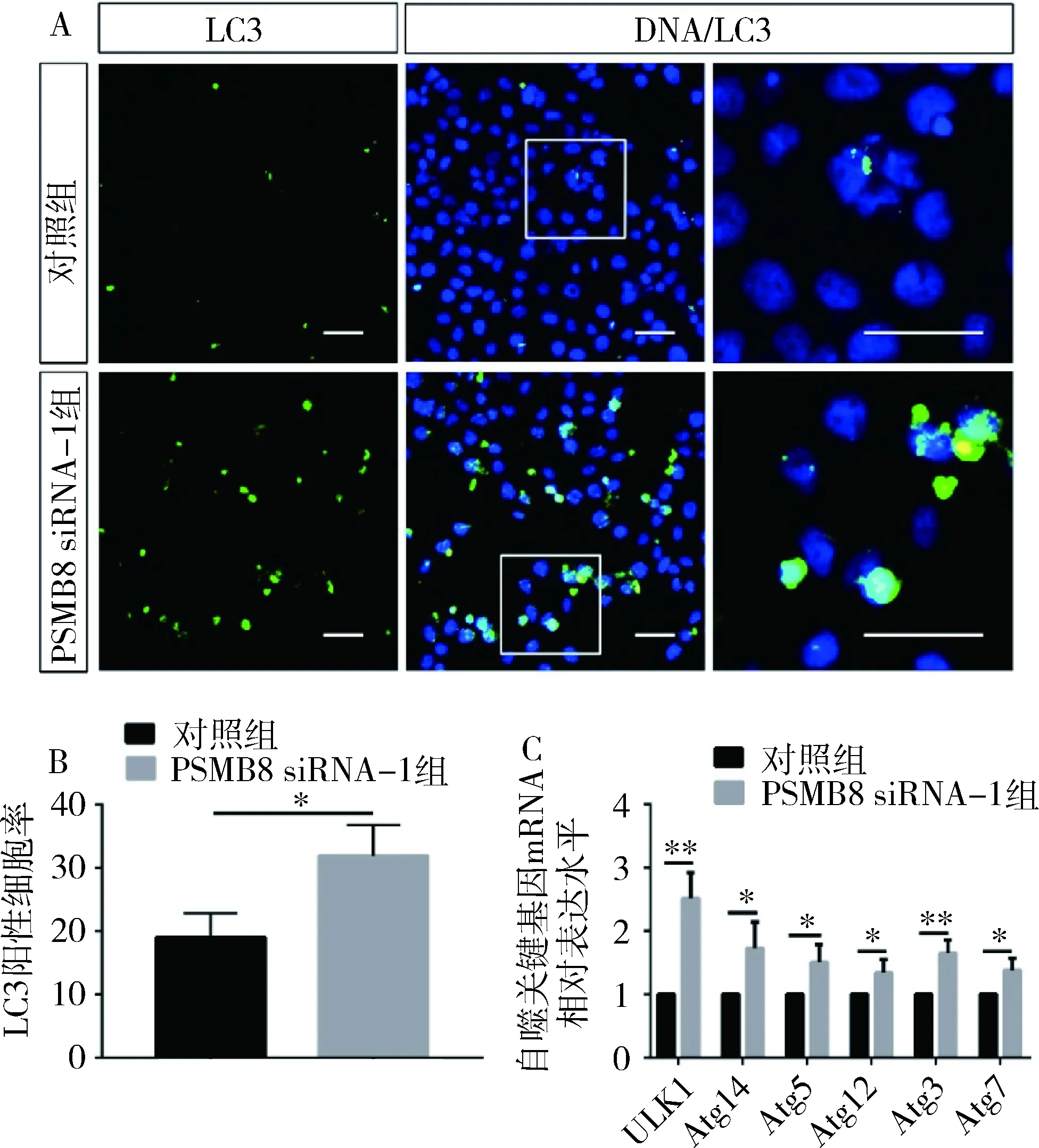
图4 PSMB8 siRNA导致HTR-8细胞内自噬水平增强A.对照组和PSMB8 siRNA-1组进行免疫荧光染色(×400),LC3(绿色),DNA(蓝色),标尺50μm; B.对照组和PSMB8 siRNA-1组中LC3阳性细胞率柱状图; C.对照组和PSMB8 siRNA-1组中自噬相关基因mRNA相对表达水平柱状图; *P<0.05,**P<0.01
讨 论
滋养细胞在多种机制的共同作用下调控其增殖、凋亡、分化及血管重塑等功能,以确保胚胎的正常发育。滋养细胞功能障碍将导致多种不良妊娠结局的发生,如流产、胎儿生长受限、早产等。稽留流产是自然流产的一种特殊类型,其发病机制仍需进一步阐明。PSMB8是在稽留流产绒毛组织的蛋白质组学谱系中被鉴定到差异蛋白之一,与绒毛滋养细胞的功能关系密切,但其功能尚不明确。本研究以HTR-8为研究对象,旨在研究PSMB8对HTR-8细胞凋亡及自噬的影响,了解PSMB8在HTR-8细胞凋亡及自噬过程中产生的作用。
PSMB8作为免疫型蛋白酶体的关键亚基,已被证实具有影响细胞凋亡的能力。比如,PSMB8通过介导ERK1/2和PI3K/AKT信号通路调控胶质瘤细胞的凋亡、迁移和侵袭,在多发性骨髓瘤细胞中加入PSMB8靶向抑制剂后导致细胞增殖减少,凋亡增加[14,15]。本研究在HTR-8细胞中沉默PSMB8基因后,CCK8、流式细胞术及TUNEL检测法的结果一致表明HTR-8细胞凋亡水平明显增高,说明PSMB8对滋养细胞的凋亡功能产生了影响。半胱氨酸蛋白酶(caspase)家族是直接导致细胞凋亡分解的蛋白酶系统,其中caspase-3参与了两条触发凋亡的主要通路,分别是细胞膜死亡受体介导的外源性凋亡途径和线粒体介导的内源性凋亡途径,在细胞凋亡过程中占据重要地位[16]。正常情况下,caspase-3以无活性的酶原状态存在,在相应酶切位点之间进行剪切后产生有活性的caspase-3(cleaved),介导凋亡的发生。免疫荧光结果显示,敲减PSMB8后caspase-3(cleaved)蛋白比率明显上升,表明PSMB8 siRNA可能是通过激活细胞内凋亡关键调控蛋白caspase-3,引发多种凋亡途径,从而诱导滋养细胞的凋亡。
自噬-溶酶体途径(autophagy-lysosome pathway,ALP)是不同于凋亡的一种程序性死亡方式。它是指胞质内双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体,并与溶酶体融合形成自噬溶酶体,降解其所包裹内容物的过程,需要Atg家族及多种蛋白因子的参与[17]。Agt1(ULK1)、Agt14参与了自噬体的形成,Atg5-Atg12复合物和微管相关蛋白1轻链3 (microtubule- associated protein1 light chain 3,LC3)对于自噬体的延伸和成熟极为重要。LC3包括两种可相互转化的形式LC3Ⅰ和LC3Ⅱ,当自噬被诱导后LC3Ⅰ在Atg3、Atg7等因子的作用下转化为LC3Ⅱ与自噬体膜结合[18]。本研究中,PSMB8表达下降后,免疫荧光检测自噬标志LC3阳性率明显增高并且自噬相关基因ULK1、Agt14、Atg5、Atg12、Atg3、Atg7 mRNA表达水平均上调,提示PSMB8 siRNA通过诱导自噬体形成和延伸阶段来增强细胞的自噬水平。
研究显示自噬与凋亡的关系十分复杂,一方面自噬可以通过降解促凋亡蛋白来抑制细胞凋亡[19];另一方面,当细胞自噬过度激活后将会活化线粒体中的前凋亡因子来诱导凋亡的发生[20]。因此,除了PSMB8表达下调对HTR-8细胞凋亡的直接诱导作用之外,沉默PSMB8后细胞内高水平的自噬也可能是诱导细胞凋亡的机制之一。
细胞内蛋白质的降解主要通过两种途径,包括ALP和泛素-蛋白酶体系统(ubiquitin-proteasome pathway,UPP)。UPP是一种广泛存在于真核细胞内的依赖ATP 的非溶酶体降解途径,能够快速地降解一些错误折叠的和短暂控制基本细胞生命活动的调节蛋白,来维持细胞的正常生物学功能[21]。越来越多的证据表明ALP和UPP相互影响,当UPP功能受损时,未折叠的蛋白质积累,从而诱导自噬水平代偿性增高。在经过乙醇处理后的大脑皮质中,免疫蛋白酶体被诱导活化,标准型蛋白酶体亚基表达下降,大量泛素化的蛋白质无法分解,同时导致ALP受到抑制并且自噬体的体积发生变化。因此,沉默PSMB8后导致蛋白酶体功能受损,诱导HTR-8细胞内自噬水平补偿性上升,可能是细胞内自噬水平增强的机制,但是仍需要更深入的研究进行解释。
综上所述,本研究结果表明在HTR-8细胞内下调PSMB8的表达可以诱导滋养细胞凋亡并且激活自噬,初步发现PSMB8参与稽留流产发生、发展的作用机制,为进一步研究稽留流产发病机制提供新的思路。
