玉米秸秆生物炭对沉积物中BDE-47生态毒性的影响
2020-07-02向静米盈田斌龚双姣马陶武
向静,米盈,田斌,龚双姣,马陶武
吉首大学生物资源与环境科学学院,吉首 416000
作为水体中各种污染物沉积库的沉积物是潜在的二次污染源[1],而受到持久性有机污染物污染的沉积物对水生生物和人类健康具有很大的生态与健康风险。采用低能耗、高效率和对环境干扰小的修复技术对污染沉积物进行原位修复是维持水生态系统健康的重要手段。通常,对污染沉积物修复的主要目标是最大程度地降低污染物的生物有效性和生态毒性。研究证实,黑炭颗粒可以强烈地吸附与沉积物结合的污染物,从而降低污染物的生物有效性、减少生物积累和生态毒性[2-3]。
生物炭是一种重要的新型碳材料,目前被认为是一种重要的绿色环境吸附剂,在环境修复中发挥重要的作用[4],因此,将生物炭应用于污染沉积物的原位修复具有很大的潜力[5-9]。关于生物炭对水土环境中污染物阻控的研究主要关注污染物的生物有效性[10-11],但在判断生物炭对污染沉积物的修复效力时仅依据污染物生物有效性的变化往往是不够的,必须同时结合生物效应进行综合评判,因为污染物的生态毒性风险只有通过生物效应才能得以体现。目前,关于生物炭对污染物生态毒性风险影响的评价研究尚较少报道[12-13]。铜锈环棱螺(Bellamyaaeruginosa)是属于腹足纲田螺科的淡水软体动物,在我国淡水环境中广泛分布,是一种典型的沉积物栖居型底栖动物,该物种对一些典型重金属和持久性有机污染物表现出较好的敏感性,是进行沉积物毒性测试的理想生物[14-15]。
多溴联苯醚(PBDEs)是典型的持久性有机污染物,PBDEs主要用作阻燃剂,在众多的PBDEs同系物中,2,2’,4,4’-四溴联苯醚(BDE-47)约占PBDEs总量的70%,也是毒性最强的[16]。PBDEs具有高脂溶性,在沉积物中的浓度通常高于水相。例如,我国珠江沉积物中PBDEs的浓度为12.7~7 361 ng·g-1,水相中浓度为108~5 788 ng·L-1 [17]。
本研究以玉米秸秆制备的生物炭(corn straw biochar, CSB)为研究对象,以BDE-47为目标污染物,以铜锈环棱螺为测试生物,采用28 d沉积物生物测试的方法,研究在BDE-47加标沉积物中添加不同比例CSB的情况下,BDE-47在铜锈环棱螺体内的生物积累、对其肝胰脏细胞DNA损伤以及螺体内氧化胁迫关键生物标志物(活性氧(ROS)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)和丙二醛(MDA)随时间的动态变化,考察CSB自身的毒性和CSB对沉积物中BDE-47生态毒性控制的效果。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
主要仪器:真空气氛炉(GR.TF 80/11,上海贵尔机械设备有限公司);比表面及孔径分析仪(美国麦克三站全功能型多用吸附仪3Flex,美国麦克仪器公司);热场发射扫描电子显微镜(Quanta 400 FEG,美国FEI公司);气相色谱-质谱联用仪(GC/MS-QP2010 plus,日本Shimadzu仪器公司);荧光显微镜(ECLIPSE 80i,日本尼康公司);多功能酶标仪(DTX-880,美国Beckman Coulter公司);台式高速冷冻离心机(TGL-16M,长沙平凡仪器仪表有限公司);水平电泳仪(DYY-12型,北京六一仪器厂);旋转蒸发仪(KE-2000E,上海亚荣仪器有限公司);玻璃匀浆器;玻璃层析柱。
主要试剂:2,2’,4,4’-四溴联苯醚(BDE-47),分子式C12H6Br4O,CAS# 5436-43-1,纯度98.5%,BDE-47标样(50 μg·mL-1)购自AccuStandard公司;定量内标13C12-PCB138(40 μg·mL-1)购自美国剑桥同位素实验室;正壬烷、异辛烷购自上海阿拉丁生化科技公司,均为GCS级;蔗糖、Tris、EDTA-2Na、2,4-二硝基苯肼(DNPH)和盐酸胍为国产分析纯;正己烷、二氯甲烷、丙酮和甲醇为国产农药残留级。
1.2 试验材料
1.2.1 测试生物
采用实验室人工培养的铜锈环棱螺作为测试生物[13],选取个体大小一致的健康成体,壳长为(18.10±1.14) mm,体重为(1.56±0.15) g,用于沉积物暴露测试。
1.2.2 沉积物
实验所用沉积物来自湖南吉首市德夯自然保护区,采集与处理方法见Ma等[14]的报道。
1.2.3 玉米秸秆生物炭制备与表征
CSB采用高纯氩气保护炭化法进行制备。先将玉米秸秆置于烘箱中烘干,粉碎后装填在管式真空气氛炉的石英炉管中。炭化前,先对炉管抽真空,然后通入高纯氩气,重复3次后,持续通入氩气,待管内压力高于1.5个标准大气压后,打开排气口,控制出气量,使管内压力在整个炭化过程中不低于1个标准大气压。根据预实验结果设定炭化温度为500 ℃,炭化时间为8 h。将所制得的生物炭用去离子水反复淋洗至浸出水呈中性,然后于85 ℃烘干至恒重,取出研磨,过150 μm尼龙筛,保存备用。经分析,在生物炭样品中未检测到BDE-47。对测试用生物炭样品采用比表面及孔径分析仪测定其比表面积、平均吸附孔径和外部表面积等表面参数,同时采用热场发射扫描电子显微镜(SEM)进行表征。
1.3 沉积物生物测试
根据我国水体沉积物中BDE-47的环境相关水平设定BDE-47的实验加标浓度为500 ng·g-1干重[17]。将生物炭设置3个添加水平(w/w):1%、4%和7%。实验共设8个处理组(表1),用于测试CSB自身的毒性(处理1~4)和CSB与BDE-47联合暴露的毒性(处理5~8),每个处理组设3个重复。

表1 实验设计Table 1 Experimental set-up
注:CSB表示以玉米秸秆制备的生物炭;-表示无添加。
Note: CSB stands for corn straw biochar; - means no addition.
参考王萌等[18]的方法对沉积物进行加标处理。首先为每个处理组称取2 100 g干沉积物(预先过150 μm尼龙筛),按上述实验设计加入相应质量的CSB到每个处理组的沉积物中,然后分别倒入搅拌机中连续搅拌至少1 h,转入塑料小桶中。按沉积物和去离子水1∶1的体积比加入去离子水,充分搅拌至混合均匀。用二甲基亚砜(DMSO)配制浓度为5 mg·mL-1的BDE-47储备液,在需要添加BDE-47的处理组加入相应质量的BDE-47储备液。每隔3 h用洁净小木铲搅拌一次,一次持续1 h,24 h后完成搅拌。加标沉积物在室温下静置14 d,在存贮期间,每隔3 d再充分搅拌一次,使加标沉积物达到理化平衡[19]。将每组处理好的沉积物均分到3个重复测试缸(4 L)中,按沉积物与上覆水1∶4的体积比加入去离子水,然后将所有测试缸置于一个水浴控温水槽中,静置3 d。暴露开始时,将所选实验螺随机分组,放入每个测试缸中,每个测试缸15只,每个处理组共有实验螺45只,保持光照周期为12 h(白昼)∶12 h(黑暗),水温(24±1) ℃,以静水充气的方式暴露28 d,对每个测试缸加盖尼龙网,中间留一个直径为5 cm的圆孔,方便喂食。按每只螺每天5 mg的量投喂食料[14]。在整个暴露期间,每个测试缸中实验螺的存活率都在90%以上,符合沉积物毒性测试标准要求。在暴露7、14、21和28 d时取样,分3批进行,首先从每个处理组中取实验螺3只,清洗干净,用钳子夹破螺尖,取出肝胰脏,立即进行DNA损伤测定;然后再从每个处理组中取实验螺3只,分离出肝胰脏置于液氮中速冻保存用于生化测定;最后从每个处理组中取实验螺3只放入装有去离子水的洁净玻璃缸中清肠24 h(以消除肠道中存留的BDE-47对BDE-47生物积累的影响),然后分离出全部的内脏团,保存于-20 ℃冰箱中,用于BDE-47的分析。在暴露实验开始前,对未经暴露的螺进行同样的取样处理和测定。此外,在暴露7、14、21和28 d时,对每个测试缸进行沉积物取样(50 g),于2 500 r·min-1离心,过滤,用于测定沉积物间隙水中BDE-47的浓度。
1.4 DNA损伤测定
采用彗星实验法(comet assay)[20]检测肝胰脏细胞DNA损伤的程度,按照Ma等[21]建立的操作方法进行DNA损伤测定,用荧光显微镜进行彗星图像采集,采用CASP软件进行图像数据分析,获取Olive尾距(Olive tail moment, OTM),OTM为彗星头部重心与尾部重心间距离与彗尾DNA含量的乘积,对每个处理组检测3个样本,每个样本观察1张载玻片,取50个细胞数据的中位数作为DNA损伤测定值。
1.5 生化测定
1.5.1 ROS的测定
利用荧光探针DCFH-DA对新鲜肝胰脏中ROS的含量进行测定。将肝胰脏组织和100 mmol·L-1的磷酸缓冲液(PBS)按质量(g)体积(mL)比1∶20的比例加入到玻璃匀浆器中,冰浴下制成匀浆,然后转入0.5 mL离心管,于4 ℃、1 200 r·min-1,离心10 min。先取190 μL上清液加入到黑底酶标板中,加入10 μL 1 mmol·L-1的DCFC-DA荧光探针;再取190 μL上清液加入到另一黑底酶标板中,加入10 μL PBS,吹打均匀后,于37 ℃孵育30 min,在多功能酶标仪上测定荧光强度(激发波长(500±15) nm;发射波长(530±20) nm)。最后取部分剩余上清液采用考马斯亮蓝法在595 nm下测定蛋白含量,ROS含量以荧光强度值(FI)·mg-1蛋白表示。
1.5.2 SOD、GST和MDA的测定
按照龙奕等[22]的方法进行组织样品的制备和指标的测定。先将冷冻的肝胰脏组织和0.01 mol·L-1Tris-HCl匀浆介质(pH 7.4)按质量(g)体积(mL)比1∶9的比例加入到玻璃匀浆器中,冰浴下制成匀浆,然后转入0.5 mL离心管,于4 ℃、2 500 r·min-1,离心10 min。先取上清液20 μL(即10%匀浆上清液),用匀浆介质稀释到1%,用于测SOD活性;再取上清液220 μL,用于测GST活性;剩余的匀浆液在10 000 r·min-1继续离心20 min,取上清液,稀释到1%,用于测定MDA含量。SOD活性采用氯化硝基四氮唑蓝(NBT)光化还原法测定,在550 nm下测吸光度,以50%抑制率的酶量为1个SOD的活力单位(U·mg-1蛋白);GST活性采用1-氯-2,4-二硝基苯(CDNB)法测定,在340 nm下测吸光度,活力单位以U·mg-1蛋白表示;MDA含量采用硫代苯巴比妥酸(TBA)比色法测定,在532 nm下测定吸光值,活力单位以nmol·mg-1蛋白表示;采用考马斯亮蓝染色法在595 nm下测定蛋白含量。
1.6 内脏团中BDE-47的分析测定
按照刘佳等[23]的方法对冷冻保存的内脏团样品和间隙水样进行前处理。以PCB-209作为回收率指示物标样,以13C12-PCB138作为定量内标。在GC/MS上采用程序升温的方法进行测定。色谱柱升温程序为初始温度110 ℃保持1 min,8 ℃·min-1升温至180 ℃保持1 min,以2 ℃·min-1升温至240 ℃保持5 min,以2 ℃·min-1升温到280 ℃保持6 min。质谱条件:采用EI离子源进行电离,离子源温度为230 ℃,电子能量70 eV,灯丝电流0.7 mV,离子扫描模式为SIM模式,接口温度为300 ℃。全过程采用方法空白、加标空白、基质加标和基质加标平行样进行质量控制。样品中PCB-209的加标回收率为71%~96%,在合理的回收率范围(60%~120%)内,符合分析要求。仪器对BDE-47的检测限为1.08 ng·mL-1。采用内标法和校正因子对BDE-47进行定量分析计算。
1.7 数据处理与统计分析
实验数据采用SPSS20.0进行统计分析。对实验数据先进行正态分布检验,然后利用单因素方差分析法(ANOVA)和多重比较检验法(LSD)进行组间差异显著性检验,差异显著性水平为0.05。
2 结果(Results)
2.1 生物炭表征
对CSB进行了表面积和孔径测定,结果显示,CSB的比表面积和外部表面积分别为81.66和115.17 m2·g-1,平均吸附孔径为3.874 nm。CSB的扫描电镜照片显示,其外部形貌呈片层状或者柱状,孔隙度较高(图1)。
2.2 沉积物间隙水中BDE-47的浓度
暴露实验前和不同取样时间点沉积物间隙水中BDE-47浓度的变化如表2所示。在对照组和生物炭单独处理组中均未检测到BDE-47。在BDE-47单独处理组和CSB与BDE-47联合处理组,暴露21 d后,间隙水中BDE-47的浓度有所下降,但差异不显著,说明在暴露实验过程中生物扰动对沉积物化学特性的影响可以忽略不计。与BDE-47单独处理组相比,CSB与BDE-47联合处理组间隙水的BDE-47浓度均显著下降,比较暴露28 d后的情况可以看出,1%、4%和7% CSB与BDE-47联合处理组BDE-47的浓度分别比BDE-47单独处理组下降了52%、71%和81%。

图1 玉米秸秆生物炭(CSB)的扫描电镜照片Fig. 1 Scanning electron micrograph of corn straw biochar (CSB)
2.3 CSB对铜锈环棱螺的毒性
将铜锈环棱螺暴露于单独添加不同比例CSB的沉积物28 d后,结果表明,与对照组相比,各处理组铜锈环棱螺肝胰脏DNA损伤(OTM值)、活性氧(ROS)水平、SOD活性、GST活性和MDA含量均未表现出显著差异,说明CSB对铜锈环棱螺不具有毒性。
2.4 CSB和BDE-47联合暴露对铜锈环棱螺肝胰脏中BDE-47生物积累的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺内脏团中BDE-47含量的影响如图2所示。随暴露时间的延长,不同处理组的BDE-47含量总体上呈上升趋势,添加不同比例的CSB能明显降低BDE-47的生物积累。在暴露后期(21和28 d),4%和7% CSB与BDE-47联合处理组的BDE-47含量不再随暴露时间的增加而升高。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的BDE-47含量分别比BDE-47单独处理组(969.94 ng·g-1)下降了50%、69%和79%。
2.5 CSB和BDE-47联合暴露对肝胰脏细胞DNA损伤的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺肝胰脏DNA损伤(OTM值)的影响如图3所示。除暴露初期(7 d)外,CSB与BDE-47联合处理组的OTM值均显著低于BDE-47单独处理组,且随着暴露时间的延长和CSB比例的增加,CSB与BDE-47联合处理组的OTM值显著降低。在暴露后期(21和28 d),7% CSB与BDE-47联合处理组的OTM值不再随暴露时间的增加而升高。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的OTM值分别比BDE-47单独处理组(20.67)下降了44%、67%和83%。

图2 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺内脏团中BDE-47含量的变化注:不同字母表示处理组间存在显著性差异,P < 0.05;下同。Fig. 2 The change of BDE-47 burden in the visceral mass of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSBNote: Different letters show statistically significant differences between treatment groups, P < 0.05, the same below.

表2 沉积物间隙水中BDE-47的浓度(平均值±SD, n=3)Table 2 The concentration of BDE-47 in the porewaters of the sediments (mean±SD, n=3)
注:同一列数据后英文小写字母不同表示不同处理组之间差异显著(P<0.05);ND表示未检出。
Note: Different lowercase letters in the same column of data represent significant differences between different treatment groups (P<0.05); ND is not detected.

图3 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺肝胰脏DNA损伤的变化Fig. 3 The change of DNA damage in hepatopancreas of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSB
2.6 CSB和BDE-47联合暴露对肝胰脏细胞ROS水平的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺肝胰脏ROS水平的影响如图4所示。除暴露初期(7 d)外,CSB与BDE-47联合处理组的ROS水平均显著低于BDE-47单独处理组。4%和7% CSB与BDE-47联合处理组的ROS水平显著低于1% CSB与BDE-47联合处理组,但4%和7% CSB与BDE-47联合处理组之间没有显著差异。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的ROS水平分别比BDE-47单独处理组(70.71)下降了29%、40%和41%。
2.7 CSB和BDE-47联合暴露对肝胰脏细胞SOD活性的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺肝胰脏SOD活性的影响如图5所示。在暴露初期(7 d),CSB的影响不明显;暴露14 d后,CSB与BDE-47联合处理组的SOD活性显著低于BDE-47单独处理组;在暴露后期(21和28 d),CSB与BDE-47联合处理组的SOD活性总体上显著高于BDE-47单独处理组。在整个暴露期内,4%和7% CSB与BDE-47联合处理组之间没有显著差异。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的SOD活性分别比BDE-47单独处理组(13.08 U·mg-1蛋白)升高了9%、17%和21%。

图4 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺肝胰脏活性氧(ROS)含量的变化注:FI表示荧光强度。Fig. 4 The change of reactive oxygen species (ROS) levels in hepatopancreas of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSBNote: FI stands for fluorescence intensity.

图5 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺肝胰脏超氧化物歧化酶(SOD)活性的变化Fig. 5 The change of superoxide dismutase (SOD) activities in hepatopancreas of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSB
2.8 CSB和BDE-47联合暴露对肝胰脏细胞GST活性的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺肝胰脏GST活性的影响如图6所示。GST活性随时间的变化规律与SOD活性基本相同。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的GST活性分别比BDE-47单独处理组(31.68 U·mg-1蛋白)升高了89%、80%和83%。
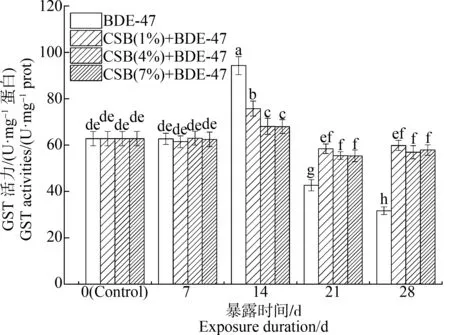
图6 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺肝胰脏谷胱甘肽-S-转移酶(GST)活性的变化Fig. 6 The change of glutathione-S-transferase (GST) activities in hepatopancreas of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSB
2.9 CSB和BDE-47联合暴露对肝胰脏细胞MDA含量的影响
在沉积物中添加不同比例的CSB对铜锈环棱螺肝胰脏MDA含量的影响如图7所示。除暴露初期(7 d)外,CSB与BDE-47联合处理组的MDA含量均显著低于BDE-47单独处理组,但1%、4%和7% CSB与BDE-47联合处理组之间没有显著差异。暴露28 d后,1%、4%和7% CSB与BDE-47联合处理组的MDA含量分别比BDE-47单独处理组(2.52 nmol·mg-1蛋白)下降了66%、71%和72%。

图7 CSB和BDE-47单一或复合加标沉积物暴露后铜锈环棱螺肝胰脏丙二醛(MDA)含量的变化Fig. 7 The change of malondialdehyde (MDA) levels in hepatopancreas of Bellamya aeruginosa following exposure to sediments amended with BDE-47 and/or CSB
3 讨论(Discussion)
3.1 生物炭的潜在生态毒性风险
目前,关于生物炭生态毒性风险的研究已有一些报道。一些研究指出,生物炭具有较低的毒性[24-25]。另有一些研究表明,生物炭不具有毒性,例如,Busch等[26-27]的研究表明水热法制备的生物炭对蚯蚓没有毒性;韩杰等[28]的研究表明水稻秸秆生物炭对小鼠不具有毒性。已有研究表明,生物炭的毒性主要与制备工艺和处理方法有关,相对较高温度下(>400 ℃)慢速热解制备的生物炭通常不具有毒性[29-32];酸化处理可以降低生物炭的毒性风险[33]。在本研究中CSB都是在较高裂解温度(500 ℃)下制备的,而且在暴露实验前都经过酸洗处理,因此不具有毒性。此外,生物炭的毒性还与测试生物种类有关[34]。
3.2 生物炭对沉积物或土壤中有机污染物生物积累的影响
有研究表明,在沉积物或土壤中添加生物炭可以降低有机污染物的生物积累,而且与生物炭的添加量有关。Shen等[5]在研究中指出,当沉积物中玉米秸秆和马尾松生物炭的添加量<1.5%时,摇蚊幼虫体内多环芳烃的生物积累显著降低,但当生物炭添加量>1.5%时,对多环芳烃的生物积累没有影响;Xia等[6]发现玉米秸秆和柳树生物炭可以显著降低沉积物中全氟辛烷磺酸在摇蚊幼虫体内的生物积累,并且生物炭用量(0.2%~1.5%)越高,生物积累降低越多。Wang等[35]在研究中指出,松木生物炭(400 ℃)虽然能显著降低土壤中阿特拉津在2种蚯蚓体内的生物积累,但当生物炭添加量为0.5%时,阿特拉津在威廉腔环蚓(Metaphireguillelmi)体内的生物积累低于赤子爱胜蚓(Eiseniafoetida),而当生物炭用量为2%时,阿特拉津在2种蚯蚓体内的生物积累没有差异。本研究显示,在沉积物中添加CSB(500 ℃)能显著降低BDE-47在铜锈环棱螺体内的生物积累,而且在实验范围内CSB添加比例越高,效果越显著。因此,生物炭对沉积物或土壤中有机污染物生物积累影响的差异与污染物的种类和浓度、生物炭的制备条件、种类和添加水平以及测试生物的种类有关[13]。本研究还显示,随着CSB添加比例的增加,沉积物间隙水中BDE-47的浓度显著下降,从而导致BDE-47的生物积累显著减少,因此,BDE-47的生物积累与沉积物间隙水中BDE-47的浓度成正相关,这与Xia等[6]的研究结果基本一致。
3.3 生物炭对沉积物或土壤中有机污染物生态毒性的影响
目前,有关生物炭与沉积物或土壤中有机污染物相互作用后对底栖动物或土壤动物的潜在生态毒性风险的评价研究仅有少量报道。Bielská等[36]研究了土壤中芒草生物炭与芘相互作用对秀丽隐杆线虫(Caenorhabditiselegans)的影响,结果显示生物炭可以显著降低芘对秀丽隐杆线虫的生态毒性。Bielská等[12]又进一步研究了土壤中木屑和稻壳生物炭与芘、多氯联苯(PCB-52)和p,p’-滴滴伊(p,p’-DDE)相互作用对跳虫(Folsomiacandida)的影响,结果表明,添加生物炭(1%~5%)可以降低这些有机污染物对跳虫的繁殖毒性。本研究通过考察铜锈环棱螺的DNA损伤以及氧化胁迫相关生物标志物的变化来反映沉积物中CSB对BDE-47生态毒性的影响。细胞DNA损伤和氧化胁迫的生物标志物通常可以有效指示污染物的生态毒性[13,22]。当生物机体受到外源性化学物质胁迫时,作为机体抗氧化防御系统重要组分的SOD可以降低或消除氧化胁迫以维持ROS的平衡,但过多的ROS则会激活或抑制SOD活性;MDA水平是衡量机体脂质过氧化程度和细胞氧化损伤的程度;GST是一种在机体Ⅱ代谢中参与亲电性化合物解毒的关键酶,它同时也参与细胞的抗氧化防御,污染胁迫时GST活性的改变体现了机体对污染物的生物转化和抗氧化功能;机体细胞DNA在ROS的攻击下容易发生氧化损伤。结果表明,沉积物中不同比例的CSB与BDE-47的联合暴露能够显著降低铜锈环棱螺肝胰脏的DNA损伤和ROS水平,显著减少对SOD和GST活性的抑制,显著降低MDA含量,这说明不同添加比例的CSB均可以显著降低BDE-47对铜锈环棱螺的毒性,较高比例(4%和7%)CSB的效果更为显著。从变化趋势来看,DNA损伤随着CSB添加比例的升高而显著降低,但不同添加比例的CSB与BDE-47联合处理组之间的ROS水平、SOD活性、GST活性和MDA含量没有显著差异,也就是说,BDE-47的氧化胁迫毒性不随CSB添加比例的升高而下降,这可能是由于不同CSB添加比例引起的联合处理组中BDE-47生物积累的差异并不足以引起氧化胁迫生物标志物响应的改变,这与铜锈环棱螺对BDE-47胁迫的响应相对较慢有关[15]。
综上所述,在慢性暴露情况下,本研究所制备的CSB对铜锈环棱螺不具有毒性。CSB通过显著降低沉积物间隙水中BDE-47的浓度而降低其在铜锈环棱螺体内的生物积累,在实验浓度范围内(1%~7%),CSB添加比例越高,降低BDE-47生物积累的效果越显著。不同添加比例的CSB均可以显著降低BDE-47对铜锈环棱螺的毒性(DNA损伤),较高比例(4%和7%)CSB的效果更为显著,但BDE-47的氧化胁迫毒性不随CSB添加比例的升高而下降。因此,从降低沉积物中BDE-47生态毒性风险的角度来说,沉积物中CSB的合适添加比例为4%。
