低剂量微囊藻毒素MC-LR诱导罗氏沼虾肝胰腺损伤及凋亡
2020-07-02曹清晟王丽萍杨辉魏文志张莹莹
曹清晟,王丽萍,杨辉,魏文志,张莹莹
扬州大学动物科学与技术学院,扬州 225000
近年来,由于生活及工农业生产中含有大量氮、磷的废污水进入水环境中,导致水体富营养化,水华藻类大量增殖,其中蓝藻水华的发生范围最广,并且释放微囊藻毒素(MCs),对人类及其他动物的危害也最为严重[1-2]。MCs主要是具有生物活性的环庚肽化合物,已经发现了100多种不同类型的MCs异构体,其中,MC-LR是分布最广和毒性最强的亚型[3-4]。天然水体中,MCs的含量一般在0.1~10 μg·L-1之间,但是在藻类爆发季节,MCs的含量也可以升到几十μg·L-1[5-6]。水中的MCs不仅对水生生物有直接危害,而且通过饮用水或食物链对鸟类、家畜和人类产生毒害作用。我国规定居民饮用水MCs的含量不得超过1 μg·L-1。迄今为止,由于微囊藻爆发尚未找到有效的解决方法,给人类的生产及生活带来较大的影响,MCs的生物毒性研究一直以来都是国内外研究的热点。
MCs具有明显的嗜肝性,与肝癌的发生、肝内出血以及肝坏死有密切关系[7]。除肝脏外,MCs可富集在动物的多个器官中,包括心脏、肠、性腺、肌肉、肾脏和肺组织中,进而产生毒害效应[8-9]。目前,其毒性作用研究主要集中在对动物新陈代谢、个体生长发育、免疫机能、神经毒性以及生殖毒性等方面[8-13]。MCs通过细胞膜上三磷酸腺苷(ATP)依赖的转运体进入细胞,然后特异性抑制丝氨酸和蛋白磷脂酸合成酶1和2A的活性,从而影响细胞内蛋白磷酸化和去磷酸化,破坏细胞骨架,最终导致细胞凋亡和坏死[14]。MCs还可通过减少白细胞总数,诱导淋巴细胞凋亡、坏死,最终降低机体免疫水平[15-16]。此外,MCs会破坏动物机体的活性氧(ROS)平衡[17],损伤细胞DNA,抑制DNA的修复活性,诱导细胞凋亡及坏死[18-19]。
目前,MCs毒性机制的研究主要集中在哺乳动物及鱼类等脊椎动物上,对无脊椎动物如南美白对虾、克氏原螯虾、日本沼虾和卤虫等也有相关报道[20-22]。罗氏沼虾(Macrobrachiumrosenbergii)是节肢动物门的一种,隶属于大氏沼虾属,是世界上最大的淡水对虾品种,具有生长速度快、饵料食谱广和抗病害强等特点,是我国大型养殖业生产的一种特殊水产养殖品种,在我国广东、江苏和浙江等省份有较大的养殖规模。由于罗氏沼虾的养殖主要以投喂饲料为主,所以养殖水体中氮磷浓度较高,每年的6—10月份,虾塘蓝藻水华爆发严重。所以MCs已经成为影响罗氏沼虾生长的不可以忽视的一个因素,但是关于MCs对罗氏沼虾的毒性机制研究的报道较少。因此,本研究以MC-LR和罗氏沼虾为研究对象,通过组织学观察、免疫组化定位、氧化应激指标测定以及荧光定量PCR技术探究养殖水体中常见的低浓度MCs对罗氏沼虾肝脏的毒害效应及潜在机制。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用罗氏沼虾购买于中国江苏省高邮市罗氏沼虾养殖场,药物MC-LR(纯度≥95%)购买于中国上海源叶生物科技有限公司。
1.2 实验方法
1.2.1 实验动物处理及样品收集
实验所用的罗氏沼虾(5月龄)饲养于实验用玻璃缸内,密度大约为1 L水1 g虾,养殖用水充分曝气,水温控制在(28±0.5) ℃,光照/黑暗周期为14 h/10 h,每天投喂2次罗氏沼虾专用饲料,在实验室适应2周后,平均体重在(11.31±1.05) g,将虾随机分组,分别暴露在0、0.5和5 μg·L-1的MC-LR溶液中1、2和3周,设置3个平行。MC-LR的暴露浓度根据其在自然水体中的浓度设定。暴露期间,每天更换暴露用水的1/2,并补充相应剂量的MC-LR,在暴露1、2和3周时分别采样一次。在每个采样时间点,每个玻璃缸内随机捞取3只虾,称重,解剖后采集肝胰腺组织并称重,计算肝体指数(HSI),计算公式为HIS=肝脏重量/体重×100%。一部分肝胰腺用Bouin固定液(索莱宝,中国)固定,以进行石蜡切片组织学观察、MC-LR富集和细胞凋亡检测,一部分肝胰腺组织立即储存于-80 ℃,待进行氧化应激指标和实时定量PCR分析。
1.2.2 组织学观察
取0.3 cm3左右的肝胰腺组织块用波恩固定液(索莱宝)固定48 h;经梯度乙醇脱水后再使用水杨酸甲酯脱色12~24 h,待组织完全透明后,再浸蜡然后包埋;蜡块凝固后使用涡轮式切片机(Leica RM2235,德国)进行切片,切片的厚度为6 μm;二甲苯脱蜡,梯度酒精复水后使用HE方法染色,梯度酒精脱水后中性树胶封片,室温晾干后即可显微镜观察拍照(Olympus BX53,日本)。
1.2.3 肝胰腺中的MC-LR免疫定位
将石蜡切片用二甲苯脱蜡,然后使用梯度酒精脱水,BSA进行抗原封闭,用MC-LR免疫抗体(1∶500稀释) (上海羽朵生物,中国)进行孵化过夜,再用小鼠二次抗体孵化后,采用辣根过氧化氢酶DAB显色试剂盒(碧云天,中国)进行显色,梯度酒精脱水后使用中性树脂进行密封后,用显微镜对组织样进行检测。
1.2.4 肝胰腺细胞凋亡检测
细胞凋亡检测使用TUNEL组织染色试剂盒(碧云天,中国)进行。简要步骤:(1)用20 mg·L-1蛋白酶K将切片处理15 min;(2)用TdT反应液(TdT酶以及生物素标记的dUTP)在37 ℃孵育1 h,然后使用标准柠檬酸盐液处理15 min终止反应,再使用磷酸盐缓冲液(PBS)(pH=7.4)洗去未结合的生物素标记的dUTP;(3)使用体积分数为3%的H2O2处理5 min,阻断内源性过氧化物酶;(4)将切片用链霉素标记的辣根过氧化物酶室温孵育30 min后,使用PBS洗去未反应试剂;(5)使用DAB显色,并用苏木素染核。阳性对照为DNase I处理后的切片;阴性对照在步骤(2)中使用等体积的PBS替代TdT。观察方法同普通HE染色组织切片。细胞核被染成棕色的细胞为凋亡细胞。
1.2.5 氧化应激指标测定
肝胰腺组织使用PBS研磨后,离心,上清液用于测定氧化应激相关指标包括过氧化氢(H2O2)、总抗氧化能力(T-AOC)以及一氧化氮(NO)由试剂盒测定(南京建成,中国),具体操作及计算方法依照说明书进行,蛋白定量使用Bradford蛋白浓度测定试剂盒进行(碧云天,中国)。
1.2.6 总RNA提取、反转录及qPCR
使用Trizol一步法提取肝胰腺组织的总RNA,通过琼脂糖凝胶电泳28s rRNA和18s rRNA比值检测RNA完整性。用微量分光光度计(Thermo NanoDrop 2000c,美国)测定分离RNA的浓度和纯度,总RNA使用带基因组DNA去除的反转录试剂盒(Takara,日本)反转成cDNA。通过实时荧光定量PCR(qPCR)检测促凋亡基因(bax)、抗凋亡基因(bcl2)、细胞色素C基因(cytc)以及半胱氨酸蛋白酶3基因(casp3)的mRNA的表达。选择18s rRNA(18s)和β-机动蛋白(actb)作为内参基因,所使用的引物序列如表1所示,引物的扩增效率(E)值都在90%~110%之间。基因的相对表达量采用2-△△Cq法进行(F=2-△△Cq, △△Cq=(Cqtarget gene-Cqmean of actband18s)enrofloxacin-(Cqtarget gene-Cqmean of actb and 18s)control)计算MC-LR暴露下基因表达的相对变化。
1.3 数据分析
所有数据均用均数±标准误(SEM)表示,分析前对数据进行分布正态性检验(Shapiro-Wilk检验)和方差齐性检验(Levene’s检验),对不符合正态性和同方差的数据进行对数(lg)转换,然后进行单因素方差分析,对差异显著的数据集进行Tukey检验,显著性水平P<0.05。

表1 定量引物序列Table 1 Primer sequences for qPCR
2 结果(Results)
2.1 MC-LR诱导肝胰腺的损伤
如图1(a)所示,对照组中的肝小管形态完整,相互之间连接紧密,刷状缘发达。在低浓度MC-LR处理的前2周肝胰腺组织无明显变化,而在处理的第3周发现肝小管之间的缝隙变大,部分连接消失(图1(b))。高浓度MC-LR处理下,第1周即出现上述现象(图1(c)),随着暴露时间延长,肝小管间的缝隙逐步加大,连接逐渐消失,肝小管壁逐渐变薄,乃至消失;在暴露3周后,发现部分肝小管中的刷状缘消失(图1(d)和(e))。
2.2 MC-LR在肝胰腺组织中的富集
对照组未检测到MC-LR(图2(a));在低浓度(0.5 μg·L-1)的MC-LR暴露下,罗氏沼虾的肝胰腺组织中,在暴露后的第1、2和3周内都没有出现明显的MC-LR毒素蓄积现象;在高浓度(5 μg·L-1) MC-LR暴露下,第1周即发现MC-LR在罗氏沼虾肝胰腺少量富集,随着暴露时间的延长,MC-LR的富集增多,并且在肝胰腺组织的边缘部MC-LR富集更为明显(图2(b)~(d))。
2.3 MC-LR诱导肝胰腺细胞凋亡
如图3所示,对照组的肝胰腺中,没有明显凋亡的细胞。低浓度(0.5 μg·L-1)MC-LR处理组在整个暴露阶段也没有明显的凋亡现象发生。高浓度(5 μg·L-1)MC-LR处理组,在暴露的第3周,发现了被染成棕色的凋亡细胞。

图1 微囊藻毒素LR(MC-LR)诱导罗氏沼虾肝胰腺损伤注:(a) 对照组;(b) 0.5 μg·L-1 MC-LR处理组暴露3周;(c) 5 μg·L-1 MC-LR处理组暴露1周;(d) 5 μg·L-1 MC-LR处理组暴露2周;(e) 5 μg·L-1 MC-LR处理组暴露3周;Lt为肝小管,Bb为刷状缘;星号表示肝小管之间连接组织消失,缝隙变大;箭头表示肝小管壁变薄;三角形表示肝小管刷状缘消失。Fig. 1 Microcystin LR (MC-LR) induced hepatopancreas injury of Macrobrachium rosenbergiiNote: (a) control group; (b) 0.5 μg·L-1 MC-LR treatment group after 3 weeks; (c) 5 μg·L-1 MC-LR treatment group after 1 week; (d) 5 μg·L-1 MC-LR treatment group after 2 weeks; (e) 5 μg·L-1 MC-LR treatment group after 3 weeks; Lt stands for hepatic tubule; Bb stands for brush border; asterisk shows that the connective tissue between the hepatic tubules disappeared, and the gap became larger; the arrow shows that the hepatic tubule wall became thin; the triangle shows the brush border in the hepatic tubules disappeared.
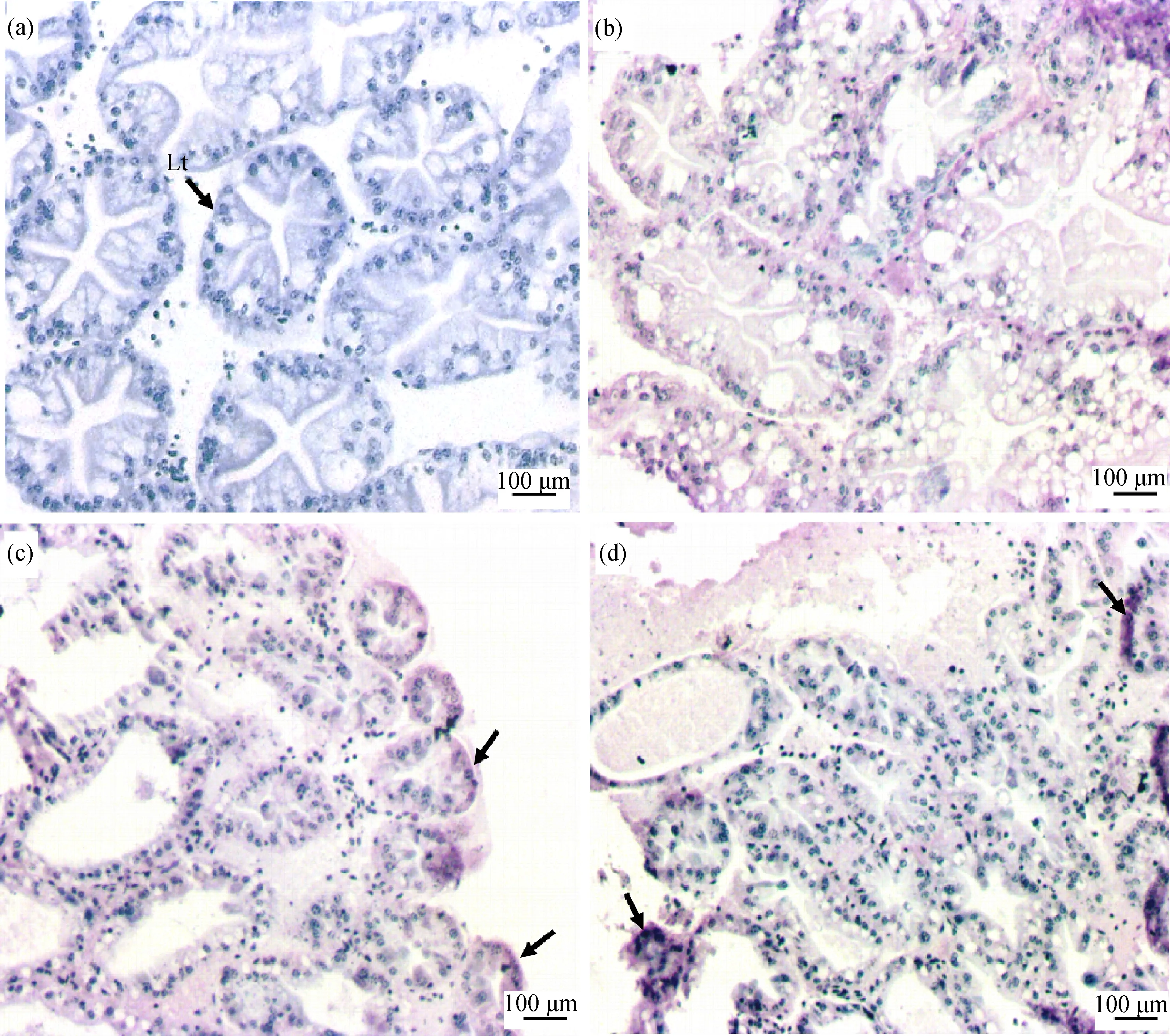
图2 MC-LR在罗氏沼虾肝胰腺组织中蓄积注:(a) 对照组;(b) 5 μg·L-1 MC-LR处理组暴露1周;(c) 5 μg·L-1 MC-LR处理组暴露2周;(d) 5 μg·L-1 MC-LR处理组暴露3周;Lt表示肝小管;紫色为MC-LR毒素富集;黑色箭头指示MC-LR富集较多的部位。Fig. 2 MC-LR accumulated in the hepatopancreas of Macrobrachium rosenbergiiNote: (a) control group; (b) 5 μg·L-1 MC-LR treatment group after 1 week; (c) 5 μg·L-1 MC-LR treatment group after 2 weeks; (d) 5 μg·L-1 MC-LR treatment group after 3 weeks; Lt stands for hepatic tubule; purple indicates MC-LR enrichment; black arrow indicates the site where MC-LR is abundantly enriched.

图3 MC-LR诱导罗氏沼虾肝胰腺细胞凋亡注:(a) 对照组;(b) 5 μg·L-1 MC-LR处理组暴露3周;黑色箭头指示被染成棕色的凋亡细胞。Fig. 3 MC-LR induced hepatic cell apoptosis in Macrobrachium rosenbergiiNote: (a) control group; (b) 5 μg·L-1 MC-LR treatment group after 3 weeks; black arrow shows apoptotic cells stained brown.
2.4 MC-LR对氧化应激相关指标的影响
如图4所示,在暴露第2周,5 μg·L-1MC-LR显著上调了肝胰腺中H2O2的水平0.22倍;在暴露第3周,0.5和5 μg·L-1MC-LR显著诱导肝胰腺H2O2水平0.19倍和0.38倍。0.5 μg·L-1MC-LR在暴露1周后显著上调NO含量0.23倍,在暴露2周后显著上调NO含量0.36倍;NO含量在5 μg·L-1MC-LR处理组中,在暴露2周和3周后,分别显著上调0.62倍和0.41倍。5 μg·L-1MC-LR在暴露的1周后显著上调T-AOC含量1.43倍,在暴露3周后显著下调T-AOC含量19%。
2.5 MC-LR对凋亡相关基因表达的影响
如图5所示,在暴露1周和3周后,0.5 μg·L-1MC-LR分别显著上调bax基因表达0.49倍和0.22倍;5 μg·L-1MC-LR在暴露1周后显著上调bax基因表达2.24倍,在暴露3周后显著下调bax表达72%。暴露2周后,bcl2的表达在0.5和5 μg·L-1MC-LR处理组中分别显著上升0.80倍和0.61倍;在暴露3周后,其表达在0.5 μg·L-1MC-LR处理组中显著上升0.49倍。在0.5 μg·L-1MC-LR处理组中,cytc基因的表达在暴露后1周显著上升1.82倍,在暴露3周后,显著下调49%;在5 μg·L-1MC-LR处理组中,cytc基因的表达在暴露后1周和2周分别显著上升1.88倍和0.70倍,在暴露3周后,显著下调50%。在3个时间点,casp3基因的表达均被MC-LR抑制(76%~23%)。
3 讨论(Discussion)
蓝藻水华以及其产生的MCs一直以来都是威胁水产养殖业健康发展的主要问题之一。在罗氏沼虾的养殖中,由于投饲量较大,水体的富营养化程度高,蓝藻水华爆发更为严重,对罗氏沼虾的健康养殖带来较大影响。在本研究中,为了探究环境相关浓度的MCs对罗氏沼虾的毒性效应,选取了与水环境中MCs浓度比较接近的0.5和5 μg·L-12个MC-LR浓度作为实验浓度;并且考虑到虾类接触藻毒素的方式是通过鳃呼吸、体表渗入以及食物带入等多个途径,因此,采用更接近其真实生活状态的养殖水体暴露方式进行;通过毒素暴露浓度与方式的控制,保证能够更加准确地反映自然水体中MCs对罗氏沼虾的毒害效应。
肝脏是MCs主要的靶器官,本研究的MC-LR免疫组化结果表明,较高浓度(5 μg·L-1)的MC-LR可在罗氏沼虾的肝胰腺中富集,并且富集量随时间增加。Yuan等[23]对克氏原螯虾和日本沼虾进行了为期7 d的MC-LR暴露,并通过液质联用检测了MC-LR在虾体内的富集情况,结果与本研究相似,MC-LR在肝胰腺组织中的富集也是随暴露时间增加而增多。不同的是在暴露1周后,0.1 μg·L-1MC-LR处理组的克氏原螯虾及日本沼虾的肝胰腺中也有毒素检出,而本研究中低浓度处理组(0.5 μg·L-1MC-LR)中没有发现毒素的明显富集。其主要原因可能有2点,一是液质联用检测的敏感度更高,二是不同的虾对MCs的代谢强度有差异,罗氏沼虾可能对MC-LR的代谢能力更强。此外,本研究发现,MC-LR在肝胰腺组织外缘富集更多,这可能也意味着MCs对肝胰腺外缘部分损伤更大。
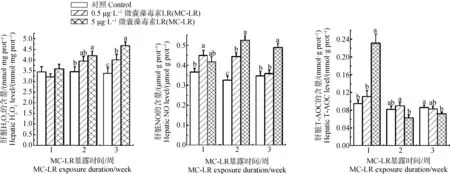
图4 MC-LR对罗氏沼虾肝胰腺氧化应激相关指标的影响注:数据均以mean±SEM表示,标注不同字母表示差异显著(P<0.05)。Fig. 4 Hepatic oxidative stress-related index levels of Macrobrachium rosenbergii in response to MC-LR exposureNote: All data were expressed as mean±SEM; bars with different letters indicated significantly difference at P<0.05.

图5 MC-LR对罗氏沼虾肝胰腺凋亡相关基因表达的影响注:数据均以mean±SEM表示,标注不同字母表示差异显著(P<0.05)。Fig. 5 Hepatic apoptosis-related gene expression of Macrobrachium rosenbergii in response to MC-LR exposureNote: All data were expressed as mean±SEM; bars with different letters indicated significantly difference at P<0.05.
组织学切片结果表明,环境相关浓度的MC-LR对罗氏沼虾的肝胰腺有较大的损伤作用,即使是在低于我国饮用水安全浓度标准(0.5 μg·L-1)下,MC-LR的长时间暴露也会对肝胰腺产生损伤。MC-LR产生这种损伤的机制是什么?许多研究表明,MCs可以通过诱导氧化应激对机体产生损伤[18,24-25]。氧化应激是指体内氧化与抗氧化作用失衡,倾向于氧化,是由自由基包括HO·和NO等在体内产生的一种负面作用。与MCs在其他动植物中产生损害的结果相似[26-27],在本研究中,HO·和NO的水平在MC-LR暴露期间均增加,并且大多呈现剂量依赖型上升方式。然而,T-AOC水平在暴露早期升高,随着暴露时间的延长而降低,尤其在较高浓度组更为明显。这表明,暴露早期罗氏沼虾在进行着积极的抗氧化反应,但随着暴露时间延长,氧化机体的抗氧化能力逐渐减弱,这与本研究中肝胰腺组织损伤不断加重的结果一致。

综上,本研究结果表明,较高的环境相关浓度的MCs(5 μg·L-1)会在罗氏沼虾肝胰腺中显著富集,诱导氧化应激,破坏肝胰腺的形态和结构,并且破坏作用随暴露时间延长而加剧,组织发生细胞凋亡。较低的环境相关浓度的MCs(0.5 μg·L-1)对肝胰腺的影响相对较小,但是依然会诱导罗氏沼虾肝胰腺氧化应激,并且长时间作用下也会给肝胰腺组织结构带来损伤。
