湿地植物水蓼(Polygonum hydropiper L.)对镉的富集特征及生理响应
2020-07-02葛依立陈心胜黄道友葛大兵邓正苗李峰谢永宏
葛依立,陈心胜,黄道友,葛大兵,邓正苗,李峰,谢永宏,*
1. 湖南农业大学生物科学技术学院,长沙 410128 2. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410128 3. 中国科学院洞庭湖湿地生态系统观测研究站,岳阳 414000
近几十年来,由于采矿、冶炼和化工等行业废水的超标排放以及农业生产中化肥、农药的大量使用等原因,地表水污染已成为严重的环境问题[1]。其中,镉移动性强,生物毒性大,且极易通过食物链进入人体,因此,已引起社会的广泛关注[2]。
人工湿地由于成本低、绿色环保等优点,逐渐发展为水体重金属污染修复的研究热点。在人工湿地系统中,植物通过吸附、根际沉淀、吸收和离子交换等过程,在去除重金属等污染物方面起着关键作用[3]。关于湿地植物对镉富集能力的研究已有报道。例如在20 mg·L-1的镉处理下,人工湿地中芦苇的根、茎和叶的镉含量分别达到了200、80和40 mg·kg-1[4]。在15 mg·L-1镉处理下,美人蕉地上和地下部分镉含量分别达到555.4和1 159.2 mg·kg-1[5]。在40 μmol·L-1镉处理下轮叶黑藻叶片和茎中镉含量分别为2 220.0和1 362.3 mg·kg-1[6]。这些研究表明,湿地植物具有修复重金属污染水体的良好前景,但当前报道的对镉高富集的水生植物种类较少,限制了人工湿地植物的选择和应用。
湿地植物一般具有较高的金属耐受性,但镉作为植物的一种非必需元素[7],当镉元素的浓度超过一定值时,会对植物产生毒害作用,导致植物根、茎和叶的生物量下降。例如,Colzi等[8]研究发现,在5 mg·L-1镉的水培溶液下,绿狐尾藻根和枝叶的长度下降,7 d后可发现植物老叶顶端已出现坏死区域。在0.5 mol·L-1镉处理下,卷心菜的生物量显著下降[9]。
镉对植物的毒害可能是通过抑制酶活性,阻断代谢重要分子的官能团,置换或取代基本元素以及破坏膜完整性而改变细胞在分子水平上的许多生理过程[10]。植物一方面可以将重金属结合到渗出的有机酸或细胞壁的阴离子团中,以便阻止它们进入根系细胞;另一方面可以通过增强细胞抗氧化酶系统,促进植物体内产生的活性氧的清除过程[11]。植物采取这2种防御机制,可以控制重金属元素的摄取、积累和易位。同时,植物可通过从细胞质中排除重金属游离离子的方式达到解毒的目的[12]。例如,当镉浓度升高至10 mmol·L-1时,空心莲子草过氧化物酶(POD)活性下降,而超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性显著升高[13]。这主要由于镉离子损伤了细胞内蛋白质、DNA等大分子,从而引起膜脂过氧化作用,使植物体内的活性氧增加,导致严重的细胞损伤[14]。
虽然,针对湿地植物对镉的吸收、富集和转移特征的研究已有报道,但当前已知的对镉吸收和富集能力强的湿地植物种类仍然较少,限制了湿地植物在重金属污染土壤和水体修复中的应用[15]。此外,湿地植物如何通过调整抗氧化酶活性等生理条件对镉离子胁迫做出响应也缺乏系统研究。水蓼(PolygonumhydropiperL.)是一种常见的湿地植物,分布在潮湿土壤及浅水环境中。水蓼具有生长迅速、光合速率高、通气组织发达和耐水淹等特征,具有在人工湿地中应用的潜力。盆栽实验表明,在土壤镉含量为100 mg·kg-1的条件下,水蓼地上部的镉含量可达到68 mg·kg-1,而地下部分可达到200 mg·kg-1[16]。由此可见,水蓼是一种潜在的高富集植物。但实际生产中,污染土壤和水体的镉浓度不可能如此之高,如工业废水中镉的最高容许排放浓度为0.1 mg·L-1。在较低镉浓度下,水蓼对镉的富集能力如何?镉在植物体内是如何进行分配和转运的?镉胁迫是否会造成水蓼叶绿素、抗氧化酶系统等的生理损伤?基于这些问题,笔者设置了4个水平的镉溶液(0、0.5、1和2 mg·L-1),研究水蓼对镉的富集特征以及生长和生理响应,探讨水蓼作为镉的高富集植物的潜力,为水蓼在重金属污染修复中的应用提供理论依据。
1 材料与方法 (Materials and methods)
1.1 实验材料
于2016年11月在东洞庭湖君山后湖采集水蓼根茎,将采集的水蓼根茎种植于中国科学院亚热带农业生态研究所温室中,待水蓼生长3个月后,选取长势良好、生长一致的水蓼种植于直径为15 cm、高25 cm的塑料花盆中。在塑料花盆中加入未被污染的河沙,每盆种植3株水蓼。
1.2 实验仪器与试剂
仪器包括紫外可见分光光度计-2600仪(岛津(香港)有限公司);GBC932原子吸收仪(德国耶拿公司);700 ICP-OES电感耦合等离子体光谱仪(安捷伦有限公司);日立CP100NX冷冻超速离心机(天美科技有限公司)。实验所用试剂均为分析纯,均购自中国国药有限公司。
1.3 实验方法
采用水培方法进行实验,并采用随机区组法设计实验,每个处理设置5个重复。实验共使用20个水箱,每4个水箱摆成1个区组。将种好植物的花盆放置在长方形塑料水箱里(52 cm×40 cm×22 cm)。每个水箱里摆放11盆,即33株植物。在每个塑料水箱中注入8 L 1/10Hoagland营养液(含8 mg·L-1(NH4)3PO4·3H2O、50.6 mg·L-1KNO3、49.3 mg·L-1MgSO4·7H2O、94.5 mg· L-1Ca(NO3)2·4H2O、18.65 mg·L-1FeSO4·7H2O和20 mg·L-1EDTA),使营养液刚好没过花盆沙面,每天补充水箱培养液至水位刻度线。每天使用增氧机增氧1 h加速营养液的循环,并补充氧气。
预培养15 d后,称取一定质量的CdCl2·2.5H2O溶于营养液中,使同一区组(4个水箱)每个水箱中培养液的镉的质量浓度分别为0、0.5、1和2 mg·L-1。
实验在中国科学院亚热带农业生态研究所温室中进行,光照12 h,温度维持在25 ℃,于2016年5月15日开始实验,5月30日(处理15 d)进行第1次采样,6月14日(处理30 d)进行第2次采样,每次取样取5盆植物。实验期间每天观测水蓼生长情况,并记录高度、叶片数等生长特征。
1.4 分析测定
1.4.1 生物量和根、茎、叶镉含量的测定
每次收获后,用0.1 mol·L-1EDTA洗净植物表面及根部,然后用去离子水冲洗植物3次,用吸水纸将植物茎叶和根系水分吸干。每个处理的每个重复取2株植物用于生物量测定,3株植物用于镉含量测定。将植物分为根、茎和叶3个部分并用电子天平称其鲜重,分别装于信封中在105 ℃下杀青30 min,将杀青后的植物于65 ℃下烘干至恒重,并称取各部分质量。然后,用粉碎机将烘干样品粉碎,装入4号自封袋备用。称取0.2 g植物样采用硝酸-高氯酸湿式消解法消解植物样品,洗液定容过滤后使用电感耦合等离子体光谱仪(ICP-OES)进行镉含量测定。通过ICP测定GBW07603(GSV-2)标准物质,用于计算金属检测限以及验证植物样品的金属含量,回收率介于96.8%~101.7%之间。
1.4.2 生理指标测定
每次取植株顶端第3片至第8片完全展开且长势一致的健康叶片;称取叶片0.4 g,加入0.1 mol·L-1磷酸盐缓冲溶液(pH值为7.4)研磨,在4 ℃、12 000 r·min-1离心20 min,取上清液为原酶液用于测定SOD活性、CAT活性和丙二醛(MDA)含量。SOD活性采用羟胺法测定,CAT活性采用钼酸铵法测定,MDA含量采用硫代巴比妥酸法测定;上述抗氧化指标的测定均使用南京建成生物工程研究所研发的试剂盒完成。叶绿素含量是衡量植物光合作用的基础指标,采用80%丙酮比色法进行测定。
1.5 数据处理与统计分析
生物富集系数(bioconcentration factor, BCF) =植物体中的镉含量(mg·kg-1)/溶液中的镉含量(mg·kg-1)。
转移系数(translocation factor, TF) =植物体地上部的镉含量(mg·kg-1)/植物体地下部的镉含量(mg·kg-1)。
不同采样时间和不同镉浓度处理下,水蓼各部分的生物量、镉含量以及生理指标的差异显著性分析采用单因素重复测量的方差分析(Repeated Measures One-way ANOVA),并采用Tukey检验进行不同处理间的多重比较,显著度水平为0.05。所有统计分析使用SPSS 19.0进行,并使用Origin8.5进行绘图。
2 结果(Results)
2.1 不同镉处理对水蓼生长特征的影响
水蓼总生物量受到镉浓度和采样时间的显著影响,并且两者之间存在交互效应(表1和图1(a))。处理15 d中,水蓼总生物量随镉处理浓度的升高呈先增加后下降的趋势。在1 mg·L-1镉处理下水蓼的总生物量最高,为8.4 g;而2 mg·L-1镉处理下总生物量有所下降,为5.6 g。处理30 d时,在0和0.5 mg·L-1镉浓度下总生物量较15 d时显著升高,但在镉浓度为1和2 mg·L-1时较15 d无显著差异。在处理30 d时,不同镉浓度下水蓼的总生物量没有显著差异,在7.7~9.7 g之间(图1(a))。
水蓼根生物量受到镉浓度和采样时间的显著影响(表1和图1(b))。在处理15 d中,根生物量随镉浓度的增加呈增加趋势,2 mg·L-1镉处理下根生物量最高,为0.36 g。处理30 d时,在0和0.5 mg·L-1镉浓度下,根生物量较15 d时显著增加,但在1和2 mg·L-1镉浓度下较15 d时无显著差异。在处理30 d时,不同镉浓度下水蓼的根生物量没有显著差异,在0.3~0.5 g之间(图1(b))。
水蓼茎、叶生物量受到不同镉浓度的显著影响,并且镉浓度和采样时间存在交互效应(表1、图1(c)和(d))。在处理15 d中,茎生物量和叶生物量随镉浓度增加呈先增加后下降的趋势。在镉浓度为1 mg·L-1时,水蓼茎和叶的生物量最高,分别为1.0和0.5 g;但在2 mg·L-1时有所下降,茎和叶生物量分别为0.8和0.3 g。处理30 d时,在0和0.5 mg·L-1镉浓度下茎生物量较15 d显著增加,但在1和2 mg·L-1镉浓度下较15 d时无显著差异;叶生物量在0和1 mg·L-1镉浓度下较15 d显著增加,但在2 mg·L-1镉浓度下较15 d无显著差异。在处理30 d时,不同镉浓度下水蓼茎和叶的生物量没有显著差异,茎生物量在1.1~1.6 g之间,叶生物量在0.6~1.0 g之间(图1(c)和(d))。
2.2 不同镉浓度对水蓼镉富集能力的影响
水蓼的整株植物(全株)镉含量、叶镉含量和茎镉含量受镉浓度和采样时间的显著影响,并且两者之间存在交互效应(表1)。水蓼全株镉含量、叶镉含量和茎镉含量随镉处理浓度升高呈增加趋势(图2(a)~(c))。在2 mg·L-1镉处理下,15 d时水蓼全株、茎和叶镉含量分别为35、14和14 mg·kg-1;30 d时水蓼全株、茎和叶镉含量分别为57、47和48 mg·kg-1。在处理30 d时,在1和2 mg·L-1镉浓度下,全株镉含量、叶镉含量和茎镉含量较15 d时显著增加,但在0和0.5 mg·L-1镉浓度下较15 d时无显著差异。
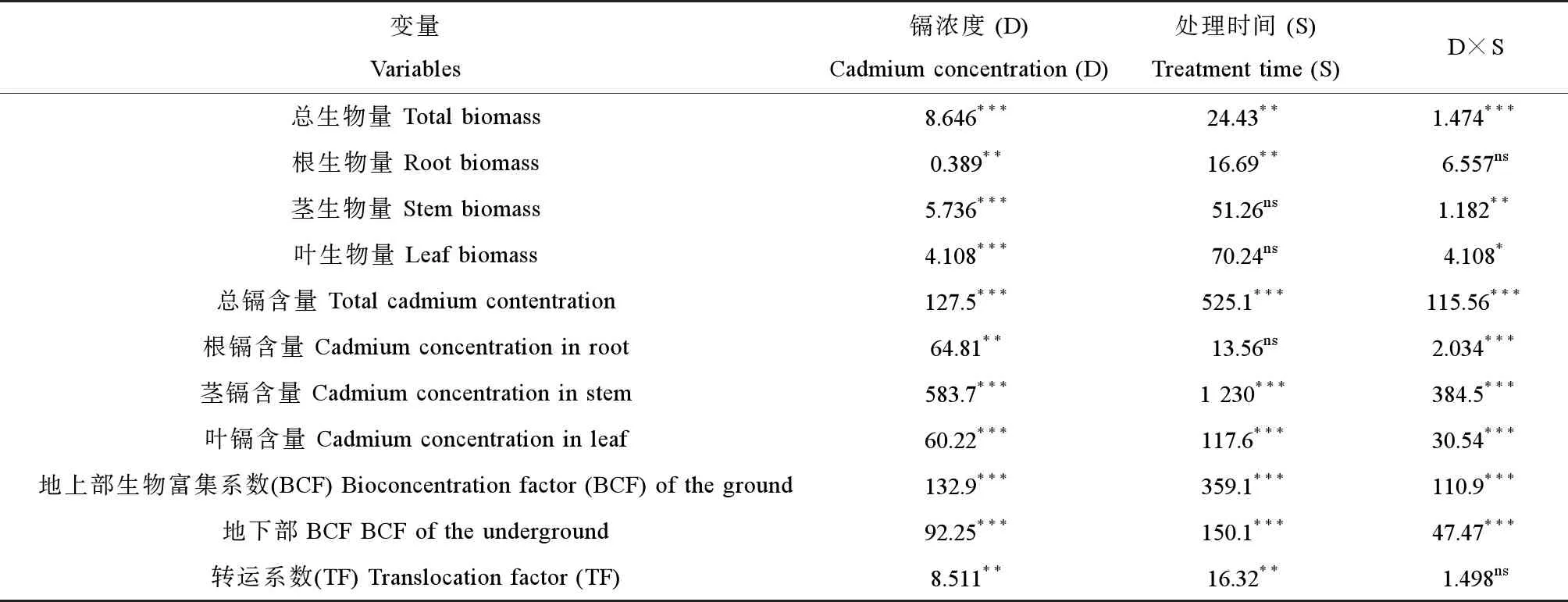
表1 水蓼生物量、镉含量和富集能力随着时间及镉浓度的重复度量方差分析Table 1 Repeated measures ANOVA of Polygonum hydropiper L. biomass, cadmium content and enrichment capacity over time and cadmium concentration
注:***P<0.001、**P<0.01、*P<0.05、nsP>0.05。
Notes:***P<0.001,**P<0.01,*P<0.05,nsP>0.05.

图1 不同镉浓度对水蓼根、茎、叶和总生物量的影响注:不同小写字母分别表示不同镉处理之间的显著差异(P<0.05)。Fig. 1 Effects of cadmium concentration on root, stem, leaf and total biomass of Polygonum hydropiper L.Note: Different lowercase letters showed significant differences between different cadmium treatments (P<0.05).
水蓼根的镉含量受镉浓度的显著影响,并且与采样时间存在交互效应(表1)。水蓼根的镉含量随镉浓度增加而增加。在2 mg·kg-1镉处理下,15 d时水蓼根的镉含量为108 mg·kg-1,30 d时根的镉含量达到了134 mg·kg-1。处理30 d时,在1和2 mg·L-1镉浓度下,根镉含量较15 d显著增加。
水蓼地上部分和地下部分富集系数均受镉浓度和采样时间的显著影响,并且两者之间存在交互效应(表1)。地上部分和地下部分富集系数均随着镉处理浓度的增加呈先增加后下降的趋势。水蓼地上部分富集系数在1 mg·kg-1镉浓度下最高,在15和30 d时分别达到11.91和45.56,但在2 mg·kg-1时开始下降(表2)。水蓼地下部富集系数在0.5 mg·L-1镉浓度时显著增加,在1 mg·L-1镉浓度下最高,在15和30 d时分别达到78.59和111.69,但在2 mg·L-1时开始下降(表2)。
水蓼转运系数受镉浓度和采样时间的显著影响(表1)。在处理15 d时,不同镉浓度下的转运系数无显著差异。在30 d时,转运系数在1 mg·kg-1镉浓度下显著增加,达到了0.41,且显著高于其他处理组。
2.3 不同镉浓度处理对水蓼生理特征的影响
2.3.1 叶绿素含量
水蓼叶绿素含量受镉浓度和采样时间的交互影响(表3)。15 d时,水蓼叶绿素含量在2 mg·L-1镉处理下显著降低(图3(a))。30 d时,叶绿素含量在0.5 mg·L-1下显著降低,在2 mg·L-1镉处理下最低,为12 mg·g-1。
2.3.2 MDA含量
水蓼MDA含量受采样时间显著影响,并且与镉处理浓度之间存在交互效应(表3)。在15 d时,MDA在各个镉处理下没有显著差异。但在30 d时,MDA含量在0.5~2 mg·L-1镉处理下显著升高(图3(b))。在处理30 d时,MDA含量在各个镉处理组中均较15 d时显著增加。
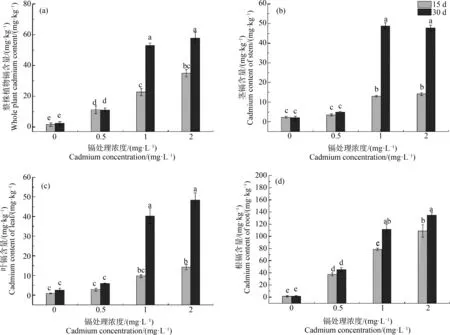
图2 不同镉浓度对水蓼根、茎、叶和整株镉含量的影响注:不同小写字母分别表示不同镉处理之间的显著差异(P<0.05)。Fig. 2 Effects of cadmium concentration on the cadmium contents in roots, stems, leaves and whole plants of Polygonum hydropiper L. Note: Different lowercase letters showed significant differences between different cadmium treatments (P<0.05).
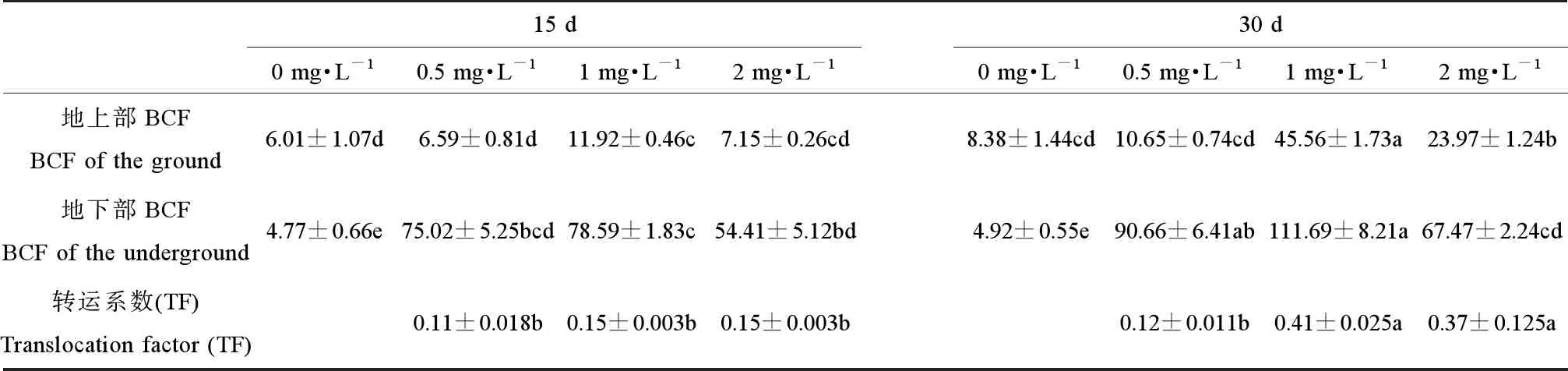
表2 不同镉浓度对水蓼的富集系数和转运系数的影响Table 2 Effects of different cadmium concentrations on the enrichment and transport coefficient of Polygonum hydropiper L.
注:不同小写字母分别表示不同镉浓度处理之间的显著差异(P<0.05)。
Notes: Different lowercase letters showed significant differences between different cadmium concentration treatments (P<0.05).
2.3.3 SOD和CAT活性
水蓼SOD活性受镉浓度和采样时间的影响,并且两者之间存在交互效应(表3)。SOD活性随镉浓度增加呈先增加后下降的趋势,1 mg·L-1镉处理下SOD活性最高,2 mg·L-1镉处理下显著下降(图3(d))。在处理30 d时,SOD活性在不同镉浓度处理下均较15 d时均显著增加。
水蓼CAT活性受到镉浓度的显著影响,并且与采样时间之间存在交互效应(表3)。在15 d时,不同镉浓度下水蓼CAT活性无显著差异,但在30 d时CAT活性在0.5~2 mg·L-1镉浓度下显著增加(图3(c))。在处理30 d时,在1 mg·L-1镉浓度下,CAT活性较15 d时显著增加,但其他镉处理条件下较15 d时无显著差异。

表3 水蓼叶绿素含量、MDA含量、SOD和CAT活性随着时间及镉浓度的重复度量方差分析Table 3 Repeated measures ANOVA of chlorophyll content, MDA content, SOD and CAT activities of Polygonum hydropiper L. over time and cadmium concentration
注: MDA为丙二醛,CAT为过氧化氢酶,SOD为超氧化物歧化酶;***P<0.001、**P<0.01、*P<0.05、nsP>0.05。
Notes: MDA stands for malondialdehyde; CAT stands for catalase; SOD stands for superoxide dismutase;***P<0.001,**P<0.01,*P<0.05,nsP>0.05.

图3 不同镉浓度对水蓼叶绿素含量、MDA含量、CAT和SOD活性的影响注:不同小写字母分别表示不同镉处理之间的显著差异(P<0.05)。Fig. 3 Effects of cadmium concentration on chlorophyll content, MDA content, CAT and SOD activities of Polygonum hydropiper L.Note: Different lowercase letters showed significant differences between different cadmium treatments (P<0.05).
3 讨论(Discussion)
实验结果表明,水蓼对镉具有较强的富集能力,在2 mg·L-1镉浓度下,全株镉含量可到50 mg·kg-1以上,根部则可以达到100 mg·kg-1以上。水蓼根、茎、叶的生长、叶绿素含量以及抗氧化酶活性均不同程度地受到镉胁迫的影响,并且随处理时长而发生变化。
3.1 镉胁迫对水蓼生长生理特征的影响
生物量的变化是植物应对环境胁迫的综合表现[17]。在本研究中,水蓼生物量对不同程度的镉胁迫响应不同。在处理15 d时,低浓度镉(≤1 mg·L-1)能在一定程度上促进水蓼的生长,而较高浓度的镉处理(2 mg·L-1)则抑制了水蓼的生长。在对其他植物的研究中也发现了较低浓度的镉能促进生长、高浓度的镉抑制生长的现象[18-20]。例如,Tang等[18]研究发现,在水培实验条件下镉浓度为44 μmol·L-1时,圆锥南芥地上部生物量会有一定增长,但当镉浓度大于178 μmol·L-1时,植物会出现叶片坏死和枯萎。Ying等[19]研究发现,当镉浓度低于10 μmol·L-1时,滇苦草的地上部和根生物量明显增加,但当镉浓度为75 μmol·L-1时,地上部和根生物量下降。Sun等[20]发现在镉浓度<16 mg·L-1时三叶鬼针草的茎生物量增加,但在100 mg·kg-1镉处理下茎生物量显著降低。低浓度镉促进植物生长的原因可能是刺激了植物酶活性,提高了植物抗氧化能力并增强了植物对镉的耐受能力,加速了植物生长[21]。但同时镉是一种强大的酶活抑制剂,高浓度镉可以破坏线粒体、叶绿体等,从而影响植物正常生长,导致植物生物量下降[22]。在本研究中,在1 mg·L-1浓度下,镉对水蓼表现为促进生长,但在2 mg·L-1时即表现为生长抑制,表明水蓼能忍耐一定程度的镉胁迫,但适应范围较窄。这与水蓼叶绿素含量、抗氧化酶活性等生理指标对镉胁迫的响应是一致的。
叶绿素含量的降低是重金属对植物毒害的普遍现象[23]。在本研究中,处理15 d时,在镉含量不高于1 mg·L-1时,叶绿素含量没有明显变化,但在2 mg·L-1时叶绿素含量明显下降。这说明,2 mg·L-1镉胁迫抑制了水蓼光合作用,加速叶片老化,最终表现为植物生长抑制,生物量下降[24]。随着处理时间的增长,水蓼叶绿素含量在0.5 mg·L-1时下降,这表明镉胁迫时间的延长导致水蓼受毒害程度增加。笔者推测可能是因为镉胁迫干扰了Fe代谢,抑制了叶绿素合成酶的活性[25],从而导致叶绿素含量减少。
酶系统作为主要的自由基清除机制,其中SOD是主要将所产生的超氧阴离子自由基(O2)歧化成H2O2和O2,CAT直接分解H2O2产生H2O和O2[26-27]。植物体内酶活性的升高可以一定程度降低或减少自由基对植物细胞膜的伤害。水蓼的SOD活性在镉浓度≤1 mg·L-1时显著增加,但在2 mg·L-1浓度下降低。这些结果表明在低浓度镉胁迫下,水蓼可通过维持自身较高的酶活性来降低镉离子对植物细胞的伤害并刺激植物生长,但在高浓度的镉胁迫下,活性氧产生速度高于自身清除速度,重金属离子对植物细胞核造成破坏,植物体内酶活性下降[28]。并且,随着处理时间的增加,不同镉处理浓度下水蓼的SOD和CAT酶活性呈增加趋势,增强了对活性氧的清除能力,对植物起到良好的保护作用[29-30]。
MDA是氧化损伤的主要直接结果之一。研究发现,MDA含量的增加与SOD活性的降低相关,这种关联可以指示植物对镉胁迫的氧化应激反应[31]。本研究发现,处理15 d时,MDA含量在不同镉浓度下没有显著差异,但在处理30 d时,MDA含量在不同镉浓度下均较15 d时显著增加。这表明,随着处理时间的增长,所积累的活性氧引发了膜脂过氧化,造成植物细胞膜系统的损伤[32-34]。
3.2 不同浓度镉胁迫对水蓼镉富集能力的影响
本研究表明,水蓼各器官镉含量随镉浓度的升高而显著增加,根镉含量显著高于茎叶。这表明,水蓼将镉从根部转移到地上茎叶的能力较低,根是水蓼镉的主要积累和解毒部位。这可能是植物通过根细胞质膜吸收镉,将镉吸附在细胞壁以及根的薄壁组织中,进而固定于细胞液泡中。在镉离子进入根后,抑制细胞分裂并缩短根的总长度,这可能导致植物吸收水分和营养物质的过程受损,进而导致枝条生长减弱,使金属离子从根部易位到地上部分的转运过程缓慢[35]。富集系数可以反映植物对重金属富集能力的强弱,转运系数是用来评价植物将重金属从地下部向地上部运输和富集的能力,转运系数越大,则重金属从根系向地上器官转运能力越强,说明植物能将大部分重金属迁移到地上部分,因此,富集系数和转运系数可用于评价植物在重金属修复领域的应用潜力[36]。湿地植物对镉富集和转运能力的研究已有较多报道,例如,在10 mg·L-1镉处理下,芦苇地上、地下部分富集系数为94.5和190.7,转运系数为0.496[37]。绿苋菜在1 mg·L-1镉处理下,植物地上部富集系数为17.55,地下部富集系数为33.08,转运系数为0.53[38]。在本研究中,水蓼地下部分及地上部分镉富集系数随着镉浓度呈先增加后下降的趋势。在1 mg·L-1镉浓度下处理30 d,水蓼的地上部分富集系数为45.6,地下部分富集系数为111.7,转运系数为0.41。由此可见,与常见湿地植物相比,水蓼对镉的富集系数和转运系数均比较高,特别是在外界镉浓度较低的条件下。水蓼与其他湿地植物相比,具有较强的富集能力和转运能力。
综上所述,低浓度的镉胁迫对水蓼的生长有刺激作用。当外界镉浓度增加或胁迫时间增长时,水蓼可以通过调节自身抗氧化酶系统来增加对镉毒害的耐受性,从而帮助植物抵御镉胁迫。水蓼虽然没有达到超富集植物的标准(在2 mg·L-1镉浓度下,根部镉含量>100 mg·kg-1,转运系数>1),但对镉具有较强的富集和转运能力,可以作为人工湿地的优势植物对镉污染水体进行修复。
