Apelin在急性肾损伤中对肾小管上皮线粒体的保护作用
2020-07-02王丽妍关毅鸣刁宗礼刘文虎
王丽妍 关毅鸣 刁宗礼 刘文虎
急性肾损伤(acute kidney injury, AKI)是导致终末期肾病的重要因素[1]。肾小管上皮细胞损伤是急性肾损伤的核心病理环节,而线粒体损伤近年来被认为是疾病的使动因素[2,3]。Sirt3作为线粒体重要的去乙酰化酶,参与维持线粒体结构和功能的稳定[4]。Apelin是新近发现的生物活性肽,其受体APJ属于G 蛋白偶联受体家族[5]。Apelin/APJ系统在肾脏的各部位均有分布,参与调节肾脏的正常生理功能。在肾病综合征、糖尿病肾病、高血压肾损害等疾病状态下,Apelin表达量会发生改变,可能在一定程度上参与疾病的进展[6]。笔者前期研究发现,Apelin可以延缓肾脏纤维化的进展,但在急性肾损伤中的作用尚不清楚。本课题采用顺铂刺激体外培养的近端肾小管上皮细胞模型,围绕Apelin/APJ受体——Sirt3相关信号通路,检测其对线粒体稳态的影响;采用顺铂诱导小鼠AKI模型,外源性补充Apelin,检测肾脏结构和功能的改变,从而验证上述假设。该研究为探索AKI的新治疗靶点提供理论基础和实验依据。
材料与方法
1.试剂与仪器:顺铂(美国Sigma公司)、Apelin-13(英国Bachem公司)、Trizol试剂盒(美国Invitrogen公司)、RevertAidTMFirst Strand cDNA Synthesis Kit反转录试剂盒(加拿大Fermentas公司)、Power SYBR green PCR Master Mix反应液(瑞士Roche公司)、兔抗人乙酰化赖氨酸抗体(美国Cell Signaling公司)、鼠抗人动力相关蛋白1抗体(英国Abcam公司)、鼠抗人视神经萎缩蛋白1抗体(英国Abcam公司)、辣根过氧化物酶标记IgG抗体(中杉金桥生物技术有限公司)、ELISA试剂盒(南京建成生物工程公司)。ABI Prism 7300实时荧光定量PCR仪(美国Applied Biosystems公司)、EM UC6超薄切片机(德国徕卡公司)、透射电子显微镜Tecnai Spirit 120kV(美国FEI公司)。
2.细胞培养:原代人肾小管上皮细胞购自美国ScienCell公司,经复苏后传代培养,取第3~5代用于实验。将细胞以1×105/ml的密度接种于25cm2培养瓶中,用含5%胎牛血清的上皮细胞培养基于37℃、5%CO2的培养箱中培养,待细胞生长至70%融合时弃去培养基,换用含有5μmol/L顺铂和(或)1μmol/L Apelin-13的培养基继续孵育24h。最后用0.25%胰蛋白酶消化细胞,并进行相关指标的检测。
3.动物模型的建立:8周龄雄性C57BL/6J小鼠,体质量23±2g,购自中国医学科学院实验动物研究所。饲养环境为温度22±1℃, 相对湿度(55±5)% 的SPF级动物实验室。通过一次性腹腔注射顺铂(20mg/kg)诱导AKI,从顺铂注射的次日起,每日腹腔注射Apelin-13(0.1μmol/kg)或等量0.9%氯化钠注射液(生理盐水)进行干预。设立3个实验组:正常对照组,不给予任何药物干预;顺铂+生理盐水组,实验第1天给予腹腔注射顺铂1次,实验第2~4天给予腹腔注射生理盐水,每日1次;顺铂+Apelin组,实验第1天给予腹腔注射顺铂1次,实验第2~4天给予腹腔注射Apelin-13,每日1次。实验第4天结束,给予小鼠腹腔注射戊巴比妥钠(50mg/kg)麻醉,摘眼球取血,膀胱穿刺留取尿液标本,最后将小鼠处死,取肾脏标本,用戊二醛固定。
4.RT-PCR法检测细胞去乙酰化酶Sirt3的表达:采用Trizol试剂盒提取细胞总RNA。反转录使用RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒,按说明书进行。引物由上海英骏生物技术服务有限公司合成(正向引物:5′-ACCCAGTGGCATTCCAGAC-3′,反向引物:5′-GGCTTGGGGTTGTGAAAGAAG-3′)。实时荧光定量PCR反应体系:反转录产物1μl,前后引物各1μl (10pmol/μl),Power SYBR green PCR Master Mix反应液10μl,加入去离子水至反应总体积20μl。在ABI Prism 7300实时荧光定量PCR仪上设置程序,反应参数:50℃ 2min,95℃ 10min,95℃ 15s,60℃ 1min,扩增40个循环,以GAPDH为对照。
5.Western blot法检测细胞线粒体蛋白的表达:将细胞用冷的PBS洗涤,加入组织裂解液,于4℃、12000×g离心30min,BCA法测定蛋白含量。取100μg蛋白行12% SDS-PAGE电泳,随后转移至PVDF膜上,再用5% BSA-PBST封闭1h。分别用兔抗人乙酰化赖氨酸抗体(1∶1000),鼠抗人动力相关蛋白1(dynamin-related protein 1, Drpl)抗体(1∶800)、鼠抗人视神经萎缩蛋白1(optic atrophy 1, OPA1)抗体(1∶500),于4℃孵育过夜。再用辣根过氧化物酶标记的二抗(1∶3000)于室温孵育1h。洗膜后用ECL法显色并曝光成像,应用凝胶成像系统软件对特异性条带做吸光度定量,以电压依赖性阴离子通道蛋白(voltage-dependent anion channel of mitochondrial outer membrane, VDAC)作内参,分析目的蛋白的相对表达量。
6.电镜观察小鼠肾脏线粒体形态:将肾脏标本放入2.5%戊二醛中固定过夜,之后加入1%四氧化锇固定2h。用新鲜的丙酮进行梯度脱水,环氧树脂包埋。将聚合好的包埋块修块,然后用EM UC6超薄切片机切片,每片厚度为70nm。用铺有Formvar膜的载网将切片带捞起,晾干后,用2%醋酸双氧铀溶液染色20min,再用2%柠檬酸铅溶液染色5min,最后用蒸馏水冲洗,晾干。将制备好的超薄切片载网在透射电子显微镜中进行观察。
7.ELISA法检测小鼠血浆和尿液肾损伤标志物含量:采用摘眼球法取小鼠血液标本,置于EDTA抗凝的真空采血管内,膀胱穿刺法取小鼠尿液标本。分别于4000×g离心15min,收集上清液,置于-80℃冰箱中保存。用ELISA试剂盒检测小鼠血浆Cr、BUN以及尿液Kim-1、NGAL含量,操作按试剂盒说明书进行。

结 果
1.Apelin拮抗顺铂对肾小管上皮细胞去乙酰化酶Sirt3表达的抑制作用:采用RT-PCR检测肾小管上皮细胞去乙酰化酶Sirt3 mRNA的表达量,可见与正常对照组比较,顺铂组Sirt3的表达量显著降低(P<0.05),顺铂+Apelin组Sirt3的表达较顺铂组明显升高(75.8%±8.3% vs 42.6%±9.4%,P<0.05)。采用Western blot法检测细胞乙酰化蛋白的水平,与正常对照组比较,顺铂组细胞的乙酰化蛋白含量明显升高,顺铂 +Apelin组乙酰化蛋白的含量低于顺铂组(图1)。

图1 Apelin对近端肾小管上皮细胞Sirt3表达量和线粒体蛋白乙酰化水平的影响与正常对照组比较,*P<0.05;与顺铂组比较,#P<0.05
2.Apelin改善顺铂对肾小管上皮细胞线粒体蛋白表达的影响:采用Western blot法检测肾小管上皮细胞线粒体分裂蛋白Drp1和线粒体融合蛋白OPA1的表达量。顺铂刺激细胞24h,可以使Drp1的表达量约增加至对照组的214%(P<0.05),OPA1的表达量约减少至对照组的48%(P<0.05)。Apelin可以明显抑制顺铂上调Drp1表达(152.7%±16.0% vs 214.3%±34.0%,P<0.05)、下调OPA1表达的效应(76.1%±12.9% vs 47.9%±6.0%,P<0.05,图2)。提示Apelin具体稳定线粒体结构的作用。

图2 Apelim对近端肾小管上皮细胞线粒体结构蛋白OPA1和Drp1表达量的影响
3.Apelin对顺铂诱导的AKI小鼠肾脏线粒体形态的保护作用:采用透射电镜观察小鼠近端肾小管上皮线粒体形态,可见对照组线粒体大部分膜完整,内嵴清晰,排列整齐。顺铂+生理盐水组线粒体数量显著减少,形态扭曲伴空泡变,大部分膜不完整,嵴的结构断裂甚至消失。而顺铂+Apelin组线粒体的病变程度轻于顺铂+生理盐水组,可见线粒体的数量有所减少,部分线粒体膜尚完整,内嵴尚清楚,但排列不整齐,部分线粒体发生空泡变(图3)。

图3 Apelin对顺铂诱导的AKI小鼠近端肾小管线粒体形态的影响(透射电镜,×8000)A.正常对照组;B.顺铂+生理盐水组;C.顺铂+Apelin组
4.Apelin减轻顺铂诱导AKI小鼠的肾损伤:对小鼠血浆的ELISA检测显示,顺铂+生理盐水组Cr、BUN的含量明显高于对照组,分别为Cr (80.35±7.52μmol/L vs 15.18±1.50μmol/L,P<0.05),BUN(30.70±2.42mmol/L vs 9.28±1.42mmol/L,P<0.05)。外源性补充Apelin可以使顺铂诱导的AKI小鼠肾功能有所改善,血浆Cr、BUN的含量显著降低,分别为Cr 33.70±4.65μmol/L,BUN 22.07±1.87mmol/L,与顺铂+生理盐水组比较,差异有统计学意义(P均<0.05)。对小鼠尿液的检测显示,顺铂+生理盐水组Kim-1、NGAL的含量明显高于对照组,分别为Kim-1(88.11±6.22μg/L vs 16.85±0.99μg/L,P<0.05),NGAL (112.81±15.26μg/L vs 12.67±1.02μg/L,P<0.05)。外源性补充Apelin可以使顺铂诱导的AKI小鼠肾损伤标志物的含量降低,分别为Kim-1 54.82±8.24μg/L,NGAL 58.53±7.09μg/L,与顺铂+生理盐水组比较,差异有统计学意义(P均<0.05,表1)。
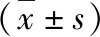
表1 各组小鼠肾损伤标志物水平的比较
与正常对照组比较,*P<0.05;与顺铂+生理盐水组比较,#P<0.05
讨 论
Apelin是新近发现的活性肽,它的受体APJ属于G 蛋白偶联受体家族。它的原前体肽由77个氨基酸组成,被分解后以多种形式的肽片段存在于体内,其中Apelin-36、Apelin-13和Apelin-12最常见。针对正常大鼠肾脏的研究显示,Apelin可以促进内皮细胞一氧化氮的释放,起到舒张入球和出球小动脉的作用,参与肾脏血流量的调节;它还能直接作用于集合管的抗利尿激素受体,参与体液平衡的调节[7]。目前,有报道显示Apelin/APJ系统可以保护线粒体,因而在一些器官损伤中发挥有益作用[8, 9]。对缺氧/复氧刺激的心肌细胞给予Apelin类似物,可以减少线粒体活性氧的产生,抑制心肌细胞凋亡[10]。同样,在心脏缺血再灌注损伤的动物模型中,外源性补充Apelin可以延迟线粒体通透性转换孔的开放,起到保护心肌的作用[11]。但在不同组织器官或不同病理状态下,Apelin/APJ系统的生物学效应存在差异,有时甚至起到完全相反的作用。针对器官纤维化的研究曾发现,该系统会促进肝纤维化的发生,而对心肌纤维化具有抑制作用。
笔者既往的研究证实了Apelin通过激活蛋白激酶Cε(protein kinase Cε, PKCε),进而抑制转化生长因子β(transforming growth factor β, TGF-β)/Smads信号通路,可以减轻肾脏纤维化[12]。然而,最近有文献报道,在急性肾缺血的动物模型中,PKCε的活化可能是导致线粒体损伤的因素[13]。由于临床上很多CKD是由AKI转化而来的,但AKI的致病因素又和CKD不同,往往是较为短暂而强烈的刺激,其病理机制也不同于慢性纤维化时肾小管上皮-间充质转分化,而是以近端肾小管的线粒体损伤为核心环节。因此,AKI时Apelin能否保护肾小管上皮细胞线粒体,起到减轻肾损伤的作用,目前尚无明确报道。
本研究建立了顺铂诱导AKI的小鼠模型,该模型是研究非免疫性急性肾损伤的成熟动物模型。在注射顺铂后,可以观察到实验组小鼠近端肾小管上皮线粒体出现明显的损伤表现,数量显著减少且形态结构不完整,与既往的研究结果一致[14]。而每日腹腔注射Apelin能减轻上述病理变化,提示Apelin在AKI时对线粒体具有一定的保护作用。通过对小鼠血浆、尿液标志物的检测,笔者观察到顺铂组小鼠血浆中反应肾功能的Cr、BUN明显升高,尿液中提示早期肾损伤的Kim-1、NGAL也明显高于正常对照组。通过外源性补充Apelin能够改善上述指标的变化,因此可以认为AKI时Apelin在整体水平具有减轻肾脏损伤的生物学效应。
通过顺铂刺激体外培养的肾小管上皮细胞模型,笔者对Apelin保护线粒体的机制进行了初步探讨。目前研究认为,线粒体作为一种双层膜结构的细胞器,不断进行着分裂和融合,其动态平衡会影响线粒体的功能[15, 16]。在横纹肌溶解致AKI的大鼠模型中观察到,肾小管上皮细胞分裂蛋白Drp1的聚集增多,伴随线粒体断裂、ATP生成减少和ROS的释放,给予线粒体分裂抑制剂1(Mdivi-1)可以有效抑制Drp1的聚集,维持线粒体的正常功能[17]。而线粒体蛋白的翻译后修饰与线粒体稳态的调节密切相关,其中去乙酰化酶Sirt3发挥着重要的作用。它是哺乳动物Sirtuin蛋白家族成员,属于烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶类。目前共发现7个Sirtuin家族成员(Sirt1~7),其中Sirt3主要定位于线粒体。Sirt3基因敲除小鼠线粒体多种蛋白的乙酰化水平增加,导致线粒体功能紊乱,最终引起细胞凋亡和组织损伤[18]。本研究观察到,向体外培养的肾小管上皮细胞中加入顺铂,会显著降低Sirt3的表达,引起细胞乙酰化蛋白水平增加,进而使线粒体分裂蛋白Drp1表达增加,线粒体融合蛋白OPA1表达降低,提示线粒体损伤的发生。当给予Apelin共同孵育时,顺铂下调Sirt3表达的作用受到抑制,细胞乙酰化蛋白的水平也有所降低,Drp1和OPA1的表达趋于正常。上述结果证明,Apelin通过促进去乙酰化酶Sirt3的表达,维持线粒体结构的稳定,从而拮抗顺铂对线粒体的损伤。
近年来研究发现,活化G蛋白偶联受体——胆汁酸受体TGR5,可以增加过氧化物酶体增生物激活受体 γ 辅激活因子-1α(PGC-1α)和雌激素相关受体α(ERRα)的表达,二者均为 Sirt3的上游信号分子。ERRα能结合到Sirt3的启动子区,且PGC-1α可以增强其结合能力,它们协同作用能够促进Sirt3的表达[19]。由此笔者推测,同样属于G蛋白偶联受体家族的APJ,在AKI时Apelin可能也通过活化上述信号通路增加Sitr3的表达,进而起到保护肾小管上皮细胞线粒体、减轻肾损伤的作用。由于人体是十分复杂的有机体,仅凭上述简单的细胞和动物模型无法完全了解Apelin/APJ系统与AKI发生和发展之间的关系,尚需开展进一步的分子生物学实验对相关机制做深入探讨。
综上所述,本研究证实了多肽Apelin在顺铂诱导的AKI中具有一定的肾脏保护作用,并初步阐明Apelin通过调节去乙酰化酶Sirt3,维持肾小管上皮细胞线粒体稳态,从而减轻肾脏损伤的分子生物学机制。
