棘白菌素类抗真菌药物的耐药机制分析*
2020-07-02张灵,杨勇
张 灵,杨 勇
(1. 电子科技大学医学院·个体化药物治疗四川省重点实验室,四川 成都 611731; 2. 四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
目前,全球真菌年感染例次超100 万,且感染率仍在不断升高,艾滋病、癌症患者在晚期易受真菌感染。治疗侵入性真菌感染一般要用抗真菌药物,包括唑类、棘白菌素类等,但长期用药易引发耐药风险。光滑念珠菌在念珠菌感染中属重要病原菌,耐药性高,多以棘白菌素类相关的抗菌药物(如米卡芬净)等抑制。近年来棘白菌素治疗失败及念珠菌暴发感染的病例时有报道,棘白菌素耐药率不断升高,特别是长期接受治疗的危重患者。在此,对其耐药机制的相关研究进行了综述,现报道如下。
1 药物简介
常用药物包括卡泊芬净、阿尼芬净等,从组分看属新型脂肽类化合物,目前在临床广泛应用,由于微生物的来源不同,适用范围各异,且脂肪酸链也各有不同。
棘白菌素类药物为广谱抗菌药物,可有效阻碍真菌细胞壁β-1,3- D-葡聚糖合成,抑制真菌生长代谢,并促使真菌溶解死亡。美国食品和药物管理局(FDA)发现,该类药对念珠菌血症的疗效确切,敏感性高,且不会引发明显的不良反应,推荐用于侵入性念珠菌感染的治疗;还发现其对造血干细胞移植患者可起到一定预防感染的作用,且疗效明显优于唑类药物,患者病情很严重并对唑类药物有抗性的情况下,可优先选择棘白菌素类药物治疗[1]。
临床研究表明,棘白菌素类药物口服生物利用度不高,在实际应用中主要选择效率更高的静脉注射给药。该类药与血清蛋白结合率为97% ~99.8%,在人体组织中广泛分布。
棘白菌素类药物对大多数念珠菌属有活性,体外环境中也可取得良好的灭菌效果,但对曲霉菌只有轻微抑制作用。该类药物可在裂解基础上改变菌丝的形态而杀菌。棘白菌素类药物无法有效抑制毛霉菌属、隐球菌属相关真菌,但对光滑念珠菌活性很高,而在抗菌方面其机制和唑类药物有差异[2],高度唑类抗性菌株中存在一定外排底物,与其抗药性密切相关[2]。棘白菌素的疗效指数高,由于人体欠缺该类型葡聚糖合成酶,对大部分患者的安全性均较高,肝毒性与肾毒性较低,另外在使用过程中药效平稳,故在临床使用广泛。
2 真菌耐药机制
棘白菌素类药物耐药性的受重视程度比其他抗真菌药物弱,耐药机制的研究有限,相关的参考资料也有较大缺失。棘白菌素类抗真菌药物的耐药机制在细胞层面及基因层面均表现出特异性,相关研究可从这些方面入手。
目前,真菌耐药的形势严峻,常见机制包括Fks1 介导的耐药机制、高剂量水平下的突破生长、细胞应激反应、内源性机制等。尽管棘白菌素类药物安全性较高,但也发现了一定的心脏毒性[3]。在抗真菌药物中,棘白菌素类占据了重要地位。有研究发现,FKS 突变与耐药密切相关,因而棘白菌素的敏感性就可通过检测这种基因的突变性而确定。
3 棘白菌素类可能的耐药机制
3.1 Fks1 介导的耐药机制
3.1.1 Fks1 突变导致白色念珠菌敏感性降低
DENNING[4]研究发现,白色念珠菌的抗药性可能和基因突变相关,而在一些针对该类真菌的遗传试验中也发现,Fks1 可能为一种靶点,而Fks1 为由Fks1 编码的一种酶的亚基,在菌株Fks1 突变情况下可有效耐受脂肽类抗菌药物,达到很高的耐药性。推断在这种基因突变影响下,棘白菌素类药物对白色念珠菌的抗菌效果显著降低[3]。一些学者在研究中检测分析了该类真菌的基因突变情况,结果Fks1 的2个区域出现了点突变,相关氨基酸区也产生了一定改变。与此相关的突变主要分为S645P 和S645F 等,且在易感菌株中该区域突变情况下,对应菌株耐压性升高,导致棘白菌素类药物的抗菌效果显著降低。而这种药物活性的降低是否是因为该区域含这类药物的结合区,目前尚无定论。
Fks1 的F639I 在酵母菌中的作用相同,对比分析发现其机制也类似。由此可判断,HS 区域的突变对该药物的耐药产生明显影响。同一患者各处采集的菌株存在一定差异,这些菌株的Fks1 突变不一致,不过在这种突变影响下都会产生耐药性。多位点序列研究结果表明,这些突变菌株的表型无明显差异性,耐药性的影响因素复杂,多种环境或因素都可引发[5]。WIEDERHOLD 等[6]选择相关的合成酶为对象进行分析,所得结果促进了对Fks1 突变和耐药性的研究。研究发现,HS 突变会降低其药物敏感性[5]。对比分析结果表明,卡泊芬净对S645P突变酶的抑制浓度显著升高;在HS1 区C 位末端突变情况下获得的酶,其耐药性明显低于其他突变[6]。
此外,耐药性也和单一的Fks1 突变相关,由此可判断出HS 区域突变很大可能为显性,而其纯合子的突变会引发耐药性。BOWMAN 等[7]选择鼠感染模型进行模拟研究,所得结果基本一致。有研究对比分析了2个等位基因都产生突变的分离株,结果99%的个体产生效应的剂量( ED99)增幅最大可到野生型的1000 倍;对应的杂合子的ED99增幅最大可到野生型的70 倍[8]。表明通过动物模型可对其纯合子和杂合子进行高效区分,也可在此基础上对该细菌的敏感性进行评价。通过临床抗性的氨基酸变化谱(见表1)可明确基因类型。
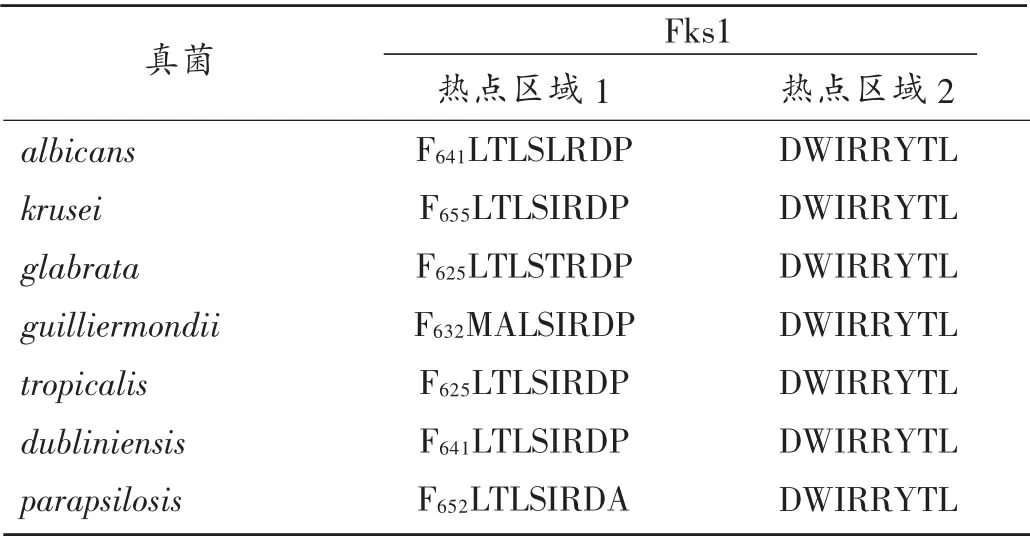
表1 赋予临床抗性的Fks 氨基酸变化谱
3.1.2 Fks1 机制导致其他念珠菌敏感性降低
从患者体内采集获得的耐药性菌株,对应的耐药机制均与Fks1 机制有关,如都柏林念珠菌等[9]。进一步研究发现,该类菌株对棘白菌素类的耐药性基本一致,且耐药机制相同,并在HS 区域也发现了明显的基因突变。在Fks2 的HS1 突变情况下,光滑念珠菌也表现出一定耐药性,针对克柔念珠菌的检测结果表明,耐药菌株中出现了HS1 突变[9]。该结论也证明了HS 区域突变相关的葡聚糖合成酶的药物敏感性降低,其耐药机制可能如此。该类药物对平滑念珠菌相关感染的效果显著,最低抑菌浓度(MIC)更高(0.5 ~8.0 μg/mL),且明显高于同类型真菌。进一步分析发现,这种差异很有可能与Fks1 HS1/HS2 区域的氨基酸多态性相关。
在近平滑念珠菌中,Pro649 氨基酸表现出随机多态性,对比分析结果表明,该种真菌中同样存在相应P649A 多态性,而对比发现其敏感性有一定降低。试验结果表明,其HS2 区域中同时还存在I1359V 多态性,在此因素影响下,相应的MIC 更高[10]。可见,非白色念珠菌的这种耐药性大部分都和HS1 和HS2 区域突变引发的fks1 多态性相关,可据此解释其耐药性。
3.1.3 Fks1 机制导致曲霉菌敏感性降低
MORRISON 等[11]针对烟曲霉进行了研究,检测到该类耐药性,并通过基因技术将白色念珠菌Fks1-S645Y 突变导入到烟曲霉中进行对照分析,发现菌株药物敏感性显著下降,但该耐药性仅在试验条件下存在,其他情况尚不明确。
3.2 高剂量水平下的突破生长
突破生长属特定的生长模式,为敏感菌株在显著超过MIC 的药物浓度条件下的生长。研究发现,该类生长可能和细胞适应性有关,并非和fks1 突变相关,和药物敏感性改变无相关性[12]。白色念珠菌生长后,相应细胞壁中的壳多糖组分占比大幅提高[13]。可见,该生长现象可能为细胞对抗菌药物治疗相关的β-(1,3)- D-葡聚糖减少症的代偿机制。MILLER 等[14]建立了鼠科肺部曲霉病模型,发现模型动物体内的菌株也存在该类生长现象,而临床未观察到类似现象,推测可能只有在实验室条件下存在,侧面说明同时存在其他类型耐药性机制。
3.3 细胞应激反应
NIIMI 等[15]的研究中设置了1个酵母敲除突变株库,以分析这类细菌调节敏感性的途径和模式,结果显示,敲除基因后药物敏感性提高。而与此相关的基因功能涉及磷脂肌醇信号途径(PKC)完整性、麦角固醇合成、转录调控,敲除和信号转换等有关环节,相应敏感性会有一定下降。BACHMANN 等[16]的研究结果表明,敲除52个基因或这种菌株可大幅提高对卡泊芬净的敏感性,而敲除39个基因的效果相反。sbe2 属高尔基体蛋白基因,与细胞壁成分的合成关系密切,其表达水平过高会引发低水平的抗性。可见,复杂途径网络可改变细胞对该类药物的敏感性[17],不过细菌的抗性是适度的,对其机制分析发现,此种抗性可视为细胞耐受性,即在一定环境压力条件下,细胞生理上进行调节而适应环境,但和耐药性并不等同。
细胞壁的合成和修复对于细胞的生长代谢有重要意义,在此过程中基因起着重要的调节作用,决定了细胞壁的合成速度,在不同细胞压力条件下细胞壁会产生对应的应激反应。真菌细胞壁合成过程中,由于会大量出现相应的聚合体,该类物质和细胞修复密切相关,也会多次出现修饰现象,频发重排现象。棘白菌素类药物在使用后可有效抑制真菌的细胞壁合成,阻碍了真菌生长代谢,且据此实现杀菌效果。葡聚糖合成酶可催化β-(1,3)- D-葡聚糖的合成,后者为细胞壁的主要成分,属耐药性的靶点,其包括催化亚基Fks1(或Fks2)与激活因子Rho1。Rho1 可通过调节作用大幅提高葡聚糖合成酶的活性,进一步分析还发现其和细胞壁的合成也紧密相关,且调节路径可能为细胞完整性[18]。外界刺激影响下会产生细胞壁应激,该应激可通过受体Wsc1 介导产生复杂的次级交互作用。相关研究发现,钙调磷酸酶基于Crz1 对Fks1 产生一定影响[19]。还有壳多糖合成酶基因chs1/2/3/8 的调整。转录因子Rlm1 可调节PKC水平,同时也影响细胞壁相关基因的表达。Wsc1 与卡泊芬净相关的细胞壁损伤有关,可使肽Slt2 处于激活状态,后者可促使保护应答,对细胞壁的合成起到调节和控制作用。研究发现,β-(1,3)- D-葡聚糖的装配亚基主要有β-(1,3)- D-葡聚糖合成酶,和这些亚基相关的基因fks1,与对细胞壁极化产生调节作用的基因相连而产生一定结构的途径网络[20]。该网络可对来自棘白菌素类药物的压力刺激进行调节,影响药物敏感性。基因组的药物敏感性研究结果表明[21],在卡泊芬净刺激下,和细胞壁合成相关的基因表达有一定改变,但差异很小。这种耐受性和PKC 途径密切相关。
3.4 内源性耐药机制
目前常见的真菌包括有镰刀菌属、接合菌等,研究发现,该类真菌均存在一定内源性耐药性,定量分析表明其MIC 超过16 μg/mL[22]。目前关于该内源性耐药机制的研究尚无明确结果。从体外分析结果来看,这几种类型的葡聚糖合成酶对卡泊芬净敏感性很高,表明该类型耐药和靶位不相关[8]。曾凤群等[23]通过形态学终点分析法进行的最低效应浓度研究结果表明,曲霉菌等对卡泊芬净有很强的敏感性。由此也可判断,上述几种类型的霉菌中含有一些和Fks1 存在明显差异性的耐药机制。可见,这类型真菌的耐药性机制相对复杂,需满足一定前提条件,在达到一定活性位点的情况下,才会导致耐药性。其他如药物修饰的作用途径尚未被证实,但也可能起了一定作用。
4 结语
棘白菌素类药物的耐药机制复杂且与多种因素相关。一些关于光滑念珠菌菌株的研究表明,在不规范用药等因素影响下,该类药物也开始表现出较高的多药耐药性[23]。稳定耐药性的FKS 机制已被深入研究,以后的研究中应明确遗传因素和FKS 突变的相关性,为抑制该类耐药性提供支持。真菌细胞在一定的代偿途径下会出现很强的应激反应,可在此基础上有效提高对药物的反应,且利用一些特征性的FKS 热点突变而实现耐药。简言之,耐药性的影响因素主要有药物长期暴露、宿主微生物库形成等,为有效应对耐药性问题,需开展相关抗药性试验以利于更好地诊断,且对治疗方案和用药剂量进行优化,从而应对耐药性问题。
细胞应答与适应机制也可对这种耐药性产生影响,不过关于fks1 突变机制相关耐药性尚不确定,很少产生由于棘白菌素耐药相关的无效病例,因而尚未引起重视。但随着该类药物的不断使用,其引发的问题也会持续表现。故有必要对该类耐药机制进行深入研究,为提高其临床疗效提供支持。同时,还需规范抗真菌药物的合理使用,不断优化用药方案,尽可能降低药物使用频率,从而减缓真菌对棘白菌素类药物耐药的发生。
