乌苯美司联合FOLFOX4 方案治疗原发性胃癌近期疗效评价*
2020-07-02张永健郭学海高秀凤赵宏阳
王 斌,张永健,郭学海,高秀凤,赵宏阳
(开滦总医院林西医院,河北 唐山 063103)
原发性胃癌癌变主要起源于胃黏膜上皮细胞恶性增生,进而浸润到整个胃部组织。早期胃癌发病并无明显症状,少数出现恶心呕吐等消化道症状而易被忽视,常被漏诊或误诊[1]。确诊时多已处于中晚期,此时应以控制肿瘤病灶、延缓病情进展和改善预后为主要目的[2-3]。化学治疗(简称化疗)是胃癌治疗的常规手段,其中FOLFOX4 方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)最常用,临床多用于降低胃癌分期、控制病灶大小[4]。多种化疗药物联用,存在明显毒副作用,损伤机体正常组织,减弱机体免疫功能,故在化疗期间有必要给予辅助治疗。乌苯美司,在各型肿瘤的辅助治疗中可提高机体免疫力,改善预后[5]。S 期激酶相关蛋白2(Skp2)与细胞周期蛋白依赖性激酶抑制蛋白(P27kipl)表达与胃癌病情进展相关,可为病情监测、疗效评估提供依据[6]。本研究中观察了FOLFOX4 方案联合乌苯美司治疗原发性胃癌的临床疗效及对患者Skp2 和P27kipl 蛋白表达的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:经CT、核磁共振(MRI)、组织病理学检查确诊,且符合日本《胃癌治疗指南》(第5 版)诊断标准[7];卡氏评分不低于60 分;预计生存周期长于6个月;对本研究拟用药物无严重过敏史。本研究内容符合《赫尔辛基医学宣言》中的伦理学要求,患者家属对本研究知情同意。
排除标准:严重心、肝、肾功能不全;精神状态、认知功能异常,不能配合治疗;入组前已接受其他治疗;治疗期间并发自身免疫性疾病、炎性疾病。
脱落剔除标准:中途自愿退出本研究;随访期间失访;未按治疗方案连续接受治疗;检测结果缺失或不完善。
病例选择与分组:选取医院2015年6月至2018年6月收治的原发性胃癌患者98 例,按住院先后顺序进行编号,奇数号纳入观察组,偶数号纳入对照组,各49 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
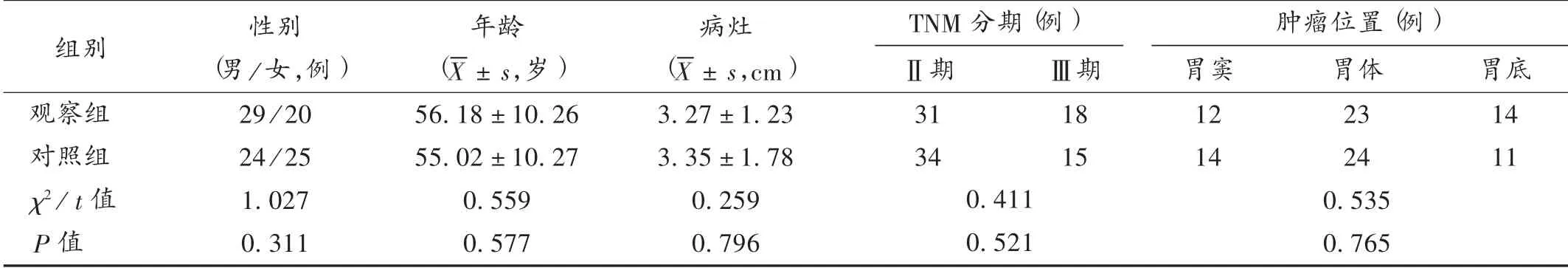
表1 两组患者一般资料比较(n =49)
1.2 方法
两组患者均予FOLFOX4 方案治疗,即第1 天予注射用奥沙利铂(江苏恒瑞医药股份有限公司,国药准字H20000337,规格为每支50 mg)85 mg/m2,加入250 mL 5%葡萄糖注射液中,静脉滴注2 h;第1,2 天予注射用亚叶酸钙(悦康药业集团有限公司,国药准字H20044158,规格为每支按C20H23N7O7计100 mg)200 mg/m2,加入250 mL 0.9% 氯化钠注射液中,静脉滴注;第1,2 天和第14 天予注射用氟尿嘧啶(山西普德药业股份有限公司,国药准字H20051113,规格为每支250 mg)400 mg/m2,加入500 mL 0.9% 氯化钠注射液中,静脉滴注20 h。观察组患者加服乌苯美司胶囊(成都苑东生物制药股份有限公司,国药准字H20094031,规格为每粒10 mg),每次3 粒,每日1 次。两组患者均以4 周为1个治疗周期,连续治疗3个周期。
1.3 观察指标及疗效判定标准
观察指标:治疗前后采集患者空腹静脉血各5 mL,离心,分离得血清。采用Attune NxT 型流式细胞仪(美国Thermo Fisher 公司)检测患者血清中免疫功能指标细胞的阳性率,并计算以酶联免疫吸附法,采用SpectraMax Paradigm 型全自动多功能酶标仪(美谷分子仪器有限公司)检测患者血清中Skp2 和P27kipl 水平,试剂盒均购于北京奥维亚生物技术有限公司,严格按说明书操作。
近期疗效判定[8]:完全缓解(CR),病灶完全消失持续超过1个月,各项生命指标检查均正常;部分缓解(PR),病灶减少不少于50%,持续超过1个月,各项生命指标检测有显著改善,接近正常值;稳定(SD),病灶缩小不超过50%,增大不超过25%,持续超过1个月,各项检测指标有一定改善;进展(PD),病灶增大超过25%,生命体征指标进一步恶化。总有效=CR +PR。
安全性:观察患者治疗期间恶心呕吐、脱发、消化道出血、骨髓抑制等不良反应发生情况。
1.4 统计学处理
2 结果
结果见表2 至表5。
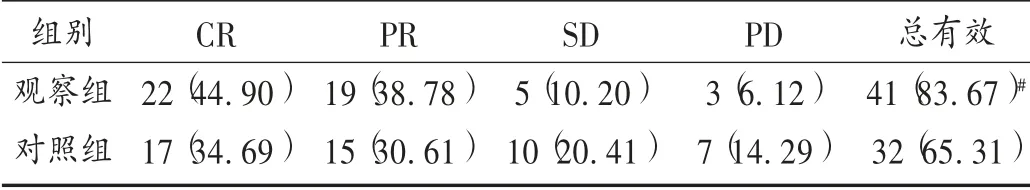
表2 两组患者近期临床疗效比较[例(%),n =49]
表3 两组患者肿瘤相关蛋白水平比较(±s,n =49)
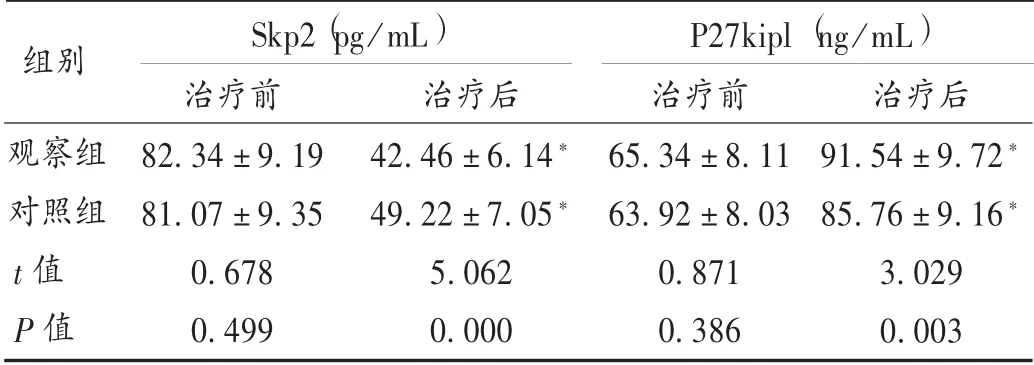
表3 两组患者肿瘤相关蛋白水平比较(±s,n =49)
注:与本组治疗前比较,*P<0.05。表5 同。
组别Skp2(pg/mL) P27kipl(ng/mL)观察组对照组t 值P 值治疗前82.34±9.1981.07±9.350.6780.499治疗后42.46±6.14*49.22±7.05*5.0620.000治疗前65.34±8.1163.92±8.030.8710.386治疗后91.54±9.72*85.76±9.16*3.0290.003
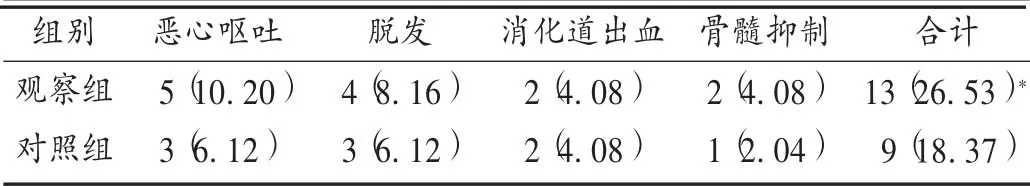
表4 两组患者不良反应发生情况比较[例(%),n =49]
3 讨论
原发性胃癌是我国最常见的恶性肿瘤,每年有大量的患者因其死亡。中晚期胃癌患者的癌细胞迅速进展和转移,难以对其实施根治性手术,临床常采取化疗。FOLFOX4 方案包括奥沙利铂、亚叶酸钙、氟尿嘧啶3 种化疗药物[9]。奥沙利铂为第3 代铂类抗肿瘤药物,通过作用于细胞的DNA 而抑制癌细胞的生长增殖,与顺铂、卡铂等比较,对癌细胞靶点的作用更强、起效更快。氟尿嘧啶主要作用于细胞S 期,抑制癌细胞的合成和增殖。亚叶酸钙增强了氟尿嘧啶在体内的代谢物活性,从而增强了氟尿嘧啶在体内的细胞毒作用[10]。因此,该方案可良好地控制肿瘤病灶,也成了临床胃癌化疗的首选方案。但FOLFOX4 方案中多种化疗药物的合用,在增强疗效的同时也增加了毒副作用,会损伤机体正常细胞及免疫功能[11]。因此,在化疗期间应给予相应辅助治疗。近些年乌苯美司在肿瘤的辅助治疗中发挥了良好的效果。
表5 两组患者免疫功能指标比较(±s,n =49)
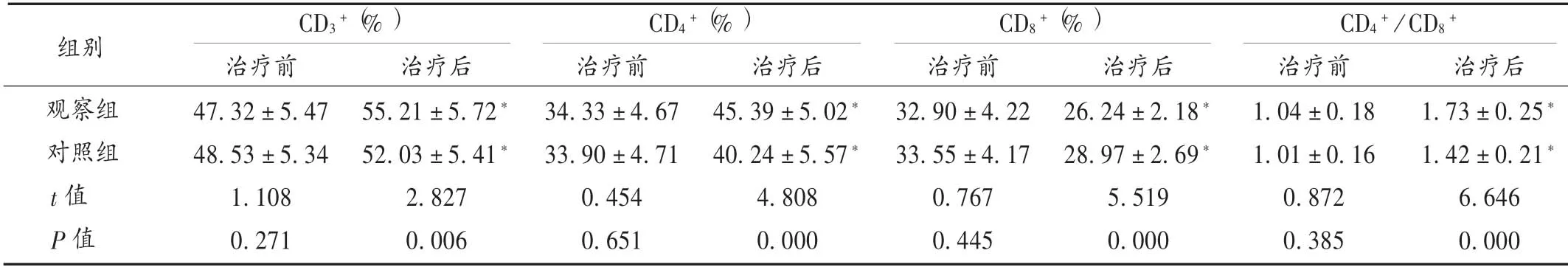
表5 两组患者免疫功能指标比较(±s,n =49)
组别CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+观察组对照组t 值P 值治疗前47.32±5.4748.53±5.341.1080.271治疗后55.21±5.72*52.03±5.41*2.8270.006治疗前34.33±4.6733.90±4.710.4540.651治疗后45.39±5.02*40.24±5.57*4.8080.000治疗前32.90±4.2233.55±4.170.7670.445治疗后26.24±2.18*28.97±2.69*5.5190.000治疗前1.04±0.181.01±0.160.8720.385治疗后1.73±0.25*1.42±0.21*6.6460.000
本研究中,相比于对照组,观察组临床疗效得到了进一步提升,表明乌苯美司能进一步提高胃癌的化疗效果,抑制病灶,控制病情进展。乌苯美司是高效免疫调节剂,是从链霉菌属中培养分离得到的二肽类化合物,可强效抑制氨基肽酶活性,并与癌细胞上的氨基肽酶位点结合,从而抑制癌症细胞的正常生长、繁殖,促进其凋亡[12]。另外,乌苯美司还能特异性地作用于淋巴细胞和单核巨噬细胞,加速对癌细胞的吞噬,从而进一步缩小肿瘤病灶,延缓癌细胞的增殖扩散[13]。观察组患者的CD3+和CD4+阳性率,CD4+/CD8+均高于对照组,CD8+阳性率低于对照组,充分表明乌苯美司对胃癌患者的免疫功能具有保护作用。其原因为乌苯美司可阻断肿瘤细胞CD13的细胞活性,增强白细胞介素的敏感性,从而增强T 淋巴细胞功能,刺激吞噬细胞和骨髓干细胞发挥免疫防御功能,恢复重建损伤的免疫功能[14]。Skp2 在各种肿瘤细胞中呈高表达状态,是调控肿瘤细胞转化、增殖的重要蛋白,Skp2 表达水平升高,提示癌细胞进展快,易发生转移和复发[15]。P27kipl 在肿瘤的进展过程中呈异常表达,通过调节肿瘤细胞周期蛋白依赖性激酶的阈值而抑制其增殖,是一种重要的抑癌基因蛋白,在胃癌患者机体中呈低表达状态[16]。因此,通过对Skp2 和P27kipl 表达水平的判断可评估胃癌的治疗效果。本研究中,观察组Skp2 水平低于对照组,P27kipl 水平高于对照组,表明乌苯美司对胃癌化疗的辅助效果较好,能调节Skp2 和P27kipl 水平。此外,观察组加用乌苯美司治疗,不良反应未明显增加。
综上所述,乌苯美司联合FOLFOX4 方案治疗原发性胃癌,能提升患者的免疫功能,调节Skp2 与P27kipl水平。
