外周血异基因造血干细胞移植治疗急性白血病疗效分析*
2020-07-02岑雪波罗小华张红宾唐晓琼
岑雪波,肖 函,罗小华,王 欣,肖 青,张红宾,唐晓琼,刘 林,王 利
(重庆医科大学附属第一医院血液内科,重庆 400016)
白血病是造血干细胞的恶性克隆性病变,若骨髓白血病细胞停滞并累积在原始及早期阶段至一定数量,则称为急性白血病。目前,针对急性白血病的治疗手段中,异基因造血干细胞移植除药物杀伤作用外,亦具有移植物抗白血病效应,可降低其复发率,但移植后可能出现移植物抗宿主病(GVHD)或感染等并发症,导致移植相关死亡率上升,影响预后。为评价异基因造血干细胞移植治疗急性白血病的效果,对2014年12月至2018年12月在我院予异基因造血干细胞移植的97 例急性白血病患者的临床资料进行回顾性研究,同时对影响其预后的相关因素进行分析。现报道如下。
1 资料与方法
1.1 研究对象
选取2014年12月至2018年12月于我科行外周血异基因造血干细胞移植的急性白血病患者97 例。其中男47 例,女50 例;年龄12 ~58 岁,平均28 岁;急性髓系白血病(AML)63 例,急性淋巴细胞白血病(ALL)33 例,急性混合型白血病1 例;高危58 例,标危39 例。对于AML 患者,有以下不良因素为高危:年龄>60 岁;初诊时外周血白细胞计数≥30×109/L;形态学亚 型 不 佳(M0,M5,M6,M7);不 良 核 型[5q-;-7;11q23;inv(3);t(6;9)];继发于骨髓增生异常综合征(MDS)或治疗相关AML;移植前未达完全缓解;二次以上完全缓解。对于ALL 患者,有以下不良因素为高危:年龄>10 岁;初诊时外周血白细胞计数≥50×109/L;不良核型[t(9;22),t(4;11),t(1;19)];免疫分型不佳(CD34+ALL);移植前未达完全缓解程度;2 次以上完全缓解。
1.2 方法
1.2.1 健康供者干细胞采集
健康供者均采用重组人粒细胞集落刺激因子(G-CSF)5 ~10 μg/(kg·d)皮下注射,连续使用4 ~5 d之后采用血液成分分离机采集外周血造血干细胞,循环血量每次10000 ~12000 mL,每日1 次,共采集2 次,采集前2 h 皮下注射5 ~10 μg/kg。
1.2.2 预处理方案
97 例患者均采用清髓性预处理方案。供受者亲缘人类白细胞抗原(HLA)配型全相合移植预处理多数采用BuCy 方案:白消安(Bu),-7 ~-4 d,0.8 mg/(kg·6 h);环磷酰胺(CY),-3 ~-2 d,60 mg/(kg·d)。供受者HLA 不全相合或非亲缘全相合则多采用FLAG +BuCy +ATG 方案:氟达拉滨(Flu),-10 ~-7 d,30 mg/(m2·d);阿糖胞苷(Ara-C),-10 ~-7 d,2 g/(m2·d);白消安(Bu),-6 ~-4 d,3.2 mg/(kg·6 h);环磷酰胺(CY),-3 ~-2 d,1.8 g/(m2·d);抗胸腺免疫球蛋白(ATG),-3 ~-1 d,2.5 ~3.5 mg/(kg·d)。部分患者增加卡莫司汀、阿糖胞苷、去甲氧柔红霉素、依托泊苷或地西他滨等化疗药物,方案有所调整。
1.2.3 干细胞移植
97 例患者均采用G-CSF 动员的外周血干细胞为回输物,中位回输单个核细胞数为(7.15 ~33.52)×108/(L·kg),平 均15.42×108/ (L·kg);CD34+细 胞 数 为(1.66 ~11.84)×106/(L·kg),平均6.84×106/ (L·kg)。
1.2.4 GVHD 的诊断及预防
采用西雅图Glucksberg 标准[1-3],Ⅲ~Ⅳ度急性移植物抗宿主病(aGVHD)视为重度aGVHD。所有接受异基因造血干细胞移植的患者均予经典环孢素A(CsA)+短疗程甲氨蝶呤(MTX)+吗替麦考酚酯(MMF)方案预防GVHD 的发生。具体方法:1)移植前1 天开始予环孢素2.5 mg/(kg·d)静脉滴注,血药浓度每周监测2 次并维持在150 ~250 μg/L,根据血药浓度调整用量,移植结束30 d 后逐渐过渡至口服给药;2)移植后第1 天予15 mg/m2MTX 静脉滴注,移植后第3,6,11 天调整剂量为10 mg/m2静脉滴注;3)移植后第1 ~40 天均予MMF 口服,每次0.5 mg,每日2 次。部分患者输注间充质干细胞预防GVHD。
1.2.5 肝静脉阻塞病(VOD)的诊断与预防
采用西雅图标准[4-5],移植后的前20 d 内至少满足以下2 项,1)胆红素>2 mg/dL;2)右上腹疼痛或肝大;3)不能解释的体质量增加(>2%基础体质量)。所有移植患者均予复方丹参注射液20 mL/d、低分子量右旋糖酐500 mL/d 静脉滴注,血小板低于20×109/L 时停用;皮下注射低分子肝素0.2 mL,每12 h 给药1 次,移植后第20 天停用,静脉滴注前列地尔10 μg,每12 h 给药1 次,移植后第30 天停用。
1.2.6 预防感染
所有移植患者均药浴后入层流病房,并使用呋喃西林滴鼻和左氧氟沙星滴眼预防感染,在移植前1 周左右开始口服左氧氟沙星200 mg,每日2 次,预防细菌感染;复方磺胺甲唑2 片,每日2 次,每周用药2 d,预防卡氏肺孢子虫感染;口服制霉菌素片1 MIU,每日3 次,预防真菌感染;预处理第1 天至移植当天予更昔洛韦250 mg/d,之后继续在造血重建早期予膦甲酸钠2.5 g静脉滴注,每12 h 给药1 次;在移植后第1,11,21 天(或移植后第1,8,15,22 天)分别静脉滴注人免疫球蛋白20 g。所有患者于移植后第1 天给予G-CSF 皮下注射激活造血功能。
1.2.7 细胞植入指标检测
连续3 d 中性粒细胞绝对值(ANC)≥0.5×109/L为中性粒细胞植活,其中第1 天为达到临床植活时间。脱离血小板输注连续7 d,血小板计数≥20×109/L 为血小板植活,其中第1 天为达到临床植活时间。移植后第21 天行骨髓穿刺,用短串联重复序列聚合酶链反应(STR-PCR)法鉴定植活。
1.3 统计学处理
采用SPSS 22.0 统计学软件分析。生存分析采用Kaplan-Meier 法,进行Log-rank 检验,P<0.05 为差异有统计学意义。危险因素分析应用COX 比例风险回归,单因素分析P 值小于0.2 的危险因素纳入多因素分析。移植0 d 定义为造血干细胞输注当天,移植后累计生存时间以该天为起点,以患者的复发、死亡或随访结束为终点,随访时间截至2019年10月1日。
2 结果
2.1 造血重建
异基因造血干细胞移植患者中性粒细胞计数恢复至0.5×109/L 的中位天数为13 d(9 ~30 d);1 例未植入;血小板稳定恢复至20×109/L 的中位天数为14 d(9 ~40 d),3 例未植入。由于STR-PCR 结果外送检验,结果保存不完善,故不纳入统计分析。
2.2 疗效分析
早期疗效分析(移植后100 d 内):97 例异基因移植患者中存活90 例(92.78%),死亡7 例(其中2 例死于颅内出血,2 例死于aGVHD,3 例死于感染性休克);共出现黏膜炎87 例(发生率89.69%),出血性膀胱炎32 例(发生率32.99%);临床诊断粒细胞缺乏伴感染75 例,其中40 例合并真菌感染,9 例合并病毒感染;肝静脉阻塞综合征2 例(发生率2.06%);aGVHD 10 例(发生率10.31%),其中重度aGVHD 4 例;血栓性微血管病2 例(发生率2.06%)。
长期疗效分析:90 例异体移植患者中位随访时间12个月(3 ~54个月),随访时间至2019年10月1日有74 例存活,其中65 例为无病存活。复发16 例(17.78%),中位复发时间为7个月(2 ~19个月)。2 例复发病例治疗后取得再次缓解,8 例复发病例带病存活。死亡16 例,其中死于多脏器功能损害5 例,呼吸衰竭6 例,肝衰竭、中枢性白血病、消化道出血、颅内出血各1 例。慢性移植物抗宿主病(cGVHD)17 例,其中广泛的有6 例。本组随访时间1年以上48 例,3年以上12 例;随访期末3年总体生存率(OS)及无病生存率(DFS)分别为63.5%和58.5%。详见图1。
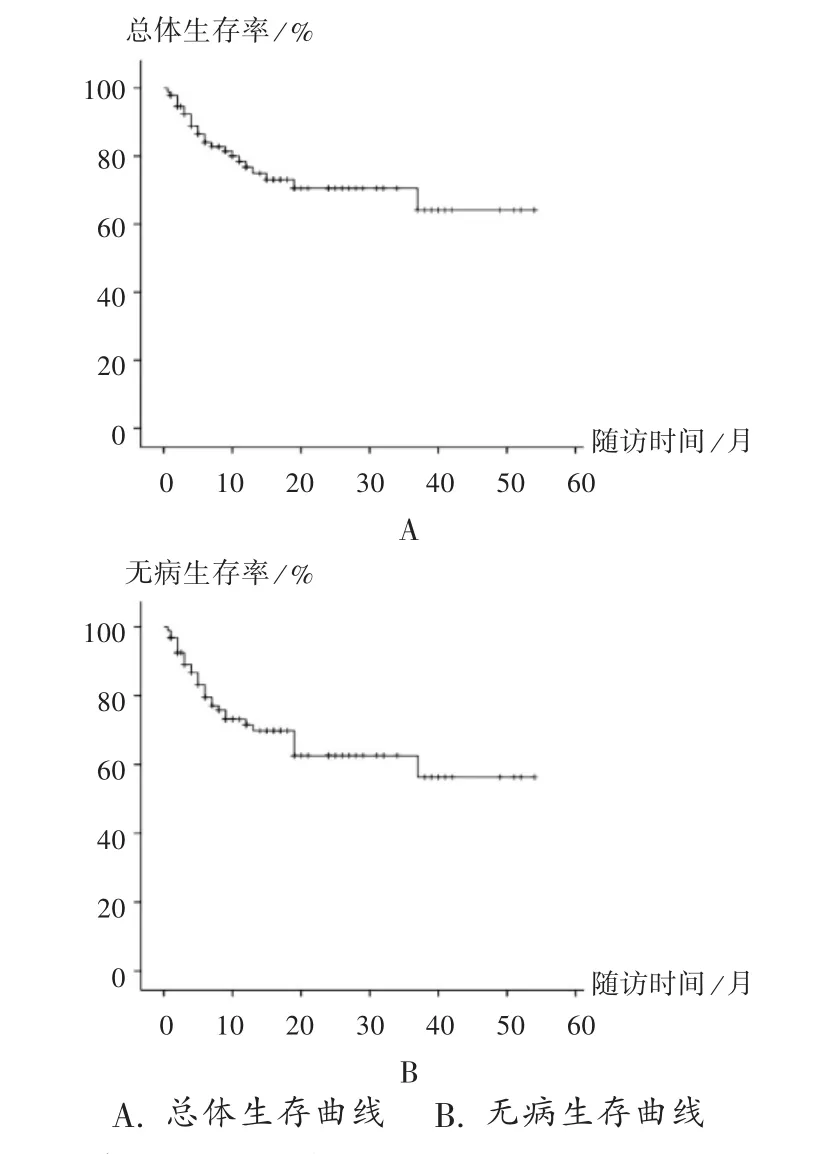
图1 97 例急性白血病患者移植后的总体生存率及无病生存率曲线
2.3 预后因素分析
本研究分析了疾病种类、疾病危险程度、aGVHD 发生程度、HLA 相合程度、供受者血型是否相符、供受者性别是否相同、供者年龄、确诊急性白血病至移植时间、血小板输注量等。单因素分析发现,重度aGVHD,确诊急性白血病至移植时间≥6个月,造血期间血小板输注量≥5 U 是不良预后指标。多因素分析结果显示,重度aGVHD、造血重建期间血小板输注量≥5 U 为独立危险因 素,其 相 对 危 险 度(RR)分 别 为5.466[(95% CI(1.556,19.196),P =0.008],2.340[95% CI(1.078,5.082),P =0.032]。详见表1。

表1 急性白血病患者移植后3年DFS 预后危险因素分析
3 讨论
根据MICM 分型技术,急性白血病可分为AML 和ALL,其中AML 约占80%,AML 的治疗包括诱导治疗及缓解后巩固治疗。常用诱导方案为阿糖胞苷联合蒽环类药物,60% ~80%的成年AML 患者在接受高强度的诱导化疗后能获得完全缓解[6]。如不进一步巩固治疗,绝大多数患者会在4 ~8个月内复发[7]。ALL 主要治疗方式是联合化疗,绝大多数方案包括长春新碱、糖皮质激素和蒽环类药物,如果BCR-ABL 基因阳性,还可使用酪氨酸酶抑制剂治疗[8]。近些年由于化疗方案的改进,成年ALL 患者缓解率不断上升,75% ~90%的患者可获得完全缓解,但相对于儿童患者,成人ALL 患者的复发率高,长期生存率由于患者年龄及疾病特征的不同波动于25% ~50%[9-12]。因此,缓解后巩固治疗至关重要。
急性白血病缓解后的巩固治疗主要包括强化化疗、自体造血干细胞移植及异体造血干细胞移植。异体造血干细胞移植同时具有化疗杀伤及免疫调节(移植物抗白血病细胞效应)的作用,故能有效降低急性白血病的复发率,但移植相关并发症也限制了总体预后水平。本研究结果显示,患者3年OS 和DFS 与文献[13-15]报道结果相似。异基因造血干细胞移植后的早期死亡原因主要是植入不良及早期并发症。移植早期严重的并发症包括与预处理毒性相关的器官衰竭、肝静脉阻塞综合征、aGVHD、感染(细菌、真菌、病毒)、血栓性微血管病。分析本研究中7 例早期死亡患者的死因,发现早期的输血支持、控制重度aGVHD 及控制感染尤为重要。文献报道异基因造血干细胞移植后的长期死亡原因有疾病复发、cGVHD、长期免疫缺陷所继发的感染、大量放化疗所致脏器功能损伤、继发性肿瘤等[16-20],其中疾病复发、cGVHD、感染是主要原因[19]。从本研究结果来看,复发也许是威胁急性白血病患者长期生存的首要因素。预后分析显示,重度aGVHD 为预后不良的独立危险因素。异基因造血干细胞移植在产生移植物抗白血病细胞效应的同时,也带来了GVHD,因此如何平衡二者的关系,是改善急性白血病移植患者预后的关键。
除了重度aGVHD 外,本研究中还发现,造血重建期间血小板输注量≥5 U 也为预后不良的独立危险因素,这在其他文献中罕有报道。有研究报道,不同化疗方案可导致急性淋巴细胞白血病患者对血小板依赖的差异[21]。造血期间血小板输注量实际反映的是造血期间血小板重建情况,血小板输注量越大表明重建速率越慢,由此推测,早期应用升血小板的细胞因子(如血小板生成素、白细胞介素11 等)加快血小板重建或能改善移植患者的预后,但有待进一步研究。其他因素可能因为样本量较小及随访时间较短的限制而无统计学意义。
目前已有不同的危险评分模型用于评价异体造血干细胞移植患者早期病死率。其中,较常用的是EBMT,PAM,HCT-CI 3 种评分系统[22-24]。EBMT 评分系统根据供受者HLA 匹配程度、疾病所处阶段、供受者的年龄和性别、诊断至移植时间来评分,起初是预测异基因移植后慢性髓系白血病(CML)患者的治疗相关死亡率及5年生存率,后来逐渐用于血液系统其他疾病,包括ALL、AML、MDS、多发性骨髓瘤(MM)等。PAM 评分系统包含8个预测因素(患者年龄、供者类型、疾病危险程度、预处理方案、血清肌酐、血清转氨酶、第1 秒用力呼气容积、肺功能),适用于CML,AML,MDS 的患者。HCT-CI 评分系统通过对17 种可能的合并症进行评分,预测异基因移植后的非复发死亡率。这些评分系统有助于预测患者的预后,以便调整相应治疗方案。而目前仍缺乏有针对性、多方面评估急性白血病疗效的评分系统,且建立这样的系统难度较大。
综上所述,急性白血病患者经异基因造血干细胞移植后可获得较高的3年OS 及DFS。重度aGVHD、造血期间血小板输注量≥5 U 为预后的独立危险因素。后续期待有针对性的、多方面评估急性白血病患者的评分系统的出现,以及更多相应患者参与研究,以更好地评估患者的预后,优化急性白血病的治疗方案。
