基于网络药理学的盐酸小檗碱治疗胃炎机制研究
2020-07-02李雪梅徐文坚
李雪梅,吴 坚,徐文坚△
(1. 广东省中山市小榄人民医院,广东 中山 528400; 2. 广东省汕头市中心医院,广东 汕头 515000)
胃病的发病率高达80%,其中以胃炎发病率最高[1]。胃炎是各种原因引起的胃黏膜炎症,为最常见的消化系统疾病,是一种血管系统的活体组织对损伤因子所发生的复杂防御反应,通常包括上皮损伤、黏膜炎性反应和上皮再生3个过程。机体许多成分参与胃炎反应过程,主要包括白细胞、血管壁细胞、细胞外基质和胃炎介质等。胃炎常表现为腹胃脘部不适、疼痛、饭后饱胀、嗳气、反酸,甚至恶心、呕吐等症状[2],影响其正常饮食和生活质量,甚至威胁机体健康。目前,治疗胃炎仍以化学药物为主,能快速改善症状,缓解不适,但易复发,甚至会产生严重不良反应。随着现代医学科学研究技术的发展,药物分离及分析技术的提高,分子生物学等相关学科研究的深入,结构确定、作用温和、药效缓慢与持久的药用天然产物逐渐成为开发新药的宝库。
小檗碱(berberine,BBR,C20H19NO5,相对分子质量为336.37)又名黄连素,可从小檗科、毛茛科、芸香科、鼠李科等属植物中提取分离的异喹啉类生物碱[3],是除青蒿素、三氧化二砷及阿帕替尼外,我国自主研发的药用植物单体药物,来源广泛,成本低,不良反应小[4-5],临床应用广泛,极具开发潜能。临床常用的盐酸小檗碱(BBRH,相对分子质量372.87)具有多种生物活性,以及抗炎、抗菌、降糖、调脂、抗痢疾、抗肿瘤等药理活性[6-15],可用于治疗消化性溃疡、胃炎、肠炎等消化系统疾病[16]。BBRH 治疗胃炎效果良好,但其作用机制尚未见系统报道。目前绝大多数药物以个别靶点和通路作为研究对象阐明其作用机制,但该法难以全面地反映具有天然属性的盐酸小檗碱的药理机制。网络药理学基于系统生物学理论,从药物、靶点与疾病间相互作用的整体性和系统性出发,通过采用复杂生物网络模型,揭示药物、基因、靶点、疾病之间复杂的整体生物网络关系,在此基础上分析、预测药物的药理学机制[17-20]。目前,多采用网络药理学方法研究天然单体药物和西药的药理机制,如丹参酮ⅡA、苦参碱、大黄素、人参二醇、牛磺鹅去氧胆酸、臭椿酮、阿帕替尼等成分和药物的机制分析[21-27]。本研究中基于网络药理学的分析方法,从整体、系统的生物学角度综合探讨BBRH 治疗胃炎的作用机制,为BBRH 药理机制的阐明及其更多临床应用的开发提供研究思路。现报道如下。
1 资料与方法
1.1 BBRH 靶点收集及其互作网络(PPI)构建
在NCBI 数据库中获得berberine 的SDF 格式文件,并 将 其 上 传PharmMapper 服 务 器(http:/ / lilab.ecust.edu.cn/pharmmapper/submit_file.php)进 行 靶 点预测,设置获得前300个人类靶点及其名称、匹配值(score)、PDBID 等 信 息;将 PDBID 导 入 UniProt(https:/ /www.uniprot.org/)数据库中检索和矫正,剔除重复、非人源与不规范的靶点,并结合TCMSP(http:/ /lsp.nwu.edu.cn/tcmsp.php)和Puchem(https:/ /pubchem.ncbi.nlm.nih.gov/)收集的靶点建立Berberine 的靶点数据库;将BBRH 潜在靶点导入STRING 数据库(http:/ /string-db.org),选定物种为人类,最后导出BBRH 潜在靶点PPI 网络文件,并使用Cytoscape 3.6.1 软件进行可视化分析。
1.2 BBRH 治疗胃炎的潜在靶点确认及PPI 构建
以“gastritis”为 关 键 词,在GeneCards(https:/ /www.genecards.org/)数据库中检索与胃炎相关的靶点,建立胃炎相关靶点数据库;按1.1 项下同法构建胃炎PPI 网络;对BBRH 潜在靶点PPI 网络和胃炎相关靶点PPI 网络进行交集比对,确认BBRH 治疗胃炎的潜在直接作用靶点及间接作用靶点,按1.1 项下同法构建BBRH 治疗胃炎的潜在作用靶点PPI 网络;采用Cytoscape 3.6.1 软件自带的“Network Analysis”插件对该PPI 网络进行拓扑性质分析,包括度数(degree)和介数中心度(betweenness)[28-29],以大于或等于1 倍介数中心度(betweenness)和接近中心度(closeness)中位数及大于或等于2 倍度数(degree)的中位数为条件筛选关键靶点[30]。
1.3 相关通路和注释分析及其网络构建
使用DAVID 数据库(https:/ /david.ncifcrf.gov/)对靶点进行KEGG 生物通路富集分析,并使用Cytoscape 3.5.1 软件的ClueGO 插件对BBRH 治疗胃炎的生物学功能进行注释分析,并采用其Merge 与Union 功能构建“药物-靶点-通路”网络。
1.4 药物-靶点的分子对接验证
采用Discovery studio 2.5,AutoDock 1.5.6,PyMOL软件,分别对原配体和蛋白进行预处理、对接、作图,以结合自由能(ΔGbind)为参考指标,ΔGbind 值越小,BBRH 与靶点的结合能力越强,并从最优构象上分析BBRH 与靶点的结合模式,从分子水平探讨两者的结合情况,准确了解靶点和活性小分子间的相互作用[31]。
2 结果与分析
2.1 BBRH 靶点收集及其PPI 网络构建
合并PharmMapper(227)和TCMSP(49)及Pubchem(54)3个数据库的BBRH 靶点,并取PharmMapper 数据库中score 排序前30个靶点及其他2个数据库的靶点,剔除重复项后共获得117个靶点,详见图1。可见,117个靶点共存在1242 条关系,对该网络的拓扑信息进行分析可知,degree,betweenness,closeness 的中位数分别为8,0.0028,0.433,且符合大于或等于1 倍betweenness 和closeness 中位数及大于或等于2 倍degree 中位数的靶点共20个,该类靶点是BBRH 作用的潜在关键靶点。结果见表1。
2.2 胃炎相关靶点的收集及其PPI 网络构建
从GeneCards 数据库获得882个与胃炎相关的靶点,对BBRH 靶点与胃炎相关靶点进行比对,得出31个BBRH 治疗胃炎的潜在直接靶点,包括TP53,MAPK1,COX-2,PPARG,IFN-γ 等。BBRH 靶点与胃炎靶点的韦恩图见图2。在BBRH 治疗胃炎的潜在直接靶点PPI网络中有30个靶点存在相互作用,且构成127 条关系,详见图3。对BBRH 治疗胃炎的潜在直接靶点PPI 网络进行Network Analyzer 分析发现,该PPI 网络中的degree,betweenness,closeness 分 别 为 6.5,0.00729,0.537,其中符合筛选条件的靶点有TP53,MAPK1,COX-2,PPARG,这4个靶点是连接其他靶点的枢纽,提示其在BBRH 治疗胃炎过程中可起到关键作用。
此外,BBRH 治疗胃炎的31个潜在直接靶点与651个胃炎相关靶点存在相互作用关系,表明BBRH 通过直接作用到31个潜在靶点上而再影响到651个靶点的活性,详见表2;对间接靶点PPI 网络进行拓扑性质分析,并列出了该网络符合关键参数条件的前50个靶点,其中包括白细胞介素6(IL-6)等靶点。结果见表3。
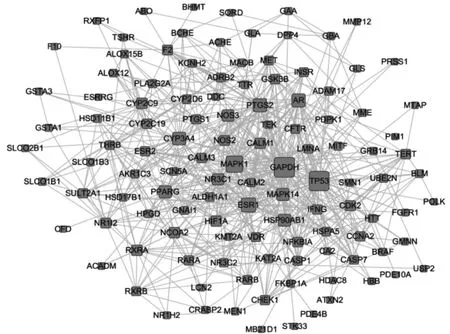
图1 盐酸小檗碱作用靶点的互作网络
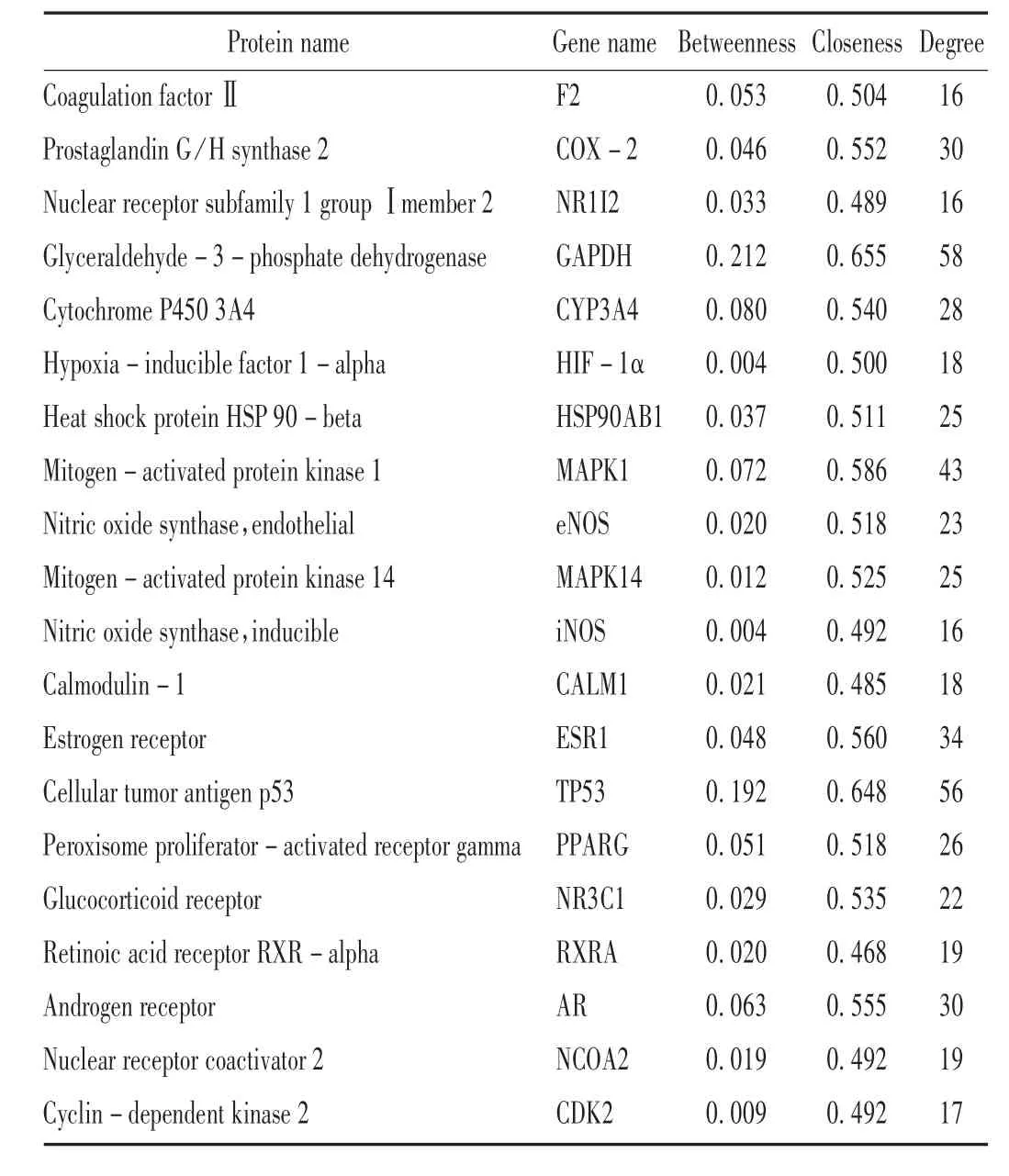
表1 关键药物靶点的拓扑参数基本情况
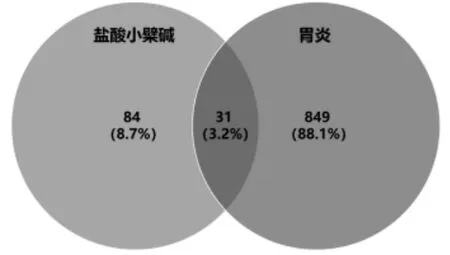
图2 盐酸小檗碱治疗胃炎的潜在直接靶点韦恩图
2.3 相关通路和注释分析及其网络构建
对靶点进行ClueGO 生物功能注释,BBRH 治疗胃炎的潜在生物学功能主要概括为13个方面的内容,如细胞因子介导信号通路调节、活性氧的代谢调节、一氧化氮生物合成过程、血管内皮细胞迁移的调控、外源性凋亡信号通路的调控、RNA 聚合物的转录、端粒酶活性的调节等,该类生物功能均与细胞增殖、细胞迁移、细胞凋亡、血管再生、细胞周期的调控,以及转录、翻译、信号转导、炎性反应、免疫应激等生物过程密切相关,提示BBRH 对胃炎的治疗是通过多种生命过程共同干预胃炎的发生、发展实现的。

图3 盐酸小檗碱治疗胃炎的潜在直接靶点PPI 网络
为了进一步探讨BBRH 治疗胃炎的潜在作用机制,将31个潜在靶点映射到DAVID 数据库,进行KEGG 通路富集,共富集到64 条信号通路(见表4),其中P>0.05的通路共有50 条,主要与炎症、癌症、免疫等相关(包括TNF 信号通路等炎症通路、B 细胞受体信号通路等免疫通路、PI3K-Akt 信号通路等常见肿瘤经典通路)。共12个靶点富集在幽门螺杆菌感染的上皮细胞信号传导(DDR1,IκB-α,MAPK14)、缺氧诱导因子-1 信号通路(HIF-1α,IFN-γ,MAPK1,iNOS,eNOS)、血管内皮生长因子信号通路(MAPK1,iNOS,eNOS,COX-2)、肿瘤坏 死 因 子 信 号 通 路(IκB-α,COX-2,MAPK14,MAPK1)、花生四烯酸代谢通路(COX-1,COX-2)、病灶粘连(BRAF,DDR1,GSK-3β,MAPK1)等与胃炎的发生,发展密切相关的信号通路中,体现了BBHR 干预胃炎的多途径作用特点。为更清晰地了解BBRH 干预胃炎的潜在机制,本研究中构建了“药物-靶点-通路”可视化网络,有助于BBHR 干预胃炎机制的阐释。详见图5。

表2 盐酸小檗碱治疗胃炎的潜在直接靶点的拓扑参数基本情况
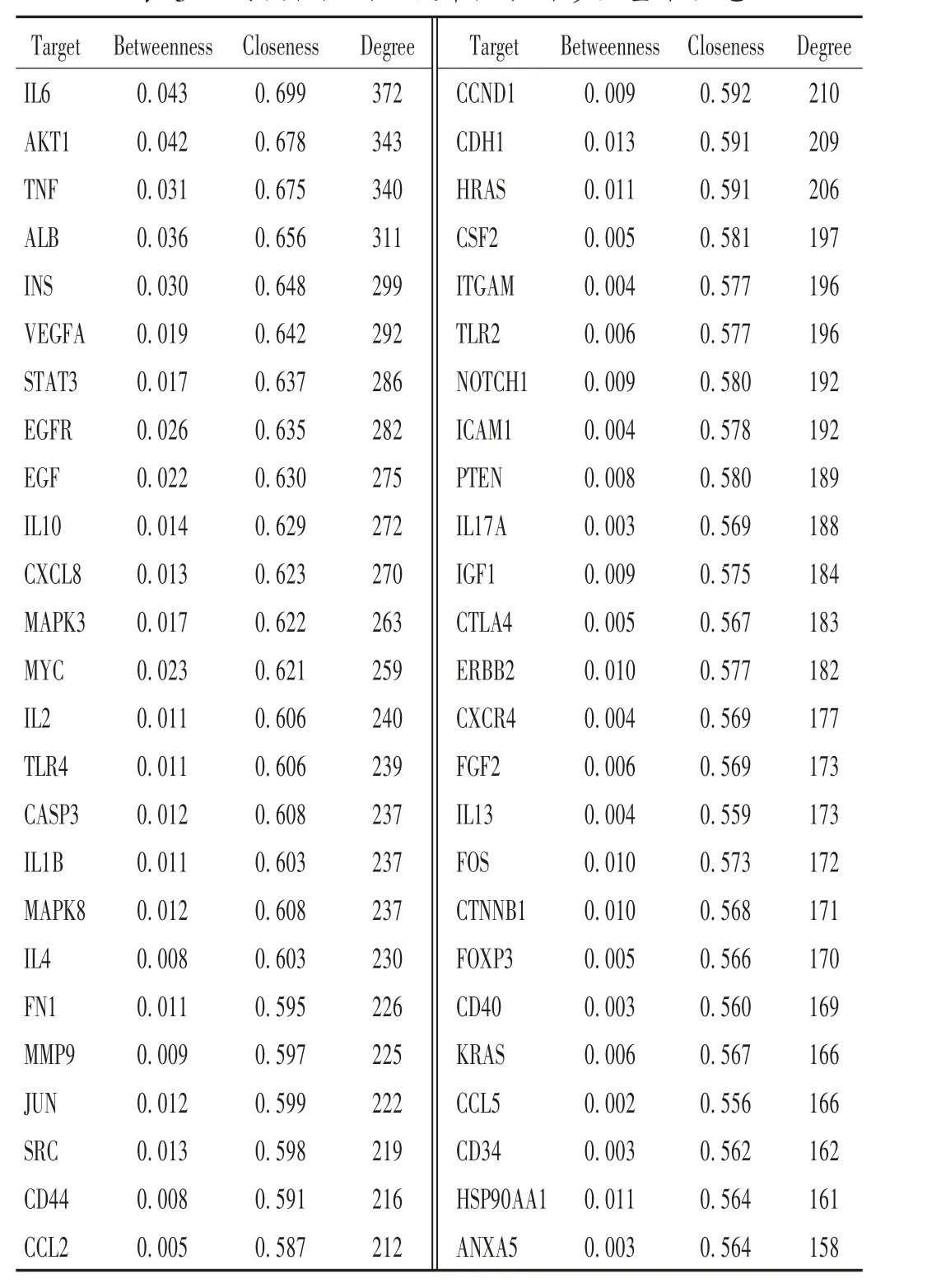
表3 间接靶点的关键节点拓扑参数基本信息
2.4 分子对接验证

图4 盐酸小檗碱治疗胃炎的生物学功能注释
将富集在与胃炎发生、发展密切相关通路的12个潜在靶点与BBRH 进行分子对接(见图4),配体与受体结合的构象稳定时能量越低,发生作用可能性越大。本研究中的分子对接结果表明,BBRH 与12个靶点的亲和力和各蛋白原配体的亲和力相近,其中亲和力最强的是iNOS(见图6),BBRH 与iNOS 的Tyr-483,Gln-199,Trp-366 存在氢键作用,其自由能为-10.1 kcal/mol,不仅接近于原配体与该蛋白的自由能,且结合最稳定。详 见 表5。此 外,BBRH 与IFN-γ,MAPK1,eNOS,GSK-3β 等靶点的自由结合能较其对应的原配体更低,且存在氢键作用。与原配体的结合相比,BBRH 与这些靶点的结合更亲和和稳定,体现了BBRH 多靶点的作用特点。
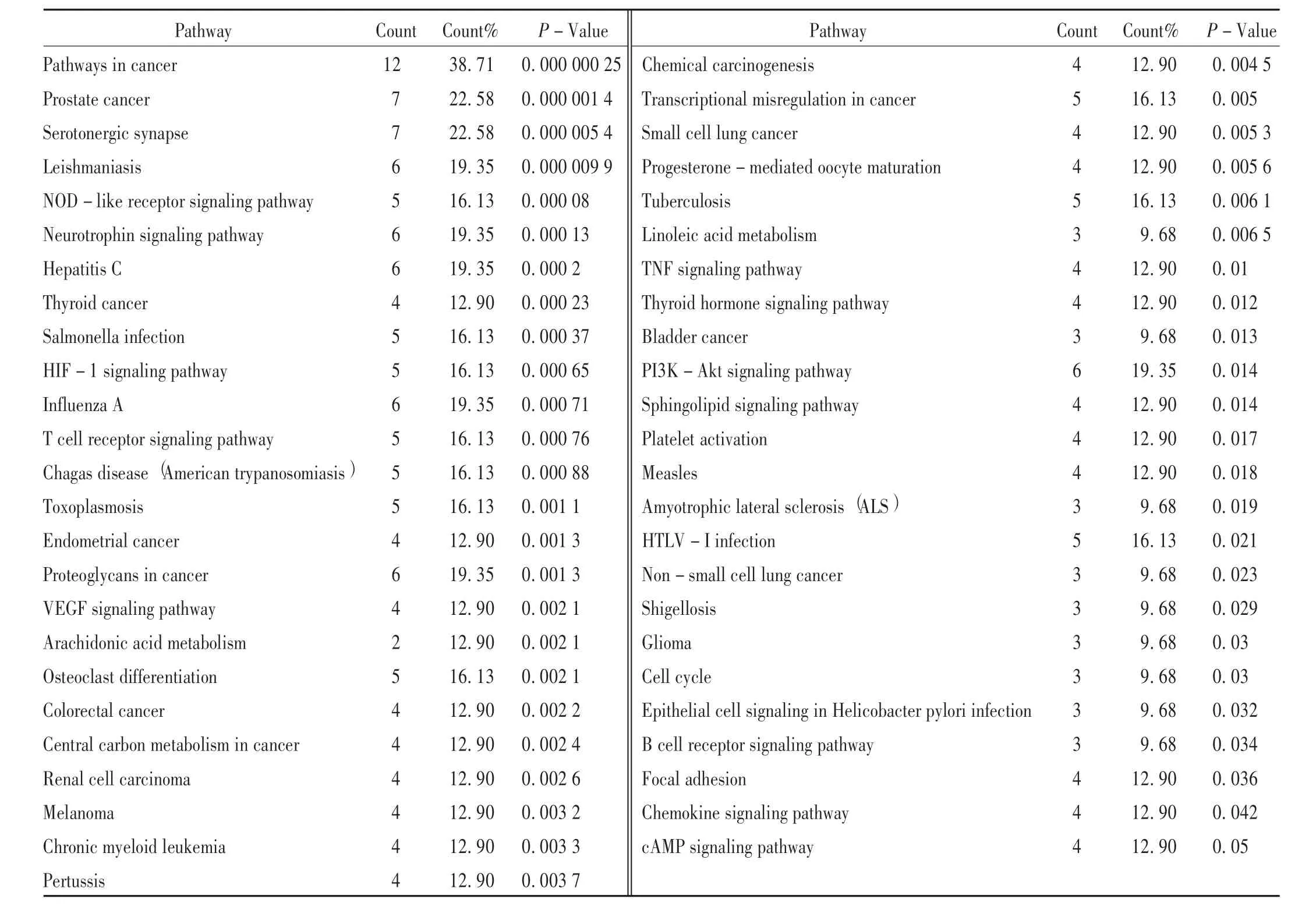
表4 盐酸小檗碱治疗胃炎的信号通路
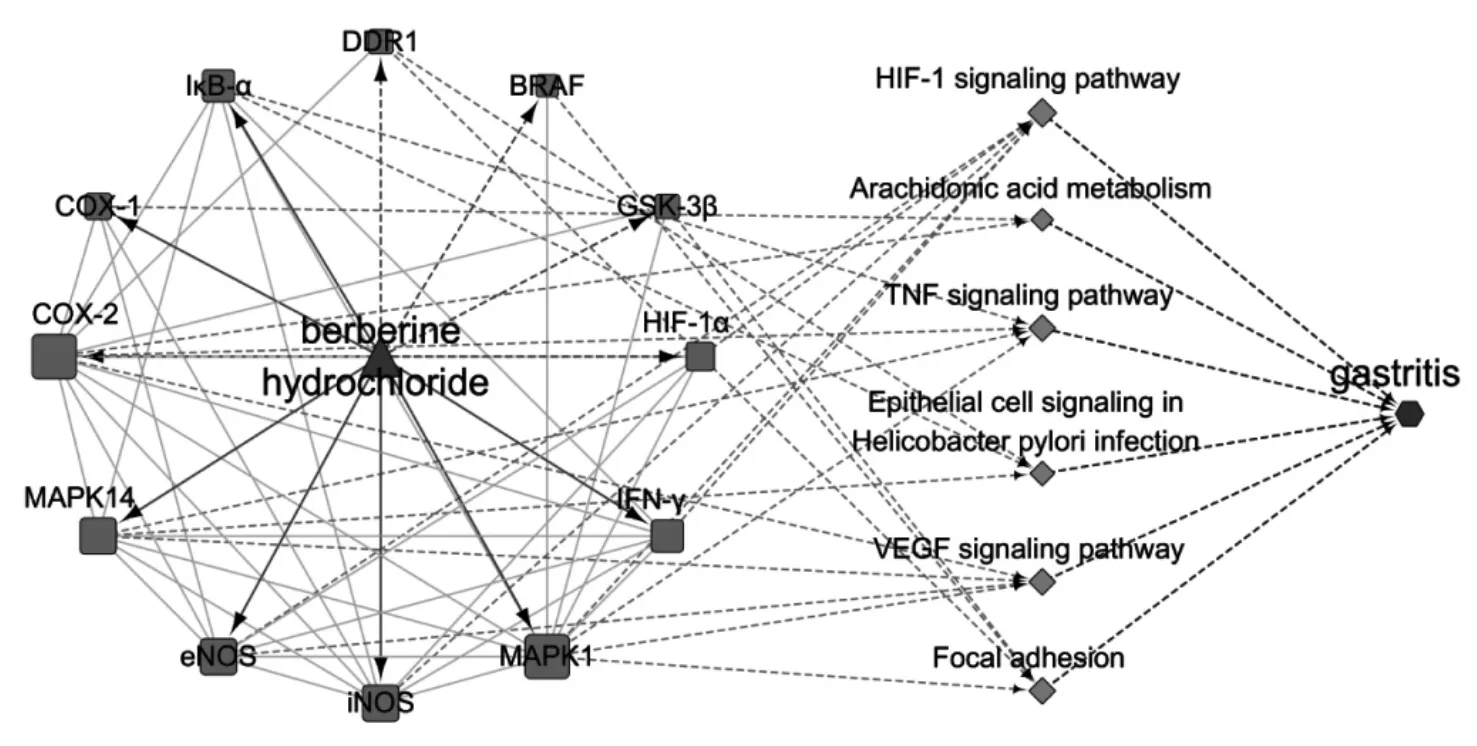
图5 盐酸不檗碱对胃炎的“药物-靶点-通路”干预网络
3 讨论
网络药理学是一种集系统生物学和多向药理学及计算机分析技术网络为一体的新型学科,其可将药物和疾病紧密关联起来[32],建立既复杂又清晰的药物-靶点-疾病的相互作用网络,助力现代药物研究者从系统和整体的角度阐明和理解药物作用机制,可为先导化合物的发现、新药靶点的识别等研究提供新策略和思路[33-34]。本研究中通过网络药理学研究发现,BBRH 可通过多靶点、多通路的作用特性干预胃炎的发生、发展。
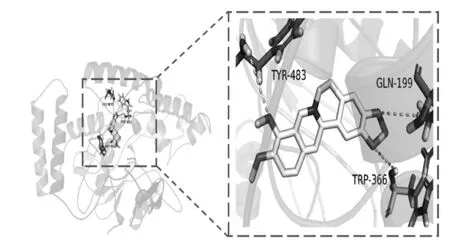
图6 盐酸小檗碱与NOS2 分子对接图
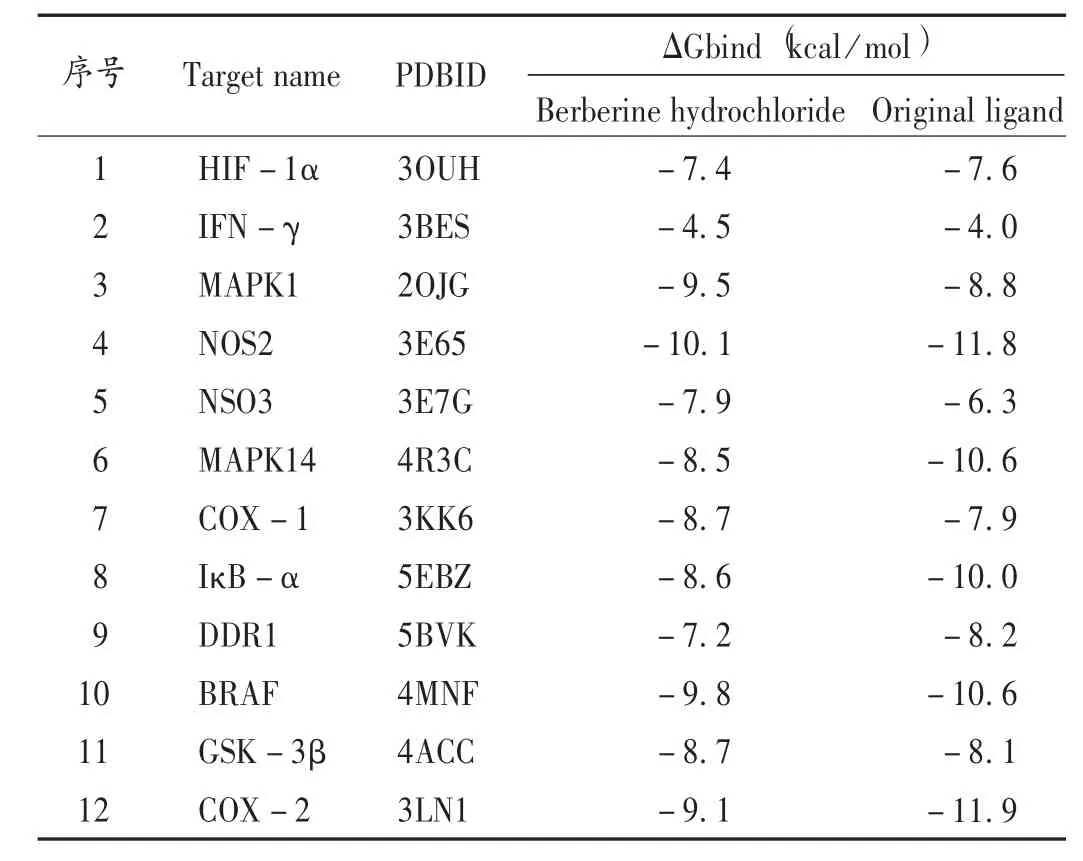
表5 盐酸小檗碱与14个重要靶点的对接结果
通过PharmMapper 服务器和TCMSP 数据库获得的BBRH 靶点与利用GeneCards 数据库得到的胃炎相关靶点进行对比与分析,并预测到BBRH 干预胃炎的潜在靶点共31个。然后利用STRING 数据库构建PPI,分析发现,共有30个蛋白存在相互作用关系,其中COX-2,MAPK1,TP53,PPAPG 等靶点较关键,这表明BBRH 干预胃炎的效果是通过多靶点相互作用实现的。随后利用ClueGO 对这些靶点进行GO 生物功能注释,结果表明,这些靶点主要参与机体多种应激反应和多种蛋白酶的生物合成过程,也参与蛋白、氨基酸、脂质等代谢,调控细胞增殖与凋亡、免疫应答及信号传导,调控多种金属离子的运转和多种蛋白激酶的活性及细胞活化等作用,提示BBRH 干预胃炎的作用可通过多层次、多途径实现。
对以上靶点进行KEGG 通路富集分析发现,31个靶点分布在64 条信号通路上,其中12个靶点富集在6 条与胃炎发生、发展密切相关的通路上,主要为酶类(包括蛋白酶、蛋白激酶、氧化还原酶等)、受体、转录因子等。分子对接结果也表明,BBRH 与这些靶点均有良好的结合,进一步分析发现,COX-2 和MAPK1 分别都富集在3 条通路中,且为在12个靶点中的拓扑参数最大的2个靶点。此外,BBRH 与iNOS 的结合最亲和,表明其在BBRH 干预胃炎的过程中发挥着较重要的作用,提示网络药理学对BBRH 干预胃炎的机制研究具有一定的可靠性和参考价值。
COX 主要分为COX1 和COX-2,前者在大多数正常组织中表达,负责生理性PG 的生成,后者在正常内环境中不表达,但其升高可导致炎性级联反应和组织损害,并与炎症程度呈正相关。COX-2 是催化花生四烯酸(AA)裂解为前列腺素类等致炎介质的关键酶,其介导的级联反应可调节炎性介质NO 和前列腺素类(PGs)的合成和释放,该酶活性的降低或抑制能有效控制炎症的发生[35]。有研究发现,胃炎患者的COX-2 的蛋白表达阳性率很高[36],表明COX-2 蛋白的表达可促进黏膜的炎性反应[37]。因此,对COX-2 蛋白表达下降可修复胃黏膜并恢复其正常的生理功能,进而缓解胃炎的症状[38]。
BBRH 具有保护胃肠道黏膜的作用,可诱导胃肠黏膜中PGE2 含量的增加,COX-1 表达的升高及COX-2表达的降低[39],同时,促进可能与胃肠黏膜血管内皮细胞分泌NO 密切相关的eNOS 的表达,介导胃黏膜血管内皮细胞依赖性舒张反应,改善胃局部微循环,通过修复胃黏膜的损伤,恢复胃肠黏膜的生理功能、增强其对外界刺激的防御能力,从而实现BBRH 对胃肠黏膜的保护作用。
MAPK1(ERK 1/2)和MAPK14(p38)均为丝裂原活化蛋白激酶(MAPK)家族成员,参与机体对外界环境应激的适应、炎性反应等多种生理、病理过程,是多种抗炎药物作用的共同通路[40]。在生理状态下,NF-κB 以p50-p65 异源二聚体的形式存在,且与IκB 结合而处于失活状态[41]。IκB-α 是遏制NF-κB 核因子活性的关键蛋白[42],可通过与NF-κB 二聚体结合,使NF-κB 以失活的静息状态存在细胞质中。但当细胞受到外界刺激时,IκB-α 被磷酸化[43],NF-κB 变为游离状态,启动相关基因的转录和表达,诱导相关炎性因子、趋化因子及炎性介质表达,放大炎性损伤[44]。BBRH 能下调MAPK 信号通路中ERK 1/2 和p38 蛋白磷酸化水平,提高两者总蛋白的表达水平[45]。此外,BBRH 还能降低NF-κB 信号通路中p65 蛋白和IκB-α 的磷酸化水平和提高IκB-α 总蛋白表达水平[46],从而减少炎性因子的转录和表达,减轻炎症对组织的继续损伤而发挥其抗炎效应。
BRAF 作为一种蛋白激酶也参与了促有丝分裂信号从细胞膜到细胞核的传递,能磷酸化MAPK1 激活MAPK/ERK 信号通路,影响细胞分裂、分化和分泌[47]。由分子对接结果可知,BBRH 可与BRAF 的Lys483,Sep467,Phe595,Ser463 形成较稳定的氢键,据此推测BRAF 也是BBRH 参与胃炎治疗的重要靶点。
慢性胃炎多由幽门螺杆菌感染引发。幽门螺杆菌是定植于胃黏膜表面和黏膜层之间的微需氧菌,其细胞壁的主要成分为脂多糖,可使单核细胞、巨噬细胞分泌抗原类物质,幽门螺杆菌感染机体的同时可刺激iNOS 表达增高,该蛋白诱导产生的NO 含量也随之增加[48],进而引起并加剧了胃黏膜的炎性反应,造成胃黏膜发生损伤及萎缩等变化。故幽门螺杆菌的阳性率越高,慢性胃炎的症状就越重[49]。
在机制方面,受体酪氨酸激酶(DDR1)在多个脏器的炎症中发挥重要作用[50-51],参与调节炎性细胞在病灶的聚集和浸润,可通过促进炎性细胞对胶原基质屏障的黏附和侵袭作用[52],在多种炎症性疾病的发生、进展中发挥关键作用[53]。BBRH 在体内外对幽门螺杆菌均有较强的抑制或杀灭作用,其机制可能为抑制细菌在胃上皮的附着和增殖[54]。此外,BBRH 还可抑制促炎因子iNOS 的表达[55],减少炎性介质的产生。
在炎性反应和缺氧环境中,缺氧诱导因子-1α(HIF-1α)对此环境中的代谢、增殖、凋亡、炎性免疫反应中发挥重要作用[56-58]。目前,HIF-1 与PI3K,MAPK,NF-κB 信号传导通路之间联系紧密[59-60],多个促炎因子的转录和表达受HIF-1 的调控[61],如HIF-1α 调节iNOS 表达升高后产生的NO 可促进炎性细胞释放TNF-α,放大炎性反应。同时,TNF-α[62],IL-1β[63],ROS[64],NO[65]、生长因子[66]等致炎因子也能激活HIF-1α 的转录和表达,提示HIF-1 与炎性反应过程密切相关[67],并认为HIF-1α 可能作为炎症疾病治疗的一个新靶点[68-69]。分子对接结果显示,HIF-1α 与Tyr310,Arg383,Arg322 形成稳定的氢键,提示HIF-1α 也可能在BBRH 治疗胃炎的过程中起到非常重要的作用。
糖原合酶激酶3β(GSK-3β)是一种广泛表达在真核生物中的一种多功能丝氨酸/苏氨酸激酶,参与细胞分化、增殖、凋亡、代谢等多种细胞活动过程[70-72]。GSK-3β 可参与调控炎症信号转导通路[73],在炎症性疾病的发生、发展中可选择性地调控炎症信号的转导。在不同致病源刺激下,GSK-3β 可选择性调控MyD88和TRF 依赖性的信号转导通路,正向调控促炎因子和IFN-γ 的产生,介导不同的炎性反应[74-75],当GSK-3β活性受到抑制或其基因被敲除后,可下调IL-16,IL-12,TNF-α 等促炎因子的产生,上调IL-10 等抗炎因子的分泌[76-77]。对分子的对接结果分析发现,BBRH 与GSK-3β的Tyr134,Ser467,Phe201,Gln185 形成较稳定的氢键,推测GSK-3β 也可能参与了BBRH 对胃炎的治疗。
综上所述,可通过调节多条生物通路共同作用抑制炎性因子的产生,促进胃黏膜保护物质的分泌,阻断病菌迁移、侵袭、增殖、凋亡等过程干预胃炎的发生、发展。因此,推测BBRH 主要可通过修复胃黏膜、减轻炎症损伤、消除幽门螺杆菌感染等功能发挥其治疗胃炎的作用。
本研究中通过“药物-靶点-疾病”关系网络的构建,获得了BBRH 干预胃炎的重要靶点,其中BBRH 与部分靶点的作用已有文献证实,在一定程度上确证了本研究的准确性,其余靶点的作用尚需进一步探讨,并给予实验确证;初步解释了BBRH 干预胃炎的作用是通过多层次调控实现的,为今后更加深入地阐明BBRH 治疗胃炎的机制提供了理论依据和线索。
