特发性肠系膜静脉硬化性肠炎一例与文献复习
2020-07-02李永宇何瑶
李永宇 何瑶
1991年日本学者小山首次报告1例慢性右半结肠狭窄的缺血性结肠炎[1]。2003年Iwashita等[2]根据病理上无特异性炎症所见,故命名为特发性肠系膜静脉硬化性肠炎(idiopathic mesenterie phlebosclerotic,IMP)。病变部位肠管的静脉钙化导致循环血流障碍而引起的慢性缺血性结肠病变,是临床上比较罕见的疾病。本文报道1例IMP。
一、临床资料
患者,男性,56岁,间断性右下腹部疼痛半年余,无伴发热、恶心、呕吐、腹胀、便血等症状,大便2~3次/日,近半年体重减轻3 kg。当地医院结肠镜检查显示肠道多发溃疡,拟诊“缺血性肠病可能,炎症性肠病可能”,为明确诊断,收入中山大学附属第一医院消化内科。患者既往有结核病病史,接受正规抗结核治疗,自诉已愈。否认高血压、糖尿病、心脏病等病史,有长期服用保健品、中药、药酒史。入院后全腹CT小肠造影(computed tomography enterography,CTE)检查(图1、2)示:右半结肠肠壁增厚、水肿,肠腔稍扩张、周围血管多发钙化,主要累及肠系膜上静脉属支及部分小动脉,结肠周围脂肪间隙不清,增强扫描肠壁轻度强化,强化程度较正常肠壁稍低。结肠镜检查示(图3、4):降结肠以上黏膜呈紫蓝色改变。横结肠见散在小溃疡,大小约0.2 cm×0.3 cm,部分呈纵形排列。升结肠见散在0.3 cm~1.8 cm的溃疡,不规则,底附白苔,部分呈环状排列,盲肠见一处溃疡,底附白苔及污秽物,回盲瓣可见线状溃疡,回肠末段未见异常。乙状结肠距肛门18 cm见0.8 cm×0.8 cm息肉,直肠见0.3 cm×0.3 cm息肉。回盲部及升结肠取样,病理活检提示:黏膜层组织,呈慢性炎症改变,个别腺体扩张,可见个别隐窝脓肿,部分腺体呈腺瘤样增生,未见肉芽肿。直肠和乙状结肠息肉的病理提示为增生性息肉和腺瘤性息肉。病例分析:患者既往有结核病史,因此首先需排除肠结核,但患者已行正规抗结核治疗,肠镜病理活检未发现干酪样坏死以及抗酸染色阴性,γ-干扰素释放试验结果阴性,肠结核证据不足。患者结肠镜提示肠系膜上静脉供血肠段病变明显,病变区域与正常区域分界清楚,需注意缺血性肠病的可能,但患者既往无糖尿病、高血压、血脂异常等病史,结合全腹部CTE检查结果、病理结果以及长期服用中药及保健品史,最终确诊为IMP。患者病情相对较轻,暂予低分素肝素来抗凝治疗,改善肠道血循环以及口服美沙拉嗪,定期随访,必要时考虑手术治疗。
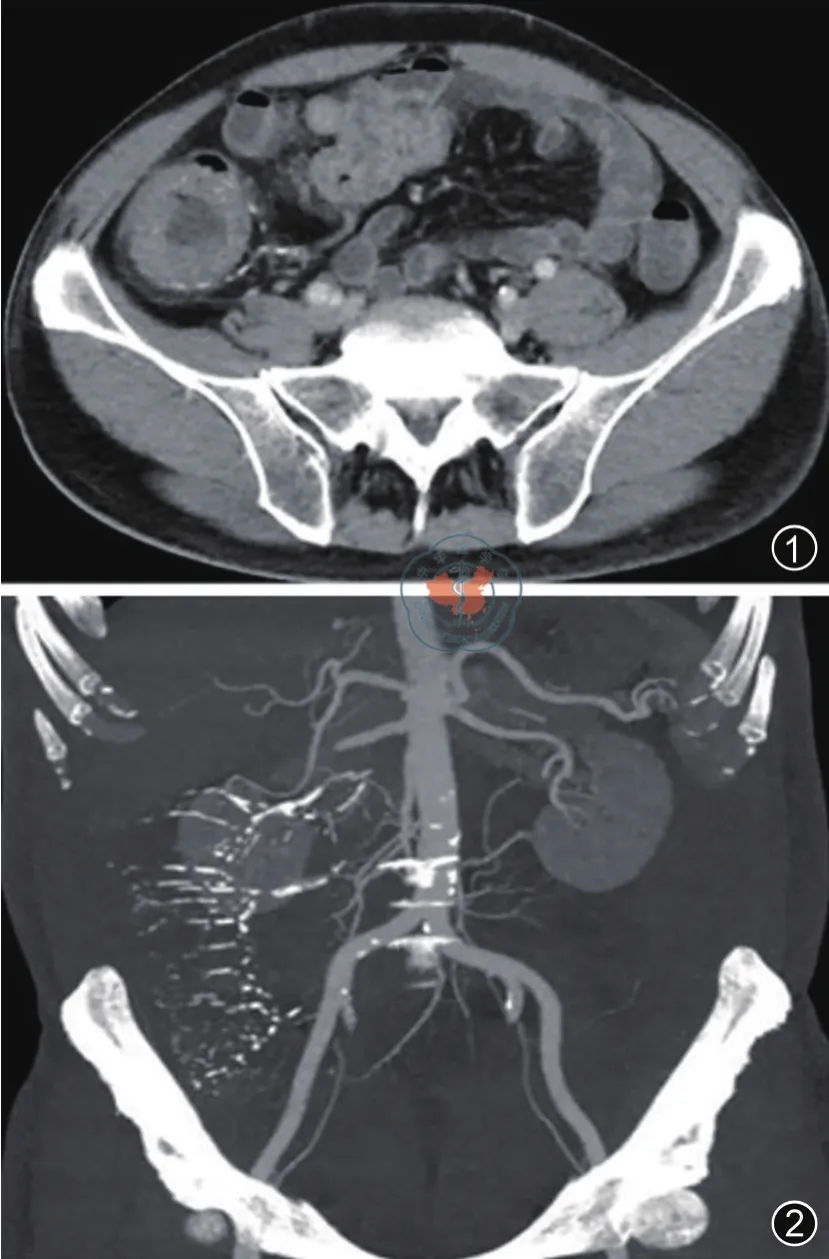
图1 CTE右半结肠肠壁增厚、水肿,肠腔稍扩张、周围血管多发钙化 图2 CTE血管重建。主要累及肠系膜上静脉属支及部分小动脉血管多发钙化
二、讨论
IMP在临床上十分罕见,查阅国内外文献只有几例个案报道。其病因和发病机制尚未明确,认为病变部位的肠管的静脉钙化导致循环障碍而引起慢性缺血性结肠病变。多见于中老年女性患者,男女之比2:3,大多有服用中药史。
病变部位一般以右半结肠比较多见,大约占58.4%[2],本病例病变也出现在右半结肠,符合既往文献报道。主要症状为腹痛、其次是腹泻,恶心、呕吐等症状比较多,但是偶尔也有便秘、腹胀、便血等症状。随着病程的进展,肠管的伸展功能的下降导致管腔狭窄导致肠梗阻。诊断上主要靠影像学检查、结肠镜及病理检查排除其他疾病。IMP的影像学特点为沿着肠管壁的钙化,结肠肠壁的增厚。IMP的结肠镜的特点为病变部位的肠黏膜呈暗紫色或者青铜色、暗黑色等,与正常黏膜相比颜色变深变黑。其原因可能是深部的淤血的静脉丛通过萎缩的黏膜可以透见所致。病变部位的肠黏膜一般肿胀比较明显,有时可见不规则溃疡。Iwashita等[2]、Guo等[3]报道切除肠管的病理特征为静脉壁的显著的纤维化和钙化,黏膜下层的高度的纤维化和黏膜固有层的胶原纤维的血管周围沉积,黏膜下层小血管壁的泡沫细胞的出现,动脉壁的肥厚以及钙化,无血栓等改变。如果病理活检看到胶原纤维的血管周围沉积和静脉壁的纤维性肥厚时可以考虑此病。
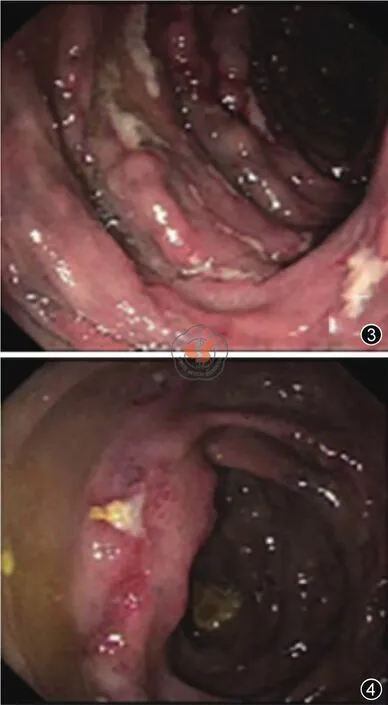
图3 结肠黏膜呈紫蓝色改变,结肠多发的纵形排列及环状排列的溃疡 图4 回盲瓣可见线状溃疡,周围黏膜充血、水肿
目前,IMP的发病机制不清,全身疾病以及服用中药患者发病率较高,发生在肠系膜上静脉供血肠段病变明显,但是发病机制尚未明确。Hiramatsu等[4]报道了IMP患者的多中心、全国性调查,收集了222例IMP患者病历,其中147例服用中药;服用中药中长期服用中药栀子的患者达到119例。Kang等[5]报道栀子苷与作用于HepG2细胞产生的代谢产物的毒性反应致小肠菌群失调可引起血管壁增厚,纤维化和钙化,从而导致缺血。
本病无明确的治疗指南,如果怀疑中药引起时及时停用中药,并发肠梗阻时切除病变部位的肠管,手术病例一般预后较好,无复发的病例。症状较轻时原则上采用保守治疗。
