阿帕替尼联合TACE术治疗中晚期肝癌有效性与安全性的Meta分析
2020-07-01唐贵菊田塬王继婷苏松李亚玲
唐贵菊 田塬 王继婷 苏松 李亚玲

中图分类号 R735.7 文献标志码 A 文章编号 1001-0408(2020)12-1487-08
DOI 10.6039/j.issn.1001-0408.2020.12.15
摘 要 目的:系统评价阿帕替尼联合经动脉化疗栓塞术(TACE)治疗中晚期肝癌的有效性和安全性,旨为临床合理用药提供循证参考。方法:计算机检索Cochrane图书馆、Embase、PubMed、Web of Science、中国生物医学文献服务系统、中国知网、万方数据、维普网等数据库,收集阿帕替尼联合TACE术(试验组)对比TACE术(对照组)治疗中晚期肝癌的随机对照试验(RCT),检索时限均为建库起至2019年9月。筛选文献、提取资料并采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具和改良Jadad量表评价纳入文献的质量后,采用 Stata 12.0软件进行Meta分析。结果:共纳入16项RCT,合计1 043例患者。Meta分析结果显示,试验组患者客观有效率[OR=3.10,95%CI(2.38,4.03),P<0.001]、疾病控制率[OR=3.56,95%CI(2.62,4.83),P<0.001]、生存率[OR=2.40,95%CI(1.86,3.10),P<0.001]以及腹泻[OR=2.27,95%CI(1.21,4.24),P=0.011]、血壓升高[OR=6.97,95%CI(1.21,40.15),P=0.030]、蛋白尿[OR=12.44,95%CI(2.51,61.71),P=0.002]、手足综合征[OR=32.50,95%CI(12.03,87.77),P=0.001]发生率均显著高于对照组,而治疗后血清血管内皮细胞生长因子[SMD=-3.64,95%CI(-5.06,-2.22),P<0.001]、基质金属蛋白酶9[SMD=-3.21,95%CI(-4.31,-2.10),P<0.001]、甲胎蛋白[SMD=-3.54,95%CI(-7.03,-0.06),P=0.046]水平以及骨髓抑制[OR=0.61,95%CI(0.39,0.97),P=0.035]、发热[OR=0.63,95%CI(0.42,0.95),P=0.027]、恶心呕吐[OR=0.70,95%CI(0.51,0.97),P=0.030]发生率均显著低于对照组;两组患者腹痛[OR=0.87,95%CI(0.54,1.39),P=0.547]、皮肤瘙痒[OR=1.63,95%CI(0.36,7.50),P=0.530]发生率比较,差异均无统计学意义。结论:阿帕替尼联合TACE术能显著提高中晚期肝癌患者的临床疗效、延长生存时间、减少肿瘤复发及转移,并降低骨髓抑制等TACE术后相关不良反应的发生,但会增加腹泻等阿帕替尼相关不良反应的发生。
关键词 阿帕替尼;经动脉化疗栓塞术;中晚期肝癌;有效性;安全性;Meta分析
Efficacy and Safety of Apatinib Combined with TACE in the Treatment of Moderate and Advanced Liver Cancer: A Meta-analysis
TANG Guiju1,TIAN Yuan1,WANG Jiting1,SU Song2,LI Yaling3(1. School of Pharmacy, Southwest Medical University, Sichuan Luzhou 646000, China; 2. Dept. of Hepatobiliary, the Affiliated Hospital of Southwest Medical University, Sichuan Luzhou 646000, China; 3. Dept. of Pharmacy, the Affiliated Hospital of Southwest Medical University, Sichuan Luzhou 646000, China)
ABSTRACT OBJECTIVE: To systematically evaluate the efficacy and safety of apatinib combined with transcatheter arterial chemoembolization (TACE) in the treatment of moderate and advanced liver cancer, and to provide evidence-based reference for rational drug use in the clinic. METHODS: Retrieved from Cochrane Library, Embase, PubMed, Web of Science, SinoMed, CNKI, Wanfang, VIP database, RCTs about apatinib combined with TACE (trial group) versus TACE (control group) in the treatment of moderate and advanced liver cancer were collected from inception to Sep. 2019. After screening the literature and extracting the data, the quality of included literatures was evaluated by using bias risk assessment tool recommended by the Cochrane system evaluator manual 5.1.0 and the modified Jadad scale. Meta-analysis was carried out by using Stata 12.0 software. RESULTS: Totally 16 RCTs were included, involving 1 043 patients. Results of Meta-analysis showed that objective response rate [OR=3.10, 95%CI(2.38,4.03), P<0.001], disease control rate [OR=3.56, 95%CI(2.62, 4.83), P<0.001] and survival rate [OR=2.40, 95%CI(1.86, 3.10), P<0.001], the incidence of diarrhea [OR=2.27,95%CI(1.21,4.24),P=0.011], hypertension [OR=6.97,95%CI(1.21,40.15),P=0.030], proteinuria [OR=12.44,95%CI(2.51,61.71),P=0.002] and hand foot syndrome [OR=32.50,95%CI(12.03,87.77),P=0.001] of trial group were significantly higher than those of control group. The serum level of VEGF [SMD=-3.64, 95%CI(-5.06, -2.22), P<0.001], MMP-9 [SMD=-3.21, 95%CI(-4.31, -2.10), P<0.001], AFP [SMD=-3.54, 95%CI(-7.03, -0.06), P=0.046] after treatment, the incidence of myelosuppression [OR=0.61,95%CI(0.39,0.97),P=0.035], fever [OR=0.63,95%CI(0.42,0.95),P=0.027], nausea and vomiting [OR=0.70,95%CI(0.51,0.97),P=0.030] in trial group were significantly lower than those of control group. There was no statistical significance in the incidence of abdominal pain [OR=0.87, 95%CI(0.54, 1.39), P=0.547] and skin itching [OR=1.63, 95%CI(0.36, 7.50), P=0.530] between 2 groups. CONCLUSIONS: Apatinib combined with TACE can significantly improve clinical efficacy, prolong survival time, reduce tumor recurrence and metastasis. It can reduce the occurrence of related ADR as diarrhea after TACE, but increase the occurrence of apatinib-related ADR as myelosuppression.
KEYWORDS Apatinib; Transcatheter arterial chemoembolization; Moderate and advanced hepatocellular carcinoma; Efficacy; Safety; Meta-analysis
我国癌症发病率、患者病死率随人口老龄化加剧而逐年上升,现已位列全球首位[1]。目前,肝癌位居我国癌症发病率第5位(26.92%)和病死率第2位(23.72%)[2],严重威胁患者的健康,给患者及其家属带来了巨大痛苦和负担。手术切除、介入治疗、靶向治疗等是肝癌治疗的主要方法[3]。早期肝癌患者经手术切除后可获得治愈;但多数患者确诊时已进展为中晚期,以介入治疗为主要手段[4]。经动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)是最為常用的介入治疗手段,但单纯的TACE术存在肿瘤细胞灭活不彻底的缺点[5],易导致患者术后复发,且上述复发与新生血管生成直接相关[6]。
阿帕替尼是我国首个完全自主研发的新型靶向抗血管生成药物[7]。研究发现,中晚期肝癌患者在TACE术后使用阿帕替尼,可抑制新生血管生成、减缓癌症进展、延长患者生存期、减少复发及转移[8-10]。但这些研究样本量较小,大多局限于单中心、回顾性研究,且阿帕替尼联合TACE术治疗中晚期肝癌尚缺乏充分的证据。为此,本研究采用Meta分析的方法系统评价了阿帕替尼联合TACE术治疗中晚期肝癌的有效性和安全性,旨为临床合理用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT);语种限定为中文和英文。
1.1.2 研究对象 经影像检查和病理活检确诊的中晚期肝癌患者;患者年龄、性别不限。
1.1.3 干预措施 对照组患者采用TACE术,术后给予止吐、护胃、保肝等常规治疗。试验组患者在对照组治疗的基础上给予阿帕替尼,用药1~2周后根据其耐受情况调整剂量:若耐受良好或出现轻度不良反应,可适当增加或维持起始剂量;若出现明显不良反应,则应减少剂量或短期(不超过1个月)停药观察,待不良反应减轻或消失后再逐步恢复并调整剂量。
1.1.4 结局指标 ①客观有效率(ORR);②疾病控制率(DCR);③生存率;④治疗后血清血管内皮细胞生长因子(VEGF)水平;⑤治疗后血清基质金属蛋白酶9(MMP-9)水平;⑥治疗后血清甲胎蛋白(AFP)水平;⑦不良反应发生情况。参照实体瘤疗效评价标准1.1版将疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD);ORR=(CR例数+PR例数)/总例数×100%;DCR=(CR例数+PR例数+SD例数)/总例数×100%[11]。
1.1.5 排除标准 ①主题不符的文献、二次文献(如综述、Meta分析);②回顾性研究、基础研究(包括动物实验、细胞试验)、案例报道、经验总结、会议论文;③无上述结局指标或无法提取可用数据的文献;④重复发表的文献。
1.2 文献检索策略
计算机检索Cochrane 图书馆、Embase、PubMed、Web of Science、中国生物医学文献服务系统(SinoMed)、中国知网、万方数据、维普网等数据库。中文检索词为“中晚期肝癌”“阿帕替尼”“TACE”“经动脉化疗栓塞术”;英文检索词为“Moderate and advanced hepatocellular carcinoma”“Apatinib”“TACE”“Transcatheter arterial chemoembolization”。检索时限均为各数据库建库起至2019年9月。采用主题词与自由词相结合的检索方式。
1.3 文献筛选与资料提取
由2位研究者独立检索文献,根据纳入与排除标准筛选文献并交叉核对;如遇分歧通过讨论解决或请第3位研究者协商裁定。提取资料包括第一作者、发表年份、患者例数、性别、年龄、干预措施、Child-Pugh肝功能分级、功能状态评分(KPS)、随访时间、结局指标等。
1.4 纳入文献质量评价
采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对纳入研究的质量进行评价,具体包括随机方法是否正确;是否分配隐藏;是否采用盲法;结果数据是否完整;是否选择性报告研究结果;是否存在其他偏倚来源;各项均分为“低偏倚风险”“高偏倚风险”“不清楚”[12]。同时,采用改良Jadad量表对纳入研究的质量进行评分,具体包括:随机序列的产生(恰当2分,不清楚1分,不恰当0分)、分配隐藏(恰当2分,不清楚1分,不恰当0分)、盲法(实施2分,不清楚1分,未实施0分)、撤出与失访(描述1分,未描述0分);0~3分为低质量研究,4~7分为高质量研究[13]。
1.5 统计学方法
采用Stata 12.0软件进行Meta分析。二分类变量采用比值比(OR)及其95%置信区间(CI)表示;连续型变量采用标准化均数差(SMD)及其95%CI表示。若各研究间无统计学异质性(P>0.1,I 2<50%),采用固定效应模型进行分析;反之,则采用随机效应模型进行分析。对结果的稳定性进行敏感性分析。采用Beggs检验和Eggers检验进行发表偏倚分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果与纳入研究基本信息
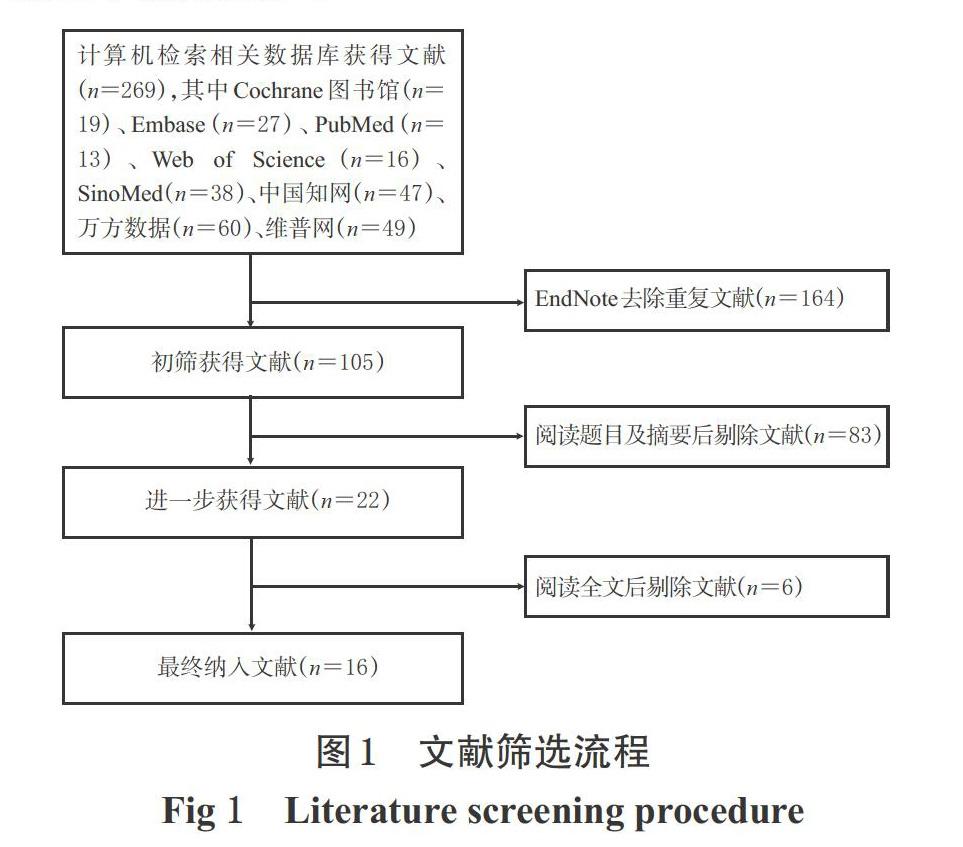
初检得到相关文献269篇,采用EndNote X8软件去除重复发表的文献,经仔细阅读题目、摘要和全文后,最终纳入文献16篇[14-29],共计1 043例患者,其中对照组521例、试验组522例。文献筛选流程见图1;纳入研究的基本信息见表1。
2.2 纳入研究质量评价结果
所有研究[14-29]均为RCT;8项研究[15-16,18,21,23-26]描述了随机分组方法,均为随机数字表法;1项研究[20]实施了双盲法;2项研究[15,28]描述了撤出与失访情况;所有研究[14-29]均不清楚是否采用分配隐藏;均未发现选择性报告结果及是否存在其他偏倚来源。10篇[15-16,18,20-21,23-26,28]为高质量研究,6篇[14,17,19,22,27,29] 为低质量研究,详见表2。
2.3 Meta分析结果
2.3.1 ORR 15项研究[14-28]报道了ORR,各研究间无统计学异质性(P=0.995,I 2=0),采用固定效应模型进行Meta分析,详见图2。Meta分析结果显示,试验组患者的ORR顯著高于对照组[OR=3.10,95%CI(2.38,4.03),P<0.001]。
2.3.2 DCR 14项研究[14-26,28]报道了DCR,各研究间无统计学异质性(P=1.000,I 2=0),采用固定效应模型进行Meta分析,详见图3。Meta分析结果显示,试验组患者的DCR显著高于对照组[OR=3.56,95%CI(2.62,4.83),P<0.001]。
2.3.3 生存率 9项研究[16,18-20,22,24-26,29]报道了生存率,各研究间无统计学异质性(P=0.999,I 2=0),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者的生存率显著高于对照组[OR=2.40,95%CI(1.86,3.10),P<0.001 ]。其中,有7项研究[16,18,20,24-26,29]报道了 6个月生存率,各研究间无统计学异质性(P=0.941,I 2=0),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者的6个月生存率显著高于对照组[OR=2.48,95%CI(1.64,3.77),P<0.001]。有7项研究[16,18,22,24-26,29]报道了12个月生存率,各研究间无统计学异质性(P=0.953,I 2=0),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者的12个月生存率显著高于对照组[OR=2.16,95%CI(1.43,3.26),P<0.001]。4项研究[19,22,24,29]报道了24个月及以上生存率,各研究间无统计学异质性(P=0.960,I 2=0),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者的12个月生存率显著高于对照组[OR=2.69,95%CI(1.59,4.56),P<0.001],详见图4。
2.3.4 治疗后血清VEGF水平 8项研究[16,18-19,21,24-26,29]报道了治疗后血清VEGF水平,各研究间有统计学异质性(P<0.001,I 2=97.1%),采用随机效应模型进行Meta分析,详见图5。Meta分析结果显示,试验组患者治疗后VEGF水平显著低于对照组[SMD=-3.64,95%CI(-5.06,-2.22),P<0.001]。
2.3.5 治疗后血清MMP-9水平 6项研究[16,18,24-26,29]报道了治疗后血清MMP-9水平,各研究间有统计学异质性(P<0.001,I 2=92.8%),采用随机效应模型进行Meta分析,详见图6。Meta分析结果显示,试验组患者治疗后血清MMP-9水平显著低于对照组[SMD=-3.21,95%CI(-4.31,-2.10),P<0.001]。
2.3.6 治疗后血清AFP水平 3项研究[19,23,27]报道了治疗后血清AFP水平,各研究间有统计学异质性(P<0.001,I 2=98.3%),采用随机效应模型进行Meta分析,详见图7。Meta分析结果显示,试验组患者治疗后血清AFP水平显著低于对照组[SMD=-3.54,95%CI(-7.03, -0.06),P=0.046]。
2.3.7 不良反应 14项研究[14-17,19-20,22-29]报道了不良反应发生情况。试验组患者骨髓抑制、发热、恶心呕吐发生率均显著低于对照组,而腹泻、血压升高、蛋白尿、手足综合征发生率均显著高于对照组(P<0.05);两组患者腹痛、皮肤瘙痒发生率比较,差异均无统计学意义(P>0.05),详见表3。
2.4 敏感性分析
以治疗后血清MMP-9水平为有效性指标进行敏感性分析,在剔除杨庆等[25]的研究后,各研究间无统计学异质性(P=0.182,I 2=35.9%),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者治疗后血清MMP-9水平显著低于对照组[SMD=-2.20,95%CI(-2.47,-1.92),P<0.001],与“2.3.5”项一致,提示结果稳定、可信。以蛋白尿发生率为安全性指标进行敏感性分析,在剔除杨嘉文[16]的研究后,各研究间无统计学异质性(P=0.844,I 2=0),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者蛋白尿发生率显著高于对照组[OR=27.30,95%CI(9.06,82.26),P<0.001],与“2.3.7”项一致,提示结果稳定、可信。
2.5 发表偏倚分析
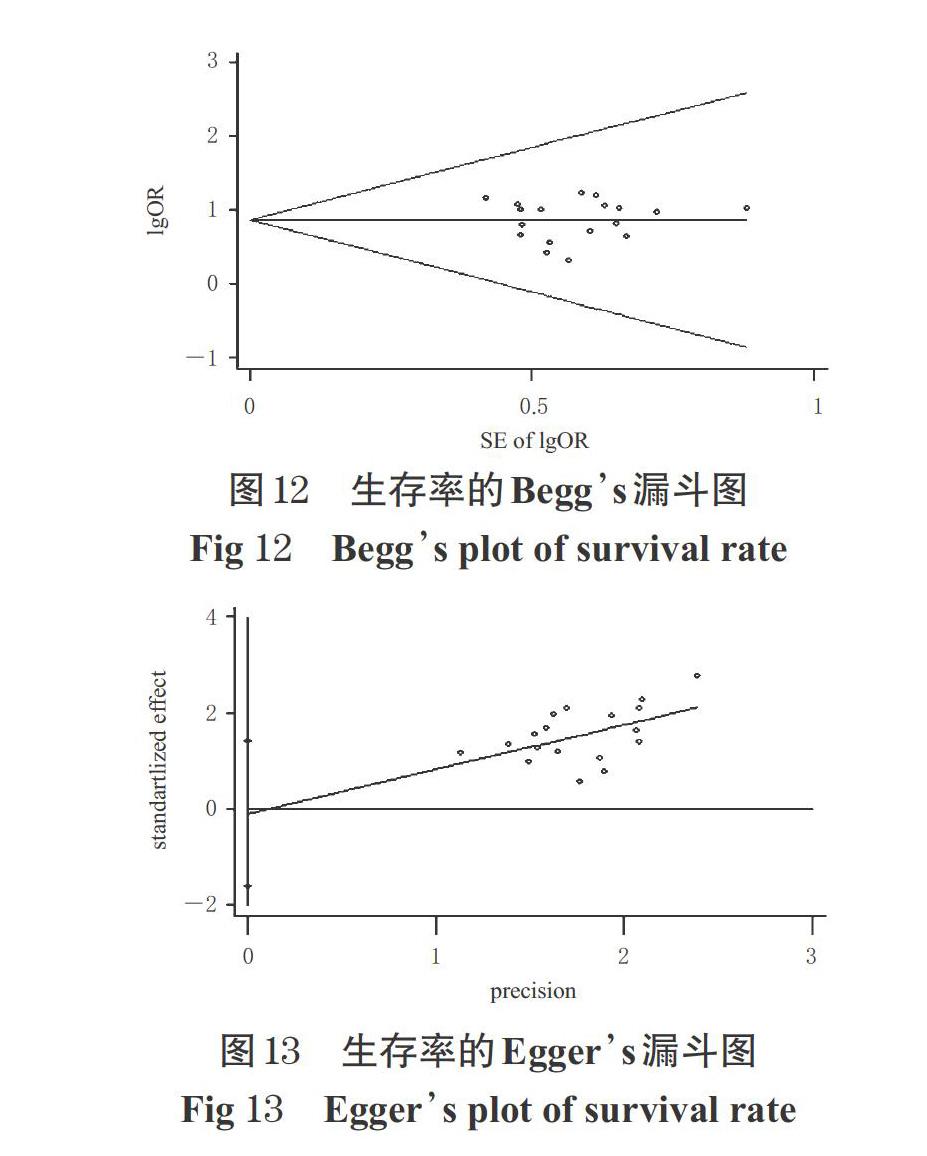
以ORR、DCR、生存率为指标,分别采用Beggs检验和Eggers检验进行发表偏倚分析,以每项独立研究OR值对数的标准误为横坐标、OR值的对数为纵坐标绘制漏斗图,结果见图8~图13。由图8~图13可见,ORR的 Beggs检验的P值为0.124,大于0.05,提示存在发表偏倚的可能性较小;Eggers检验的P值为0.017,小于0.05,提示存在一定发表偏倚。 DCR的Beggs检验的P值为0.112,Eggers检验的P值为0.21,均超过0.05,提示存在发表偏倚的可能性较小。生存率的Beggs检验的P值为0.495,Eggers检验的P值为0.899,均超过0.05,提示存在发表偏倚的可能性较小。
3 討论
肝癌是发病率高、预后较差的恶性肿瘤,由于早期症状不明显、病灶隐匿且进展迅速,多数患者确诊时已处于中晚期甚至已转移[4]。根据国内外肝癌的诊疗规范与实践指南,TACE术为中晚期肝癌患者的一线推荐治疗方案[30-32]。TACE术可直接增加肿瘤组织局部的化疗药物浓度,增强药物的杀伤作用;可阻断肿瘤细胞的血液供应,导致其缺血、缺氧,促使肿瘤细胞坏死、凋亡[8-10]。但 TACE术后,残存的肝癌细胞可因缺血、缺氧而导致VEGF(与肿瘤血管生成紧密相关)表达增加,引起转移和复发[33-34]。有研究认为,MMP-9在肿瘤血管生成、肿瘤生长及转移中具有重要作用,可与VEGF协同刺激新生血管生成,使残存的肝癌细胞通过新生血管获得营养物质而致肿瘤复发及转移[18,35-36] 。AFP是肝癌特异性标志物,在肝癌诊断及早期筛查中具有重要意义,AFP的高表达提示肝癌患者预后不良[37]。由此推测,TACE术后联合使用抗血管生成的靶向药物,可能是提高肝癌患者疗效的有效途径。
阿帕替尼为一种新型的小分子酪氨酸激酶抑制剂,其与血管内皮细胞生长因子受体2(VEGFR-2)的亲和力是索拉非尼(该药是被多个国家批准用于晚期肝癌的一线用药)的10倍[7-8],可通过竞争性抑制VEGF与VEGFR-2的结合来阻断肿瘤细胞新生血管生成,并抑制肿瘤细胞增殖、迁移[38-40]。该药自2014年获批上市用于治疗晚期胃癌及胃-食管结合部腺癌以来,已有大量临床研究结果显示,阿帕替尼在多种实体瘤(包括肝癌)中显示出良好的抗肿瘤活性,且副作用可控性较高[41-44]。此外,阿帕替尼还可通过改善肿瘤细胞的多药耐药来提高传统化疗药物(尤其是铂类)的疗效[45],为中晚期肝癌的治疗提供了新的选择。
本研究结果显示,试验组患者ORR、DCR、生存率均显著高于对照组,提示阿帕替尼联合TACE术可显著提高患者的临床疗效、延长其生存时间。试验组患者治疗后血清VEGF、MMP-9、AFP水平均显著低于对照组,提示阿帕替尼联合TACE术可降低患者体内VEGF、MMP-9、AFP的表达,阻止肿瘤细胞新生血管的生成,减少肿瘤复发及转移,改善患者预后。安全性方面,试验组患者骨髓抑制、发热、恶心呕吐发生率均显著低于对照组,但腹泻、血压升高、蛋白尿、手足综合症发生率均显著高于对照组,两组患者腹痛、皮肤瘙痒发生率比较差异均无统计学意义,提示阿帕替尼联合TACE术可减少骨髓抑制、发热、恶心呕吐等TACE术后相关不良反应的发生,但会增加腹泻、血压升高、蛋白尿、手足综合征等阿帕替尼相关不良反应的发生[37]。本研究纳入文献中,试验组有3例患者并发严重的手足综合征,其中有2例患者因此终止治疗[28];其余患者耐受良好或症状轻微,予以减少剂量、暂停给药及对症处理后均好转,表明患者对阿帕替尼引起的不良反应基本耐受。
综上所述,阿帕替尼联合TACE术能显著提高中晚期肝癌患者的临床疗效、延长生存时间、减少肿瘤复发及转移,并减少TACE术后相关不良反应的发生,但可增加阿帕替尼相关不良反应的发生。本研究的局限性为:(1)纳入研究的样本量较小,可能存在一定的发表偏倚;(2)纳入文献质量不高;(3)多数研究未描述随机分组方法及盲法,且均未报告分配隐藏方法,可能存在选择性偏倚和实施性偏倚;(4)受试者均为国内肝癌患者,其结果可能仅适用于我国患者。故此结论尚需更多高质量、多中心、大样本的RCT进一步证实。
参考文献
[ 1 ] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Global
cancer statistics 2018: GLOBOCAN estimates of incidence
and mortality worldwide for 36 cancers in 185 countries[J].
CA Cancer J Clin,2018,68(6):394-424.
[ 2 ] European Association for the Study of the Liver,Electronic Address:Easloffice@Easloffice.eu,European Association for the Study of the Liver. EASL clinical practice guidelines:management of hepatocellular carcinoma[J]. J Hepatol,2018,69(1):182-236.
[ 3 ] 崔海忠,戈伟,曹德东,等.甲磺酸阿帕替尼联合肝动脉栓塞化疗治疗中晚期原发性肝癌的效果[J].中国医药导报,2019,22(14):88-91.
[ 4 ] OZAKYOL A. Global epidemiology of hepatocellular carcinoma(HCC epidemiology)[J]. J Gastrointest Cancer,2017,48(3):238-240.
[ 5 ] 杨泽冉,苏天昊,尉建安,等.肝动脉化疗栓塞术联合阿帕替尼治疗中晚期原发性肝癌疗效评价[J].中国肿瘤临床,2017,44(17):880-885.
[ 6 ] YANG Z,CHEN G,CUI Y,et al. The safety and efficacy of TACE combined with apatinib on patients with advanced hepatocellular carcinoma:a retrospective study[J]. Cancer Boil Ther,2019,20(3):321-327.
[ 7 ] 武姗,花瞻,李建晨,等.阿帕替尼联合其他方法治疗肿瘤的研究进展[J].肿瘤防治研究,2019,46(3):275-280.
[ 8 ] CHEN S,YU W,ZHANG K,et al. Comparison of the efficacy and safety of transarterial chemoembolization with and without apatinib for the treatment of BCLC stage C hepatocellular carcinoma[J]. BMC Cancer,2018. DOI:10.1186/s12885-018-5081-3.
[ 9 ] 陆阳,姜永能,万程,等.阿帕替尼联合TACE治疗中晚期肝细胞癌的疗效研究[J].介入放射学杂志,2019,28(2):162-165.
[10] LIU C,XING W,SI T,et al. Efficacy and safety of apatinib combined with transarterial chemoembolization for hepatocellular carcinoma with portal venous tumor thrombus:a retrospective study[J]. Oncotarget,2017,8(59):100734-100745.
[11] 孙燕.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2007:147-155.
[12] HIGGINS JPT,GREEN S. Cochrane handbook for systematic reviews of interventions version 5.1.0[EB/OL].(2011-03-12)[2018-08-18]. http://www.cochranehand- book.org.
[13] JADAD AR,MOORE RA,CARROLL D,et al. Assessing the quality of reports of randomized clinical trials:is blinding necessary? [J]. Control Clin Trials,1996,17(1):1-12.
[14] ZHU Y,FENG B,MEI L,et al. Clinical efficacy of TACE combined with apatinib in the treatment of advanced hepatocellular carcinoma[J]. J BUON,2019,24(2):608-614.
[15] LU W,JIN XL,YANG C,et al. Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma:a single-center randomized controlled trial[J]. Cancer Biol Ther,2017,18(6):433-438.
[16] 杨嘉文. TACE分别联合微波消融、125I放射性粒子植入及阿帕替尼靶向治疗大肝癌的疗效比较[J].中国医师杂志,2019,13(8):1190-1194.
[17] 白松涛,张月蒙. TACE联合阿帕替尼对晚期肝癌的临床疗效[J].中国现代医生,2018,12(2):90-92、95.
[18] 李威,满文玲,郭欢庆,等. TACE联合甲磺酸阿帕替尼治疗中晚期肝癌的临床研究[J].肿瘤药学,2017,12(1):74-78.
[19] 黎莹,杨冬阳,赖晓嵘,等.阿帕替尼联合TACE对肝癌患者AFP、VEGF和CEA的影响[J].肝脏,2018,23(5):426-430.
[20] 曾筱怡.阿帕替尼联合TACE治疗原发性肝癌的临床研究[J].基层医学论坛,2018,22(11):1442-1444.
[21] 王兰荣,王钖,曹旸,等.阿帕替尼联合动脉栓塞介入治疗肝癌的效果及对血管内皮生长因子和凋亡相关因子的影响[J].国际医药卫生导报,2017,23(7):1015-1017.
[22] 曾广源,吴龚丽莉,郑文,等.阿帕替尼片联合肝动脉化疗栓塞术治疗中晚期原发性肝癌的临床研究[J].中国临床药理学杂志,2018,34(23):2693-2696.
[23] 李薇.不同方法治疗晚期肝癌的效果[J].中国处方药,2019,17(5):131-132.
[24] 黄锐,姚立正,李文会,等.肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗中晚期肝癌的疗效及安全性评价[J].肿瘤,2018,38(10):965-972.
[25] 杨庆,潘松松,施昌盛,等.甲磺酸阿帕替尼联合TACE治疗中晚期肝癌的效果及对患者血清VEGF和MMP-9的影响[J/CD].中华介入放射学电子杂志,2019,7(2):111- 116.
[26] 黄江远,黄维,朱桥华.经导管肝动脉化疗栓塞联合甲磺酸阿帕替尼在中晚期肝细胞癌中的应用[J/CD].中国肝脏病杂志:电子版,2017,10(4):78-81.
[27] 吴彦彦.经肝动脉化疗栓塞术联合阿帕替尼對中晚期原发性肝癌患者血清甲胎蛋白异质体的影响[J].中医药临床杂志,2019,31(4):736-738.
[28] 沈玲,杨秀丽,亚国伟,等.小剂量阿帕替尼联合TACE治疗晚期肝癌临床观察[J].广州医药,2019,48(2):72-75.
[29] 何凡,陈旭东,林振文,等.中晚期肝癌患者应用经导管肝动脉化疗栓塞(TACE)联合阿帕替尼治疗的效果分析[J].肿瘤药学,2018,8(3):382-386.
[30] 郑可心,韩冰,祁兴顺,等.《2018年美国肝病学会实践指导:肝细胞癌的诊断、分期和管理》摘译[J].临床肝胆病杂志,2018,34(6):1181-1182.
[31] 葛宁灵,薛同春,叶胜龙. 《2018年欧洲肝病学会临床实践指南:肝细胞癌的管理》解读[J].临床肝胆病杂志,2018,34(6):1187-1190.
[32] 吴孟超,汤钊献,刘允怡,等.原发性肝癌诊疗规范:2019年版[J].中国实用外科杂志,2020,40(2):121-138.
[33] 何健,陈晓明. 2018年肝癌TACE治疗研究进展[J].循证医学,2019,19(1):21-22、38.
[34] 崔建东,罗敏,李涛,等.阿帕替尼联合肝动脉化疗栓塞治疗中晚期肝癌的疗效及安全性分析[J].现代肿瘤医学,2019,27(14):2553-2556.
[35] FAN W,YUAN G,FAN H,et al. Apatinib combined with transarterial chemoembolization in patients with hepatocellular carcinoma and portal vein tumor thrombus:a multicenter retrospective study[J]. Clin Ther,2019,41(8):1463-1476.
[36] LIU J,XU J,ZHANG W,et al. Safety and efficacy of drug-eluting bead transarterial chemoembolization com- bined with apatinib in patients with advanced hepatocellular carcinoma[J]. Acad Radiol,2019. DOI:10.1016/j.acra.2019.07.003.
[37] 武健,尹芳,罗贯虹,等.经肝动脉化疗栓塞术联合阿帕替尼治疗中晚期原发性肝癌的效果及安全性分析[J].临床肝胆病杂志,2018,34(4):775-778.
[38] SCOTT AJ,MESSERSMITH WA,JIMENO A. Apatinib:a promising oral antiangiogenic agent in the treatment of multiple solid tumors[J]. Drugs Today:Barc,2015,51(4):223-229.
[39] ZHANG H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther,2015. DOI:10.2147/DDDT.S97235.
[40] GENG R,LI J. Apatinib for the treatment of gastric cancer[J]. Expert Opin Pharmacother,2015,16(1):117-122.
[41] LI J,QIN S,XU J,et al. Randomized,double-blind,placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy:refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol,2016,34(13):1448-1454.
[42] KOU P,ZHANG Y,SHAO W,et al. Significant efficacy and well safety of apatinib in an advanced liver cancer patient:a case report and literature review[J]. Oncotarget,2017,8(12):20510-20515.
[43] 胡猛,刘星,刘静,等.阿帕替尼治疗恶性肿瘤研究进展[J].中国老年学杂志,2018,38(19):4858-4861.
[44] 王茂勋,关露露,陈小兵.阿帕替尼治疗恶性肿瘤的现状和进展[J].肿瘤研究与临床,2018,30(4):281-285.
[45] 张雪慧.阿帕替尼联合TACE治疗对原发性肝癌的疗效及安全性研究[D].邯郸:河北工程大学,2019.
(收稿日期:2019-11-03 修回日期:2020-04-28)
(編辑:陈 宏)
