凡纳滨对虾miRNA-184克隆与表达分析
2020-07-01梁金荣许銮佳申玉春
梁金荣,许銮佳,李 玲,郭 慧,申玉春
凡纳滨对虾克隆与表达分析
梁金荣,许銮佳,李 玲,郭 慧,申玉春
(广东海洋大学水产学院 / 湛江市海洋生态与养殖环境重点实验室,广东 湛江 524025)
【目的】研究凡纳滨对虾()miRNA-184 [microRNA-184(miR-184),记作]在健康虾及染病虾中的表达,探讨其免疫功能。【方法】用茎环法克隆鉴定凡纳滨对虾,通过荧光定量PCR检测在对虾血淋巴、肝胰腺、鳃、肌肉、心脏、胃、肠和眼柄等8个组织中的分布。对凡纳滨对虾注射副溶血弧菌(),检测不同时间点的响应变化。对感染副溶血弧菌的凡纳滨对虾分别注射0.3、3.0和30.0 ng的miR-184模拟物和抑制物,检测不同时间点对虾血细胞凋亡率。【结果与结论】在所有组织中均有表达,在胃中表达量最高,其次是肌肉,鳃表达量最低。注射副溶血弧菌后1.5 h,表达量显著上调;在24 h达到峰值,较对照组高8.25倍;对照组则维持在较低的水平。模拟物、抑制物注射量为30 ng时对虾血细胞凋亡率差异有统计学意义(<0.05);与对照组凋亡率相比,注射模拟物6 h后提高62 %。可调控凡纳滨对虾的血细胞凋亡。
凡纳滨对虾;microRNA;基因克隆;基因表达;细胞凋亡
凡纳滨对虾 () 具有市场需求量大、经济价值高、肉质鲜美等优点[1]。但对虾规模化养殖带来病害频发问题,严重制约了对虾养殖业的发展[2]。因此研究对虾病害机制,对促进对虾产业健康发展有重要意义。
miRNA 是一种由17 ~ 25个核苷酸组成的非编码RNA[3],其生物调控作用广泛,囊括细胞的分化、增殖、凋亡等过程[4];miRNA与信使RNA(mRNA)转录原理相近,作为一种内源RNA,miRNA有转录后调控的特性[5],主要表现为抑制mRNA翻译或者降解mRNA[6-7]。对虾有强大的非特异性免疫系统[8],血淋巴为主要的免疫器官之一,在病原体入侵时,血细胞主要以吞噬、包囊和形成结节等方式发挥免疫作用[9]。血细胞程序性凋亡是对虾保持内环境稳态、对抗病菌入侵的方式之一[10]。有研究表明,日本囊对虾()miRNA()介导诱发血细胞凋亡在对虾对抗WSSV感染中起作用[11],斑节对虾()感染WSSV后,miR-184()也发生明显变化[11],推测miR-184可能与白斑综合征感染有关。关于miR-184在对虾中的功能需进一步研究。笔者克隆凡纳滨对虾(记作),通过实时荧光定量PCR研究组织表达特征和应答副溶血弧菌()的表达模式,探究在对虾血细胞凋亡的调控作用,为对虾抗病免疫机制探索及其病害防治提供参考。
1 材料与方法
1.1 实验动物及细菌原液
凡纳滨对虾体质量(12.0 ± 0.5)g,取自湛江市东海岛养殖基地。在规格为0.5 m× 0.8 m × 0.5 m的水族箱中暂养7 d,海水盐度24,水温26 ~ 29 ℃,保持连续充气;每日按照对虾体质量5%投喂3次,日换水量1/4。副溶血弧菌由广东省水产经济动物病原生物学及流行病学重点实验室赠送,于–80℃下超低温保存。
1.2 总RNA提取及cDNA的合成
采用Trizol 试剂盒(Invitrogen,货号15596018,美国)提取总RNA。用10 mg/mL的琼脂糖凝胶电泳检测RNA,并用Nanodrop 2000 超微量核酸蛋白测定仪(Thermo Scientific,美国)检测浓度和质量。所有 RNA 样品各取1 μg,按照PrimeScript™ RTreagent Kit with gDNA Eraser (Perfect Real Time) 试剂盒(TaKaRa, RR047A,日本),根据庞鑫等[12]改进方法,用miR-184 RT(50 μmol/L)取代试剂盒中的RT Primer Mix合成cDNA。
1.3 MicroRNA-184测序及鉴定
根据凡纳滨对虾miRNA文库[13]获取miR-184成熟体序列,根据成熟序列运用primer 5软件设计引物、miR-184 mimics和miR-184 inhibitors,并送往上海生工生物技术有限公司合成(表1)。采用2 × PCR master MIX(上海生工)进行克隆扩增。PCR反应体系:2 × PCR master MIX 25 μL,miR- F 2 μL,miR-184R 2 μL,cDNA 2 μL,ddH2O 19 μL。扩增程序:95 ℃ 1.5 min;95 ℃ 30 s,55 ℃ 15 s,72 ℃ 1 min,40个循环;最后72 ℃下延伸1 min。取PCR产物2 μL 用聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE)确认目的片段。将剩余PCR产物送往上海生工生物技术有限公司用miR-F引物进行测序。

表1 引物
1.4 凡纳滨对虾miR-184组织表达
取健康凡纳滨对虾9尾,暂养1周后分别取血淋巴、肝胰腺、鳃、肌肉、心脏、胃、肠和眼柄等8个组织于冻存管中保存,按照每3尾虾的组织混合成一管,实验设定3个重复,所取组织于液氮速冻保存备用;注射器用ACD抗凝剂(柠檬酸0.48 g、柠檬酸钠1.32 g、葡萄糖1.47 g,用双蒸水定容至100 mL,过滤灭菌)润洗后抽出血淋巴,以4 ℃、6 000 r/min条件离心5 min,吸去上清,加入500 μL TRIzol,混匀,于– 80 ℃下保存。RNA提取和cDNA合成根据1.2进行。荧光定量PCR反应体系:2× SYBR Green Mix (TOYOBO, Japan) 12.5 μL,miR-F 1 μL,miR-184 R 1 μL,cDNA 1 μL,ddH2O 9.5 μL。反应条件:95 ℃ 1.5 min;95 ℃ 30 s,55 ℃ 15 s,72 ℃ 1 min,40个循环;最后72 ℃下延伸1 min。收集数据以进行后续分析。
1.5 感染副溶血弧菌后凡纳滨对虾miR-184的表达
在凡纳滨对虾第4步足基部注射浓度为1× 107、1× 108、1× 109CFU/mL的副溶血弧菌,确定24 h半致死浓度(LC50)为1× 109CFU/mL。同法对凡纳滨对虾以LC50攻毒,分别收集0、1.5、3、6、12、24、48、72 h的肝胰腺(72 h时,因存活虾数量已无法满足取样所需,无法得到72 h的组织表达结果)于液氮速冻,按照1.2方法进行总RNA提取和cDNA的合成。
1.6 模拟物和抑制物注射量确定
用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理过的磷酸盐缓冲液(PBS)稀释模拟物和抑制物,设梯度为0.01、0.10和1.00 ng/μL;实验分为7组,记为C、m1、m2、m3、i1、i2、i3组,每组虾9尾,注射量为30 μL。对C组注射1×PBS;m1、m2、m3组按照设定梯度注射模拟物;i1、i2、i3组按设定梯度注射抑制物,注射24 h后收集肝胰腺于液氮速冻,按照1.2方法进行总RNA提取和cDNA的合成;PCR体系:2 × PCR master MIX 25 μL,miR- F 2 μL,miR-184 R 2 μL,cDNA 2 μL,ddH2O 19 μL。扩增程序:95 ℃ 1.5 min;95 ℃ 30 s,55 ℃ 15 s,72 ℃ 1 min,40个循环;最后72 ℃下延伸1 min。取PCR产物用琼脂糖凝胶电泳确认目的片段。
1.7 MiR-184过表达和抑制表达对血细胞凋亡的影响
对感染副溶血弧菌的凡纳滨对虾分别注射模拟物和抑制物30 ng,6 h后,按照卓宏标等[14]方法,取虾9尾,每尾抽取血淋巴200 μL,按体积比1∶1与ACD抗凝剂混合,于冰上保存备用。通过Annexin V/PI apoptosis kit(联科生物,AP101)试剂盒检测血细胞凋亡,按照试剂盒方案进行冰上避光染色30 min,用流式细胞术检测细胞凋亡率,设定仪器读取10 000个细胞,每管血淋巴重复检测3次。血细胞凋亡率计算:
血细胞凋亡率(%)=(Annexin V FITC光密度值+ PI光密度值)/ 10 000。
1.8 数据处理
荧光定量数据通过2-ΔΔCT法[7]计算相对表达量,所得数据采用SPSS18.0进行单因素方差分析,并运用Duncan法进行多重比较,通过Excel作图。
2 结果
2.1 LvmiR-184克隆鉴定
PAGE结果显示,PCR产物长度约60 bp(图1),符合预期长度,电泳条带单一且明亮清晰。测序结果显示,miR-184成熟体(mature miR-184)序列(5′–TGGACG GAGAACTGATAAGGGT–3′)与本课题组建立的miRNA文库[13]吻合。

M,DNA maker DL 600;C,空白对照;U6,U6内参;184,miR-184
2.2 凡纳滨对虾LvmiR-184组织表达分析
在8个组织中的表达情况见图2。结果表明,在所有组织中均有表达,在胃中表达量最高,其次是肌肉,鳃的表达量最低。

**,与鳃组织比较< 0.01
图2 凡纳滨对虾在不同组织的表达
Fig. 2 Expression ofin different tissues
2.3 感染副溶血弧菌后凡纳滨对虾miR-184的响应
注射1× 109CFU/mL菌液0、1.5、3、6、12、24、48 h时表达结果见图3。与各时间点对照组相比,注射弧菌1.5 h后,开始上调(< 0.01),24 h时达到峰值,其中1.5 h上调3.47倍,24 h上调 8.25倍。

**,与对照组比较P < 0.01
2.4 模拟物和抑制物注射量确定
由图4A可见,注射30 ng的模拟物组电泳条带的亮度明显高于其他组;由图4B可见注射30 ng的抑制物组条带亮度较暗,与i1、i2组、对照组区别不明显;30 ng的注射量可达到过表达目的,该注射量可用于后续实验。

M, DL 2000 DNA 分子标记;c, 对照组;m1, 0.3 ng模拟物;m2, 3 ng模拟物;m3, 30 ng模拟物;u6, u6内参;i1, 0.3 ng抑制物;i2, 3 ng抑制物;i3, 30 ng抑制物
2.5 LvmiR-184过表达和抑制表达对血细胞凋亡的影响
流式细胞术检测结果如图5、6所示。结果表明,过表达显著提升血细胞的凋亡率(< 0.01),注射模拟物后,相对于对照组,血细胞凋亡率提升显著。注射抑制物后未能显著降低血细胞的凋亡率(>0.05)。
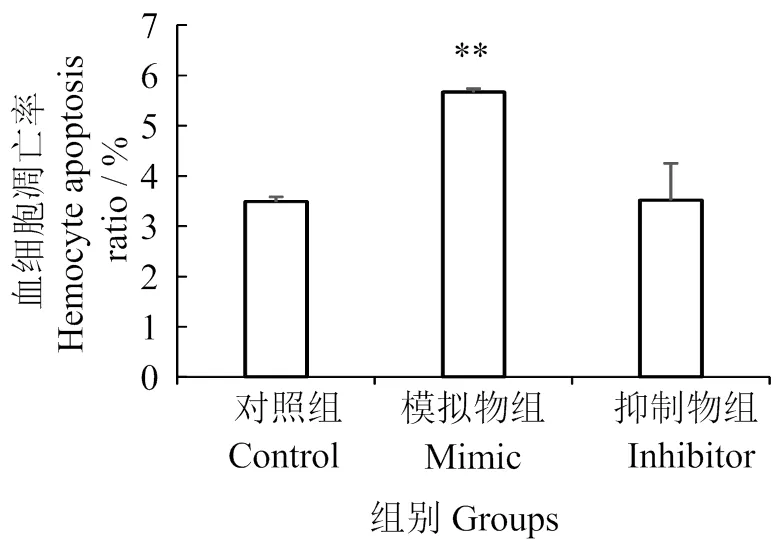
**,与对照组比较P < 0.01
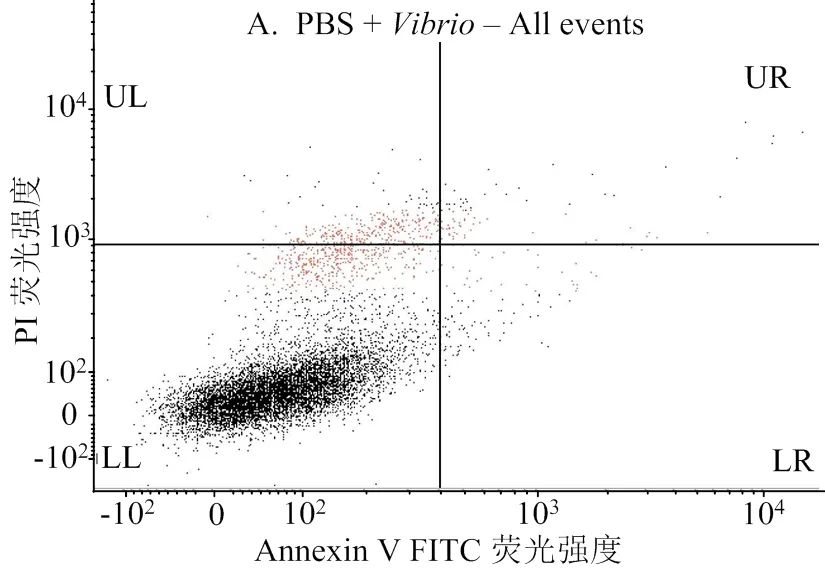
A,注射弧菌;B,注射弧菌+抑制物;C,注射弧菌+模拟物
A, vibrio injection; B, vibrio + inhibitor injection; C, vibrio + mimics injection
图6 流式细胞术检测血淋巴凋亡情况
Fig. 6 Flow cytometry for detection of hemocyte apoptosis
3 讨论
在哺乳动物中,可调节干细胞的增殖与分化、癌症的发生、细胞凋亡等过程[15-16]。Wang等[17]发现,可被活性氧(reactive oxygen species, ROS) 氧化,氧化后的miR-184与Bcl-xL和Bcl-w错配,进而引发细胞凋亡。刘秀娟[18]发现,miR-184有调节大鼠 () 肾小球系膜细胞衰老进程作用。此外,Xu等[19]研究发现,克氏原螯虾()在投喂大黄素后出现明显的差异表达,表明可能参与了甲壳动物的生长、代谢等过程。本研究克隆鉴定凡纳滨对虾,在眼柄、肝胰腺和胃等组织中高表达,表明可能参与对虾机体内多种调控作用。
Yang[20]研究表明,在日本囊对虾()对抗白斑病毒感染中表达量变化较大;Ou等[21]研究发现,克氏原螯虾在受到蟹螺原体()刺激后表达量显著上调;Xu Peng等[22]发现,河南华溪蟹()在应对镉(Cd)诱导的氧化应激反应中显著上调。上述研究结果表明,在甲壳动物中具有潜在的免疫功能。本研究发现,用副溶血弧菌攻毒凡纳滨对虾后,注射后1.5 h时,表达显著上调,并持续到实验结束,表明具有免疫调节功能。
本研究中,以成熟体为模板设计合成模拟物和抑制物,设定注射量为30 ng;通过注射模拟物发现在凡纳滨对虾体内的含量明显增加,而注射抑制物未能降低在凡纳滨对虾体内的含量表明注射模拟物可产生过表达作用。注射抑制物抑制表达作用不明显,可能原因是合成抑制物未加3′ 端化学修饰,使得抑制物无法与发生竞争性结合或者结合。Hughes等[23]发现,模拟物在人类眼角膜中形成有效的过表达浓度为15 ng,与本研究不同,可能是因为物种间对microRNA的敏感度不同。在甲壳动物中,对虾仅有非特异性免疫系统,其免疫功能包括吞噬、包囊等;血淋巴作为对虾非特异性免疫器官之一,在对抗病菌、异物入侵等免疫过程起重要作用[9,24]。吞噬、包囊作用发生后,细胞开始程序性凋亡是保持机体内稳态的一个重要的机制[25-26]。本研究表明,过量表达可增加血细胞凋亡率,表明可能参与了凡纳滨对虾细胞凋亡途径;抑制表达未显著降低血细胞凋亡率,结合结果2.4发现注射30 ng的抑制物效果不理想,未能抑制的表达,导致抑制物注射组血细胞凋亡率与对照组不显著。
研究结果为了解对虾抗病免疫机制,进而防治对虾病害提供参考。
[1] 王铵静, 杨奇慧, 谭北平, 等. 大豆酶解蛋白对凡纳滨对虾幼虾生长性能、血清生化指标、非特异性免疫力和抗病力的影响[J]. 广东海洋大学学报, 2018, 38(1): 14-21.
[2] 黄雪敏, 梁华芳, 薛明, 等. 凡纳滨对虾烂尾病病原的分离鉴定及药敏分析[J]. 广东海洋大学学报, 2019, 39(4): 42-48.
[3] 杨浩. miR-140-5p通过靶向调节TGFBR1和FGF9抑制肝细胞癌增殖和侵袭转移[D]. 长沙:中南大学, 2013. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&filename=1013358098.nh.
[4] 陈辉, 王赛, 汪丽娜. microRNA-214在心脏保护作用的研究进展[J]. 湖北科技学院学报(医学版), 2019, 33(6): 543-547.
[5] 闸雯俊, 常萌, 游艾青. microRNA对昆虫生长和发育的调控[J]. 湖北农业科学, 2019, 58(22): 198-202;210.
[6] 成磊. miRNA介导靶基因沉默的分析与识别[D]. 南京:南京航空航天大学, 2011. http://cdmd.cnki.com.cn/ Article/CDMD-10287-1011292071.htm
[7] 池明. 采用人造小RNA技术抑制马铃薯多酚氧化酶的研究[D]. 杨凌:西北农林科技大学, 2014. http://cdmd. cnki.com.cn/Article/CDMD-10712-1015513129.htm.
[8] 陶梦圆, 李长平, 伦镜盛, 等. 源于凡纳滨对虾血蓝蛋白的化学合成肽段的免疫调控活性[J]. 中国水产科学, 2019, 26(5): 844-851.
[9] 章双, 黎铭, 董晓慧, 等. 凡纳滨对虾输入蛋白α1基因的克隆与表达分析[J]. 广东海洋大学学报, 2016, 36(3): 1-8.
[10] 卢芷程, 许銮佳, 卢文宇, 等. 溶藻弧菌对凡纳滨对虾血细胞毒性及细胞凋亡和免疫相关基因的影响[J]. 南方农业学报, 2018, 49(12): 2559-2565.
[11] KAEWKASCHOLKUL N, SOMBOONVIWATB K, ASAKAWA S, et al. Shrimp miRNAs regulate innate immune response against white spot syndrome virus infection[J]. Developmental & Comparative Immunology, 2016, 60: 191-201.
[12] 庞鑫, 马春林, 廖世奇, 等. 小鼠肝脏MicroRNA的提取与分离[J]. 中国生物化学与分子生物学报, 2011, 27(11): 1067-1072.
[13] GUO H, LU Z C, ZHU X W, et al. Differential expression of microRNAs in hemocytes from white shrimpunder copper stress[J]. Fish & Shellfish Immunology, 2018, 74: 152-161.
[14] 卓宏标, 郑秋耀, 梁华芳, 等. 波纹龙虾蜕壳周期的呼吸排泄和血淋巴生理学[J]. 广东海洋大学学报, 2019, 39(5): 24-30.
[15] LIU C M, TENG Z Q, SANTISTEVAN N J, et al. Epigenetic regulation of miR-184 by MBD1 governs neural stem cell proliferation and differentiation[J]. Cell Stem Cell, 2010, 6(5): 433-444.
[16]EMDAD L, JANJIC A, AlZUBI M A, et al. Suppression of miR-184 in malignant gliomas upregulates SND1 and promotes tumor aggressiveness[J]. Neuro-Oncology, 2015, 17(3): 419-429.
[17] WANG J X, GAO J, DING S L, et al. Oxidative modification of miR-184 enables it to target Bcl-xL and Bcl-w[J]. Molecular Cell, 2015, 59(1): 50-61.
[18] 刘秀娟. MiR-184和miR-150通过靶向自噬基因促进肾脏系膜细胞衰老[D]. 北京:中国人民解放军医学院, 2014. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode =CDFD&dbname=CDFD&filename=1015521650.nh.
[19] XU W N, LIU W B, YANG W W, et al. Identification and differential expression of hepatopancreas microRNAs in red swamp crayfish fed with emodin diet[J]. Fish & Shellfish Immunology, 2014, 39(1): 1-7.
[20] YANG L, YANG G, ZHANG X B. The miR-100-mediated pathway regulates apoptosis against virus infection in shrimp[J]. Fish & Shellfish Immunology, 2014, 40(1): 146-153.
[21] OU J T, LI Y, DING Z F, et al. Transcriptome-wide identification and characterization of themicroRNAs potentially related to immunity againstinfection[J]. Fish & Shellfish Immunology, 2013, 35(2): 607-617.
[22] XU P, GUO H Q, WANG H H, et al. Identification and profiling of microRNAs responsive to cadmium toxicity in hepatopancreas of the freshwater crab[J]. Hereditas, 2019, 156(1): 34.
[23] HUGHES A E, BRADLEY D T, CAMPBELL M, et al. Mutation altering the miR-184 seed region causes familial keratoconus with cataract[J]. The American Journal of Human Genetics, 2011, 89(5): 628-633.
[24] 兰萍, 宋晓玲, 张辉, 等. 美人鱼发光杆菌对凡纳滨对虾非特异性免疫功能及抗病力的影响[J]. 渔业科学进展, 2010, 31(1): 65-73.
[25] GREEN D R. The end and after: how dying cells impact the living organism[J]. Immunity, 2011, 35(4): 441-444.
[26] SUN R, QIU L M, YUE F, et al. Hemocytic immune responses triggered by CpG ODNs in shrimp[J]. Fish & Shellfish Immunology, 2013, 34(1): 38-45.
Molecular Cloning and Expression Analysis of MicroRNA-184 in the White Shrimp ()
LIANG Jin-rong, XU Luan-jia, LI Ling, GUO Hui, SHEN Yu-chun
(,/,524025,)
【Objective】To study the expression of microRNA-184 innamed, and explore its immunologic function.【Method】MicroRNA-184 was cloned and identified by stem-loop method from. The distribution ofin eight tissues and the response changes ofat different times after injected withwas detected by qPCR. The apoptosis ratios of hemocyte ofwhich were infected with, were detected after being injected withmimics and inhibitors of 0.3, 3.0, and 30.0 ng, respectively. 【Result and Conclusion】was expressed in all tissues, with the highest expression in the stomach, followed by the muscle and gill. The expression ofin shrimp infected withwas significantly increased after 1.5 h and reached a peak at 24 h, which was 8.25 times higher than the control; while the control. The results indicated that when the injected amount was 30 ng; it was significantly difference (< 0.05) in the apoptosis rate of shrimp hemocyte, after injection of the mimics or inhibitor. Compared with the control group, the apoptosis rate has increased by 62% at 6 h after injection of the mimics. The results indicate thatcan regulate hemocyte apoptosis in.
; microRNA; gene cloning; gene expression; hemocyte apoptosis
Q78;Q959.223+.63
A
1673-9159(2020)04-0015-06
10.3969/j.issn.1673-9159.2020.04.003
2020-02-20
国家自然科学基金(31600321)
梁金荣(1992-),男,硕士研究生,研究方向为养殖环境保护。E-mail: 981061344@qq.com
申玉春(1964-),男,博士,教授,研究方向为海洋环境与生物资源保护。E-mail: shenyuchun@163.com
梁金荣,许銮佳,李玲,等. 凡纳滨对虾克隆与表达分析[J]. 广东海洋大学学报,2020,40(4):15-20.
(责任编辑:刘庆颖)
