草鱼呼肠孤病毒GCRV 096 VP7蛋白的表达及免疫原性
2020-07-01陈静妮胡海浩闫秀英简纪常
杨 硕,陈静妮,胡海浩,王 雅,闫秀英,简纪常
草鱼呼肠孤病毒GCRV 096 VP7蛋白的表达及免疫原性
杨 硕,陈静妮,胡海浩,王 雅,闫秀英,简纪常
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室 // 水产经济动物病害防控广东普通高校重点实验室,广东 湛江 524088)
【目的】研究草鱼呼肠孤病毒(grass carp reovirus, GCRV)096基因的原核和真核表达及其编码蛋白的免疫原性。【方法】应用RT-PCR技术获得GCRV 096基因,构建GCRV 096基因原核表达载体pET-VP7,用原核表达的GCRV 096 VP7蛋白免疫草鱼()15 d后,用GCRV 096和GCRV GD108分离株对其攻毒,检测GCRV 096 VP7的免疫原性。构建GCRV 096基因真核表达载体pEGFP-N3-VP7,分析其在草鱼CIK细胞中的表达。【结果与结论】GCRV 096基因的开放阅读框ORF (GenBank登录号为JN206665)为831 bp,编码276个氨基酸。成功构建GCRV 096基因原核表达载体pET-VP7,并在大肠杆菌BL21中诱导表达成功;最优表达条件是0.2 mm/L IPTG、28 ℃下表达5 h,通过HisTrap HP柱纯化融合蛋白,Western blot分析结果表明,所表达的蛋白为目的蛋白。经免疫及GCRV攻毒后,GCRV 096(Ⅰ型)免疫组基因的表达水平降低(< 0.05),而GCRV GD108(Ⅱ型)免疫组基因的表达无显著差异,表明GCRV 096 VP7蛋白对GCRV 096具有良好的免疫效果,但对GCRV GD108无明显的免疫效果。成功构建GCRV 096基因真核表达载体pEGFP-N3-VP7,Western blot分析结果表明,GCRV 096 VP7蛋白在草鱼肾(CIK)细胞中成功表达。
草鱼呼肠孤病毒;基因;表达;免疫原性
草鱼呼肠孤病毒(grass carp reovirus, GCRV)引起的草鱼出血病给我国草鱼()养殖业造成了严重损失。目前,草鱼出血病及GCRV研究已取得较大进展。已发现GCRV 4个基因型中的多株GCRV分离株[1-2],且不断有新分离株的报道。在我国分布的GCRV可分为基因型Ⅰ型、Ⅱ型和Ⅲ型。研究表明,不同GCRV基因型分离株间差异较大[3, 4-6],不同基因型与草鱼出血病不同症状间是否存在一定关系有待进一步研究。因此,GCRV的多样性增加了草鱼出血病的防治难度,给草鱼出血病的防治带来新的问题[3,7],GCRV多样性及草鱼出血病防治均有待深入研究。
预防草鱼出血病的最有效途径是疫苗接种,目前对草鱼出血病疫苗的研制和应用已取得一定进展,一定程度上降低了草鱼出血病的发生率和草鱼死亡率。对草鱼出血病疫苗来说,影响疫苗免疫效果的主要因素是疫苗靶位的选择[8-9]。
VP7蛋白是GCRV的结构蛋白,由S10片段编码,在GCRV感染及致病过程中可能起重要作用[10-11]。VP7蛋白的多克隆抗体具有中和活性,可能是GCRV主要的保护性抗原[12]。研究表明,GCRV VP7蛋白具有良好的免疫原性[13-14],人工合成的GCRV基因的表达产物与鼠抗GCRV血清有良好的反应原性[15]。基于大肠杆菌()表面展示表达GCRV 873 VP7蛋白的疫苗具有良好的免疫效果[16]。GCRV VP7蛋白和基因是良好的候选疫苗靶位,这在基于GCRV 873的相关研究中得以证明。GCRV 873 VP7蛋白特性分析、GCRV VP7蛋白基因人工合成等研究[11,15,17]以及基于GCRV 873基因构建的核酸疫苗载体均表明GCRV 873 VP7蛋白有较好的免疫保护效果[11,17]。
VP7蛋白的免疫原性在不同GCRV基因型间是否存在差异有待研究。对GCRV不同基因型分离株间的差异进行研究和解析,可为草鱼出血病疫苗的研制提供重要理论依据。本课题组亦对GCRV 096进行了相关研究[18-20],发现GCRV 096 VP7蛋白含有信号肽和潜在的抗原表位[21]。GCRV 096与GCRV 873属于我国GCRV基因型Ⅰ型,GCRV GD108属于Ⅱ型,笔者研究GCRV 096 VP7蛋白的原核表达,并分析其在不同GCRV基因型间的免疫效果差异,同时在草鱼肾脏(CIK)细胞系中实现GCRV 096 VP7蛋白的真核表达,为GCRV疫苗研发和草鱼出血病的防治研究奠定基础。
1 材料和方法
1.1 材料
pMD18-T载体、pET-28a原核表达载体、真核表达载体pEGFP-N3、大肠杆菌DH5α和BL21 (DE3) 均购自TaKaRa公司,CIK细胞购自深圳检验检疫局。
1.2 GCRV 096和GCRV GD108的分离和纯化
取患出血病草鱼肾脏,粉碎,均浆,以250、500、1 000、3 000、6 000梯度离心,每个梯度离心2 min,最后取上清液至另一离心管,以35 000离心2.5 h,沉淀用pH 7.4的磷酸盐缓冲液(PBS)溶解,分装,于‒80 ℃下保存备用。GCRV 096和GCRV GD108分别属于分布于我国的GCRV基因型Ⅰ型和Ⅱ型[20]。
1.3 GCRVs RNA的提取和反转录
应用TaKaRa公司的MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0试剂盒,按照说明书进行GCRVs基因组总RNA提取。用EasyScript First-Strand cDNA Synthesis SuperMix试剂盒反转录合成cDNA。
1.4 原核重组融合蛋白GCRV 096 VP7的表达与纯化
根据本课题组前期已获得的GCRV 096基因序列(GenBank登录号JN206665)[21],设计用于扩增基因开放阅读框(ORF)含酶切位点的引物是-ORF-F (5′-CTAATGCCACTTCA CATGATTCC-3′,下划线为酶切位点I )和-ORF-R (5′-CCGTTAATCGGATGGC TCCAC-3′, 下划线为酶切位点I )。
PCR扩增体系25 μL,含cDNA模板2 μL、引物(10 μmol/L) 各1 μL、dNTPs (2.5 mmol/L) 各2 μL、10×ExTaq Buffer 2.5 μL、ExTaq (1 U/μL) 0.25 μL、ddH2O 16.25 μL。PCR扩增条件:95 ℃ 5 min;95 ℃ 1 min、61 ℃ 1 min、72 ℃ 2 min,30个循环;于72 ℃下延伸10 min,4 ℃条件下保存。
将GCRV 096基因ORF正确插入pET-28a(+),用菌落PCR扩增、双酶切(I和I)和测序确定正确构建原核表达质粒pET-VP7。
将重组表达质粒pET-VP7转入大肠杆菌BL21,挑取生长良好的单一菌落接种到含Kan (50 μg/mL)的LB液体培养基中,以37 ℃、200 r/min条件振荡培养12 h,按体积比1∶100的比例接种到新配制的含Kan (50 μg/mL) 的液体培养基中,于37 ℃下培养至OD600 nm达0.4 ~ 0.6,加异丙基-β--硫代半乳糖苷(IPTG)至终浓度为1 mmol/L,于37 ℃下继续振荡培养4 h,以10 000 r/min离心2 min,收集菌体,以聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白表达情况。进一步优化重组融合蛋白GCRV 096 VP7的表达条件。
将含有重组质粒的BL21菌接种于200 mL含有卡那霉素的LB液体培养基中,经优化的诱导条件诱导后,离心,收集菌体并进行裂解。经过多重离心、悬浮沉淀,表达的重组蛋白用8 mol/L尿素于4 ℃条件下完全溶解。将获得的重组蛋白用HisTrap HP柱按常规方法进行纯化,分别用50、70、90、110、150、200、250、300 mmol/L咪唑洗脱缓冲液进行洗脱,逐步收集重组表达的融合蛋白,进行SDS-PAGE电泳,并按常规方法进行蛋白转膜,用含50 g/L脱脂牛奶和质量分数0.1%吐温的PBS在室温下阻断1 h,用抗-His鼠抗(1∶1 000,Invitrogen)4 ℃下孵育16 h,再用辣根过氧化物酶标记的羊抗鼠抗体(1∶3 000,Takara)孵育2 h,最后曝光显影。
1.5 GCRV 096 VP7蛋白免疫原性分析
对草鱼(约30 g)腹腔注射0.1 g/L纯化蛋白与PBS、弗氏完全佐剂制备的免疫制剂200 μL,对照组注射200 μL PBS与弗氏完全佐剂 (pH = 7.4),每组草鱼6尾,免疫15 d后,注射100 μL GCRV 096或GCRV GD108 (约2 130 µg/mL,以GCRV 096在CIK细胞的滴度为对照,依定量PCR结果和GCRV基因组质量估算而得) 进行攻毒,于攻毒后的12、24、48、72、96 h剖取实验组草鱼肾脏,每组各取样时间点的草鱼肾脏分别混合成定量PCR样品,定量分析草鱼肾脏中GCRV 096基因的表达量。定量PCR用内参基因为和,引物为βF (5′-GTGAATCGGATACTCTCG G-3′ )、βR (5′ -GCA GACATAACGCAAGGCA-3′)、GF (5′-GGCTGTGCT GTCCCTGTA-3′)和GR(5′-GGGCATAACCCTCGT AGAT-3′ )。基因定量PCR的引物为096F (5′-GGCAGCGAGTCAGCACCTTGTC-3′)、096R (5′-CTACCGCTTGCGTCCGAAATCAC-3′)、108F (5′-TTCGCTTCGGCTATAACAT-3′)和108R(5′-ACAGACAGGCTCTTCCAA-3′)。定量PCR体系(25 μL):水9.5 μL,每条引物0.5 μL (10 pmol/L),SYBR®Premix ExTM12.5 μL,cDNA 2 μL。反应条件:95 °C下预变性3 min;95 °C 10 s、55 °C 30 s,40个循环。定量PCR重复3次。
1.6 统计分析
所得定量PCR数据采用2-∆∆Ct法处理[22],进行配对t检验,应用SPSS15.0统计软件对所得数据进行统计学处理,显著性水平= 0.05。
1.7 GCRV 096 VP7真核表达载体的构建及其在CIK细胞中的表达
将GCRV 096基因的ORF正确插入至真核表达载体pEGFP-N3,进行菌落PCR扩增、双酶切(I和I)和测序,以正确构建真核表达质粒pEGFP-N3-VP7。
将CIK细胞传代至6孔细胞培养板,待细胞覆盖率约85%时,取4 μL无内毒素质粒DNA和10 μL脂质体(Lipofectamin 2000)置于不同离心管,分别用无血清、无抗生素的M199培养基稀释至总体积为250 μL,室温静置5 min,轻轻混合两种液体,室温下静置20 min,两者最终混合体积为500 μL。
混合液静置期间,清除培养板孔中的培养基,用1 mL无血清、无抗生素的M199培养基洗涤细胞3次,清除洗涤液。加入质粒和Lipofectamin 2000的混合液,轻摇,使混合液与细胞充分接触。于25 ℃的恒温培养箱中培养6 h,吸去混合液,改换含体积分数10%胎牛血清的M199培养基培养。转染24 h后用荧光显微镜观察细胞内的荧光分布情况。
转染24 h后,分别将对照正常、已转染pEGFP-N3和已转染pEGFP-N3-VP7的CIK细胞培养皿置于冰上,分别用冰预冷的PBS漂洗两次,加入150 μL细胞裂解液,刮取细胞移入1.5 mL EP管中,以3 000 r/min离心5 min,收集上清,进行SDS-PAGE电泳,并按常规方法进行蛋白转膜,用含50 g/L脱脂牛奶和质量分数0.1%吐温的PBS在室温下阻断1 h,在4 ℃下用鼠抗GFP抗体(1∶1 000,Invitrogen)孵育16 h,再用辣根过氧化物酶标记的羊抗鼠抗体(1∶3 000,Takara)孵育2 h,最后曝光显影。
2 结果与分析
2.1 GCRV 096与GCRV GD108 vp7基因同源性分析及GCRV 096 VP7重组蛋白的原核表达
GCRV 096开放阅读框(ORF) 为831 bp,编码276个氨基酸,预测分子质量约为29.85 ku;而GCRV GD108基因编码356个氨基酸,二者基因间相似率为21%,二者VP7蛋白间相似率为12%。
经菌落PCR、双酶切及测序验证,pET-VP7质粒构建成功。将原核重组质粒pET-VP7转化至大肠杆菌BL21 (DE3) 感受态细胞,其最优的表达条件是以28 ℃、0.2 mmol/L IPTG诱导5 h,诱导表达的蛋白以包涵体形式存在(图1)。Western blot分析表明,纯化后蛋白是融合表达的GCRV 096 VP7蛋白(图2)。
2.2 GCRV 096 VP7蛋白的免疫原性分析
腹腔注射原核表达重组蛋白15 d后,腹腔注射GCRV 096或GCRV GD108进行感染。感染72 h时,GCRV 096免疫组比对照组中基因的表达水平低,96 h时组间差异显著(< 0.05),可见,相对于对照组,免疫组中GCRV 096的病毒复制量减少,复制速度减慢,GCRV 096 VP7蛋白表现出良好的免疫原性;而GCRV GD108免疫组和对照组中基因的表达水平无显著差异(> 0.05),GCRV 096 VP7蛋白可能对GCRV GD108无免疫保护作用(图3)。

M,蛋白质分子质量标准;1,未诱导pET28a;2,诱导pET28a;3,未诱导pET-VP7;4-5,诱导pET-VP7

M,蛋白质分子质量标准;1-8,50、70、90、110、150、200、250和300 mmol/L 咪唑洗脱纯化后的融合表达VP7蛋白的western blot

*表示差异有统计学意义(P < 0.05)
2.3 GCRV 096 VP7蛋白在CIK细胞中的表达
经菌落PCR (图4A )、酶切鉴定(图4B) 及测序验证,重组质粒pEGFP-VP7构建成功。pEGFP-N3和pEGFP-VP7质粒转染CIK细胞后24 h,仅转染脂质体的CIK细胞无荧光(图5A),转染空载体pEGFP-N3 (图5B) 和转染pEGFP-VP7质粒的CIK细胞中有绿色荧光(图5C)。在转染pEGFP-VP7质粒的CIK细胞裂解液中,呈现有特异性蛋白条带,而仅转染脂质体和空载体pEGFP-N3的CIK细胞裂解液中无相应的蛋白条带(图6),说明GFP融合重组蛋白VP7在真核CIK细胞中得以表达。
M1,DL2000 DNA分子标准; 1-4,pEGFP-VP7阳性克隆子;M2,1 kb DNA 分子标准;5,pEGFP-VP7双酶切产物
M1, DL-2000 DNA maker; 1-4, Positive clones of pEGFP-VP7; M2: 1 kb DNA marker; 5, double enzymatic digestion product of pEGFP-VP7 plasmid
图4 重组质粒pEGFP-VP7菌落PCR及双酶切
Fig. 4 Identification of the recombinant plasmid pEGFP-VP7 by colony PCR and double enzymatic digestion
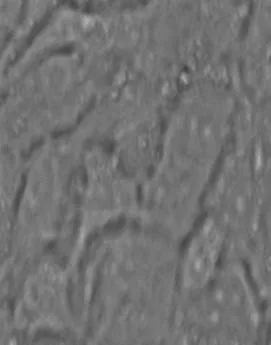
A,正常的CIK细胞(40×);B,pEGFP-N3转染CIK细胞(40×);C,pEGFP-VP7转染CIK细胞(40×)

M,蛋白质分子质量标准;1,仅转染脂质体CIK细胞裂解液;2,转染pEGFP-N3 CIK细胞裂解液;3-4,转染pEGFP-VP7 CIK细胞裂解液
3 讨论
研究表明,不同基因型分离株间在基因序列、基因组电泳带型、致细胞病变效应和疾病发展等方面存在差异,不同基因型分离株间不产生交叉保护作用[5-6,20,23-24]。对多样性GCRV而言,研究免疫原性强的蛋白和多肽等对联合免疫疫苗的研制至关重要[25]。VP7蛋白可引起草鱼产生明显的免疫反应,对草鱼出血病疫苗来说VP7蛋白有良好的免疫原性[26]。基因I型GCRV VP7蛋白合成肽抗体可特异性识别基因I型GCRV,而不识别其他基因型毒株[27]。本研究中,GCRV 096和GCRV GD108的VP7蛋白之间的相似率极低。用Ⅰ型基因型GCRV 096的VP7蛋白免疫草鱼后,对GCRV 096有明显的免疫作用,但对Ⅱ型基因型GCRV GD108无明显影响。说明VP7蛋白有良好的免疫原性,其在GCRV不同基因型间可能不发生交叉保护作用。通过比较GCRV不同基因型各分离株免疫原性的差异,找出不同分离株抗原蛋白或基因之间的差异,可为下一步亚单位疫苗和基因工程疫苗的研制提供依据,从而制备出对所有GCRV基因型分离株免疫效果良好的疫苗[25]。目前对于不同基因型GCRV疫苗交叉保护的报道极少,对草鱼出血病疫苗来说,确定GCRV不同基因型间是否发生交叉免疫极为重要,但有待进一步研究。已有研究应用多重shRNA表达系统产生抵抗GCRV不同基因型的交叉抗病毒制剂[28]。草鱼出血病的有效防控必须考虑GCRV的多样性,对草鱼出血病来说联合疫苗可能是最优选择之一。
综上,本研究纯化了原核表达的GCRV 096 VP7蛋白,研究其免疫原性,并通过不同GCRV基因型免疫效果比较,发现可能在GCRV I、II型间不存在交叉保护。此外,在CIK细胞中成功表达了GCRV 096 VP7蛋白,实现了GCRV 096 VP7蛋白在真核细胞中的表达,表明Lipofectamin 2000脂质体可将重组质粒成功转入目的细胞,实现目的蛋白在宿主细胞中的表达,为进一步动物实验及草鱼出血病DNA疫苗的研发奠定基础。
[1] YE X, TIAN Y Y, DENG G C, et al.Complete genomic sequence of a reovirus isolated from grass carp in China[J]. Virus Research, 2012,163(1): 275-283.
[2] YAN X Y, WANG Y, XIONG L F, et al. Phylogenetic analysis of newly isolated grass carp reovirus[J]. SpringerPlus, 2014, 3(4): 190-199.
[3] WANG Q, ZENG W W, LIU C, et al. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China[J]. Journal of Virology, 2012, 86(22): 12466.
[4] 黄毅昌, 雷燕, 杨玉滔, 等. 草鱼出血病分子流行病学及GCRV多样性研究[J].安徽农业科学, 2016, 44(11): 120-125.
[5] TANG Y F, ZENG W W, WANG Y Y, et al. Comparison of the blood parameters and histopathology between grass carp infected with a virulent and avirulent isolates of genotype II grass carp reovirus[J]. Microb Pathog, 2020. doi:10.1016/j.micpath.2019.103859.
[6] FAN Y D, RAO S J, ZENG L B, et al. Identification and genomic characterization of a novel fish reovirus, Hubei grass carp disease reovirus, isolated in 2009 in China [J]. Journal of General Virology, 2013, 94(Pt 10): 2266-2277.
[7] 李永刚, 曾伟伟, 王庆, 等. 草鱼呼肠孤病毒分子生物学研究进展[J]. 动物医学进展, 2013, 3(4): 97-103.
[8] 张盛权. 注射草鱼出血病疫苗免疫效果的观察报告[J]. 中国水产, 2006(7): 85-86.
[9] JIANG Y L. Hemorrhagic disease of grass carp: Status of outbreaks, diagnosis, surveillance, and research[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2009, 61(3): 188-192.
[10] FANG Q, SENG E K, DING Q Q, et al. Characterization of infectious particles of grass carp reovirus by treatment with proteases[J]. Arch Virology, 2008, 153(2): 675-682.
[11] 徐诗英, 刘林, 李婧慧, 等. 草鱼呼肠孤病毒基因核酸疫苗的构建及免疫效果[J]. 水产学报, 2011, 35(11): 1694-1700.
[12] HE Y, YANG Q, XU H X, et al. Prokaryotic expression and purification of grass carp reovirus capsid protein VP7 and its vaccine potential[J]. African Journal of Microbiology Research, 2011, 5(13): 1643-1648.
[13] LUO S X, YAN L M, ZHANG X H, et al. Yeast surface display of capsid protein VP7 of grass carp reovirus: Fundamental investigation for the development of vaccine against hemorrhagic disease[J]. J Microbiol Biotechnol, 2015, 25(12): 2135-2145.
[14] ZHU B, LIU G L, GONG Y X, et al. Protective immunity of grass carp immunized with DNA vaccine encoding thegene of grass carp reovirus using carbon nanotubes as a carrier molecule[J]. Fish Shellfish Immunol, 2015, 42(2):325-34.
[15] 韦先超, 杨泽晓, 王印, 等.草鱼出血病病毒VP7蛋白基因的人工合成与原核表达[J]. 海洋与湖沼, 2013, 44(3): 645-650.
[16] HAO K, CHEN X H, QI XZ, et al. Display of GCRV vp7 protein on the surface ofand its immunoprotective effects in grass carp ()[J].Fish Shellfish Immunology, 2018,72:199-209.
[17] 郝贵杰, 潘晓艺, 姚嘉赟, 等. 草鱼呼肠孤病毒衣壳蛋白VP7基因真核表达载体pCI-VP7的构建及鉴定[J]. 水产学报, 2010, 34(5): 807-813.
[18] 闫秀英, 郭定利, 郑树城, 等. 草鱼呼肠孤病毒096基因生物信息学分析及其在肾细胞中的表达[J]. 广东海洋大学学报, 2015, 35(4): 56-62.
[19] YAN X Y, XIE J G, LI J, et al. Screening and analysis on the protein interaction of the protein VP7 in grass carp reovirus[J]. Virus Genes, 2015, 50(3):425-33.
[20] YAN X Y, XIONG L F, LI J, et al. GCRV 096 VP6 protein and its impacts on GCRV replication with different genotypes in CIK cells[J]. Aquaculture and Fisheries, 2018, 3(5):184-190.
[21] 郑树城, 谢吉国, 王雅, 等. 草鱼呼肠孤病毒096基因生物信息学分析及其酵母表达载体的构建[J]. 广东海洋大学学报, 2014, 34(6): 31-37.
[22] KULESHOV M V, JONES M R, ROUILLARD A D, et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update[J]. Nucleic Acids Research, 2016, 44(W1): W90-97.
[23] WANG T, LI J L, LV L Q. Quantitative in vivo and in vitro characterization of co-infection by two genetically distant grass carp reoviruses[J]. Journal of General Virology, 2013, 94(Pt 6): 1301-1309.
[24] HE L B, ZHANG A D, PEI Y Y, et al. Differences in responses of grass carp to different types of grass carp reovirus (GCRV) and the mechanism of hemorrhage revealed by transcriptome sequencing[J]. BMC Genomics, 2017, 18(1):452.
[25] 王方华, 李安兴. 草鱼病毒性出血病研究进展[J]. 南方水产, 2006, 2(3): 67-71.
[26] 陈丛琳, 孙小云, 廖兰杰, 等. 利用抗草鱼IgM的单链抗体分析草鱼呼肠孤病毒的免疫原性[J]. 中国科学:生命科学, 2012, 42(12): 986-992.
[27] 刘世旭, 王庆, 常藕琴, 等. 基因Ⅰ型草鱼呼肠孤病毒VP7蛋白合成肽抗体的制备及应用[J]. 南方农业学报, 2018, 49(9): 1849-1857.
[28] MA J, ZENG L B, FAN Y D, et al. Significant inhibition of two different genotypes of grass carp reovirus in vitro using multiole shRNAs expression vectors[J]. Virus Research, 2014, 189: 47-55.
杨硕,陈静妮,胡海浩,等. 草鱼呼肠孤病毒GCRV 096 VP7蛋白的表达及免疫原性[J]. 广东海洋大学学报,2020,40(4):1-7.
Expression and Immunogenicity of VP7 Protein in Grass Carp Reovirus (GCRV) 096 Strain
YANG Shuo, CHEN Jing-ni, HU Hai-hao, WANG Ya, YAN Xiu-ying, JIAN Ji-chang
(,,,,524088,)
【Objective】To study the prokaryotic and eukaryotic expression of thegene of grass carp reovirus (GCRV) 096 strain, and the coded protein’s immunogenicity. 【Method】The Open Reading Frame (ORF) of GCRV 096gene was acquired by RT-PCR. The prokaryotic expression vector pET-VP7 of GCRV 096gene was structured. Grass carp () was challenged with GCRV 096 or GCRV GD108 after 15 days immunization with the expressed fusion GCRV 096 VP7 protein, and the immunogenicity of GCRV 096 VP7 protein was analyzed. Furthermore, the eukaryotic expression vector pEGFP-N3-VP7 of GCRV 096gene was structured, and the expression of GCRV 096gene in CIK cells was analyzed.【Result and Conclusion】The ORF of GCRV 096gene (GenBank accession number: JN206665) was 831 bp encoding for a protein with 276 amino acid residues. The prokaryotic expression vector pET-VP7 of the GCRV 096gene was constructed successfully, and the GCRV 096 VP7 protein was expressed successfully transformed intoBL21. The optimal expression condition was 0.2 mmol/L IPTG at 28 ℃ for 5 hours. Then the expressed fusion GCRV 096 VP7 protein was purified with the HisTrap HP purification column. Western blot result showed that the recombinant VP7 was of expected size. After the grass carp was immunized and challenged, the expression level of GCRV 096gene decreased (< 0.05) in the immunized group (GCRV 096, genotype I) compared to the control group; but the expression level of GCRV GD108gene had no significant difference between the immunization group (GCRV GD108, genotype Ⅱ) and the control group. The results indicated that the recombinant protein had good immunogenicity for GCRV 096 but with no obvious immune effect for GCRV GD108. Moreover, eukaryotic expression vector pEGFP-N3-VP7 of GCRV 096gene was structured successfully. The results of western blot showed that GCRV 096 VP7 protein was expressed successfully in CIK cells.
Grass carp reovirus;gene; expression; immunogenicity
Q78;Q959.46+8
A
1673-9159(2020)04-0001-07
10.3969/j.issn.1673-9159.2020.04.001
2020-01-20
国家自然科学基金(31602199);广东省自然科学基金(2015A030313622);湛江市科技计划项目(2015A03027);广东海洋大学校级项目(K15246)和973项目(2009CB118704)
杨硕(1994-),女,硕士生,主要从事水生动物病害防控。Email: 1079761052@qq.com
闫秀英(1978-),女,副教授,主要从事水生动物病害防控。Email: yanxiuying1201@126.com
(责任编辑:刘庆颖)
