山丹干无硫护色工艺研究
2020-07-01刘广平李定宴蔡小妮王延峰贺晓龙
刘广平,李定宴,王 凯,2,蔡小妮,王延峰,2,贺晓龙
(1.延安大学 生命科学学院;2.陕西省红枣重点实验室;3.延安正大宏园林绿化有限公司,陕西 延安 716000)
山丹(Liliumpumilum.DC.),又名细叶百合,俗称山丹丹,为百合科(Liliaceae)百合属(Lilium)卷瓣组(Lilium Sect.Sinomartagon)多年生草本植物[1],主要分布在甘肃、宁夏、青海、陕西、山西等北方地区。
山丹中蛋白含量为9.702 mg/g,还原性糖含量0.13%,淀粉含量为30.55%,脂肪含量为0.28%,粗纤维含量为3.72%,Vc含量为110.35 mg/g[2]。《本草纲目》记载,山丹“味苦性平,具补阴润肺、清心安神之效”,山丹也是目前《中华人民共和国药典》收录的3种药用百合之一,其干燥肉质鳞叶入药,主治阴虚久咳、痰中带血、虚烦惊悸等。此外,山丹也可糖渍制作蜜饯,或烹制菜点,甚至用于代粮,是很好的药食同源植物[3]。山丹等百合类食物多食用其新鲜鳞茎或鳞茎干片,也可将鳞茎加工成百合粉后食用。加工过程中,百合颜色褐变并产生一些不良物质,严重影响了其风味品质和市场销售[4]。报道的百合护色方法有硫熏法和添加亚硫酸盐护色法,这些方法护色效果虽好,但却能降低成品中总磷脂、总多糖和总皂苷的含量,且造成硫化物残留,危害消费者的身体健康,此外,加工过程中,亚硫酸盐会释放SO2,易损害工人健康并引起环境污染[5]。
本研究以延安山丹鳞茎为原料制备山丹干,选取氯化钠、柠檬酸、抗坏血酸和EDTA-2Na作为护色因子,通过单因素研究和多因素研究探讨山丹干护色的最佳参数,优化最佳的无硫护色方法,为山丹食用开发提供理论依据。
1 实验部分
1.1 材料与试剂
延安山丹鳞茎由本实验室提供(选择体积较大、新鲜、颜色亮白,鳞茎片丰厚、无病虫害)。柠檬酸、抗坏血酸、氯化钠和EDTA-2Na均购自上海沪试,为国产分析纯级。
1.2 仪器与设备
电子天平(AUY200,日本岛津),微波炉(EG823MF7-NRH,美的),电热恒温干燥箱(DHG-9140A,上海昕仪),色差仪(NR110,杭州彩谱)。
1.3 实验方法
1.3.1 工艺流程
鳞茎剥片→清洗→烫漂→护色液浸泡→干燥→色泽测定。
1.3.2 护色处理
新鲜的山丹鳞茎剥片清洗,沸水烫漂5 min,护色液浸泡10 min,清水漂洗,沥干,60℃干燥至鲜重的10%。
1.3.3 色泽测定
色泽值(L值)表明色泽深浅程度,L值越大,颜色越白,褐变程度越低,反之,表明颜色灰暗,褐变程度高。用色差仪检测山丹干的L值,记录数值,用于实验统计和比较研究。
1.3.4 单因素影响研究
分别利用浓度为0.20%、0.40%、0.60%、0.80%、1.00%的氯化钠溶液,0.10%、0.20%、0.30%、0.40%、0.50%的柠檬酸溶液,0.10%、0.20%、0.30%、0.40%、0.50%的抗坏血酸溶液,0.35%、0.45%、0.55%、0.65%、0.75%的EDTA-2Na溶液处理烫漂后的山丹干,检测各护色因子的护色效果。
1.3.5 多因素影响研究
以单因素影响结果为基础,山丹干的L值为响应值,根据Box-Behnken试验原理[6,7],进行四因素三水平响应面分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 氯化钠对山丹干L值的影响
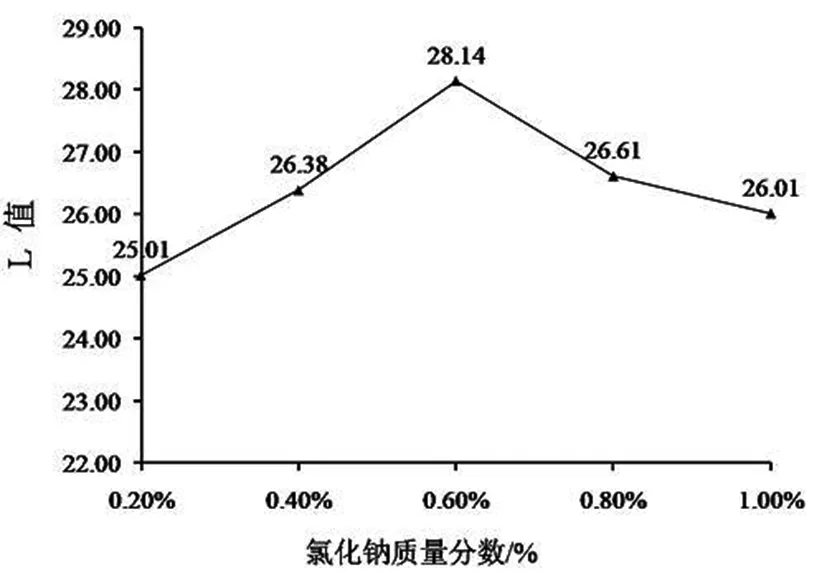
图1 氯化钠对山丹L值的影响
山丹干L值随着氯化钠浓度升高而逐渐增加,氯化钠浓度为0.6%,L值最大,但氯化钠浓度超过该值后,L值反而降低(图1)。氯化钠溶液浓度逐步升高,其中的溶解氧含量下降,降低了多酚氧化酶接触氧的机会[8],而且钠离子可抑制多酚氧化酶的活性,同时溶液较高的渗透压,又促进了多酚氧化酶失活,几种作用共同抑制了酶促褐变过程[9]。
2.1.2 柠檬酸对山丹干L值的影响
柠檬酸浓度低于0.30%时,山丹干的L值随浓度升高而逐渐增加,在0.30%时达到顶峰。当溶液浓度高于0.30%时,L值却逐渐降低(图2)。柠檬酸可降低溶液中的溶解氧,其分子中的羰基又能螯合铜离子,二者共同作用抑制了多酚氧化酶引起的褐变效应。但柠檬酸溶液浓度升高又能造成溶液pH值降低,影响羰基螯合铜离子,护色效果反而下降[10,11]。
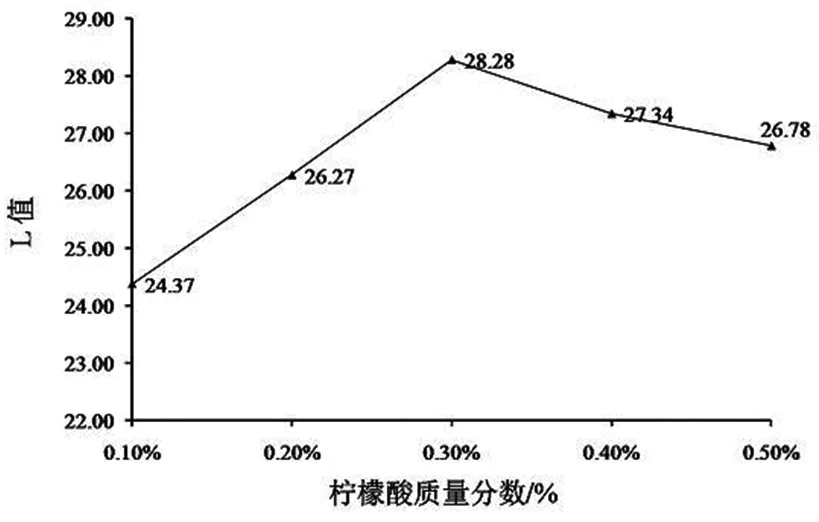
图2 柠檬酸对山丹L值的影响
2.1.3 抗坏血酸对山丹干L值的影响
抗坏血酸的护色效果见图3,随着抗坏血酸溶液浓度增加,山丹干的L值也随之增大,当抗坏血酸浓度为0.30%时,L值最大,随抗坏血酸浓度继续升高,L值却逐渐降低。抗坏血酸可通过还原多酚氧化酶的产物而影响其催化效果[12]。抗坏血酸还可保护食品中的营养成分、色素和一些风味物质,避免其发生氧化作用,起到护色作用[13]。
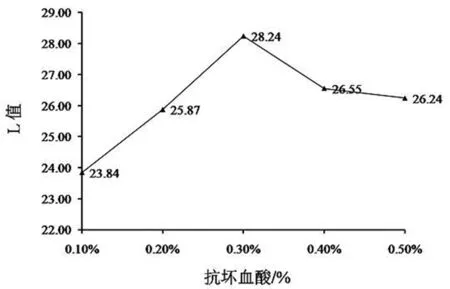
图3 抗坏血酸对山丹L值的影响
2.1.4 EDTA-2Na对山丹干L值的影响
EDTA-2Na的护色效果见图4,山丹干的L值随着EDTA-2Na溶液浓度升高而呈现先上升后下降的趋势,EDTA-2Na的浓度为0.55%时,L值最大,表明此时的护色效果最好。EDTA-2Na能减缓食品色素的衰减速率,保持山丹干的颜色稳定[14]。
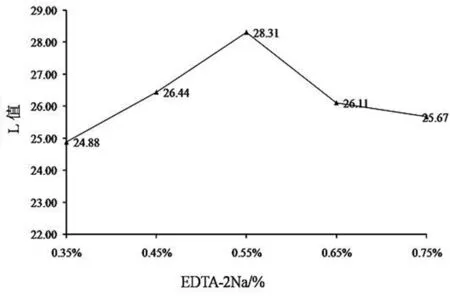
图4 EDTA-2Na对山丹L值的影响
2.2 多因素试验结果与分析
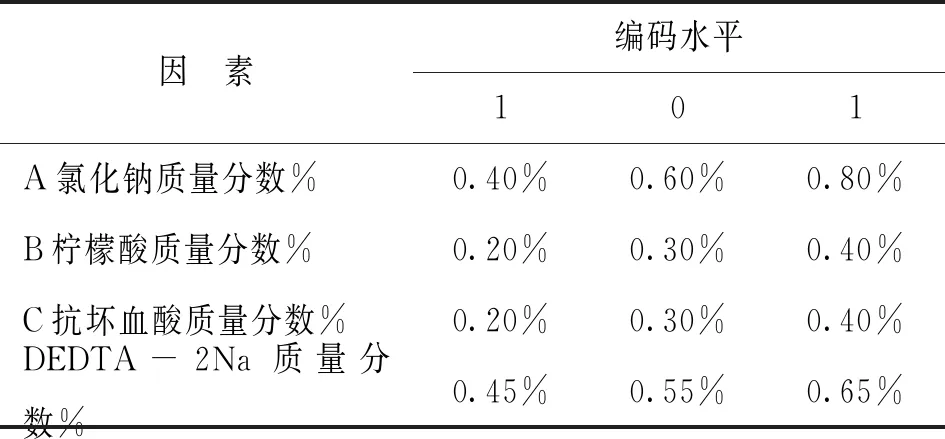
表1 响应面因素水平表
在单因素试验结果的基础上,以山丹干L值为响应值,利用Design-Expert软件中Box-Behnken Design(BBD)试验方法,设计四因素三水平共29个点的响应面试验[15]。试验因素水平选取见表1,试验方案及结果见表2,试验得到的方程模型及相关分析见表3。表3显示山丹干L值所建立的二次多项模型为:L值=28.56+0.044A+0.49B+0.47C-0.15D+0.095AB-0.050AC+0.50AD-0.26BC+0.80BD+0.62CD-0.63A2-0.20B2-0.098C2-0.72D2,校正系数=0.7089,复相关系数=0.8545,回归方程充分拟合。各因子对山丹干L值的影响为:D>C>B>A,其中D、C及二次元项A2、D2的影响极显著,而交互项BD的影响极显著,交互项AD和CD的影响显著,表明各因素对L值的综合影响不是线性关系。
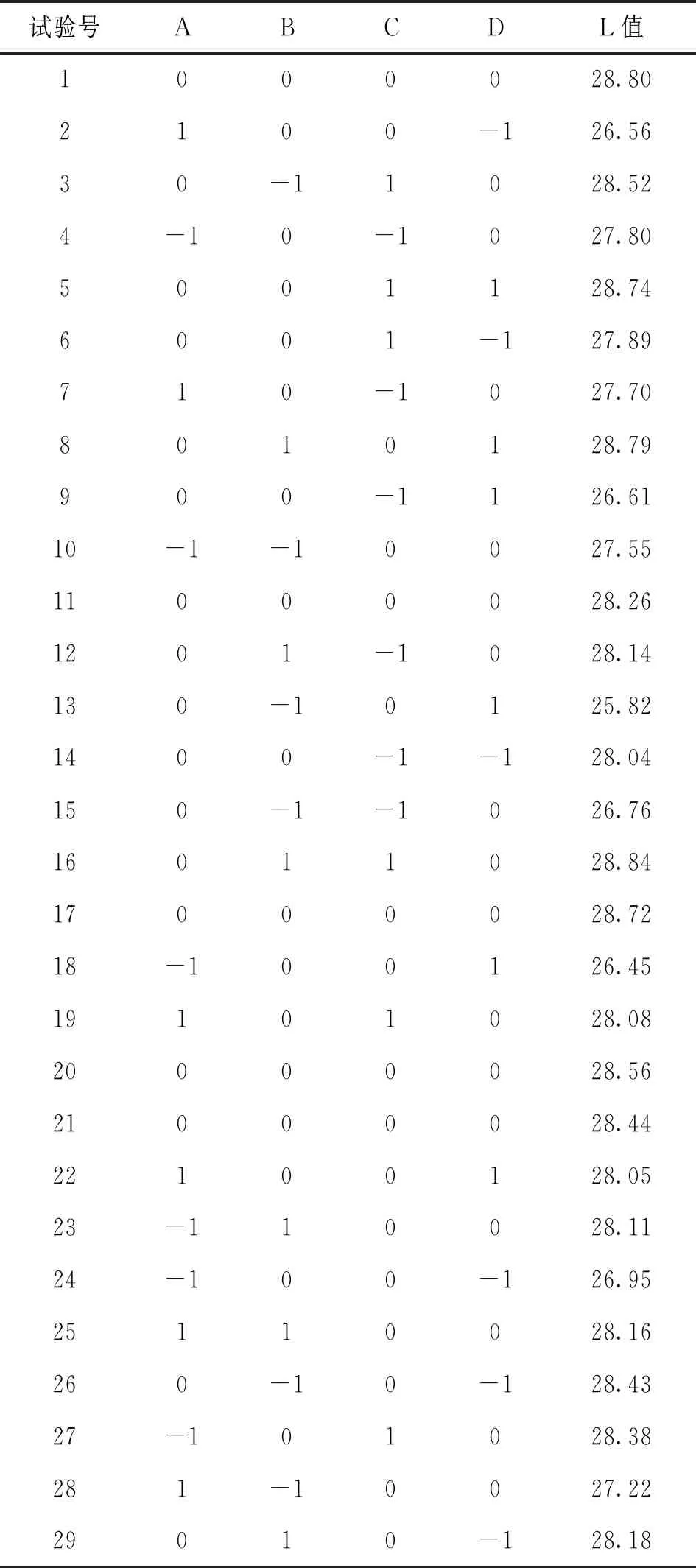
表2 响应面分析试验设计方案及结果
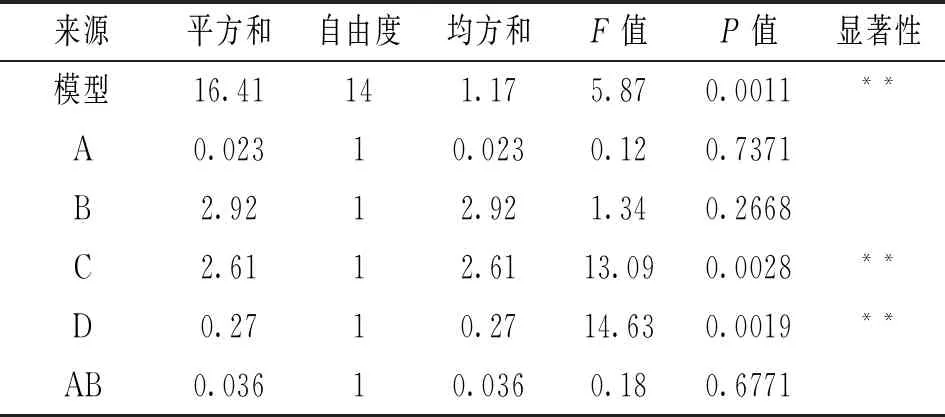
表3 方程模型方差分析及其系数的显著性检验
(续表3)
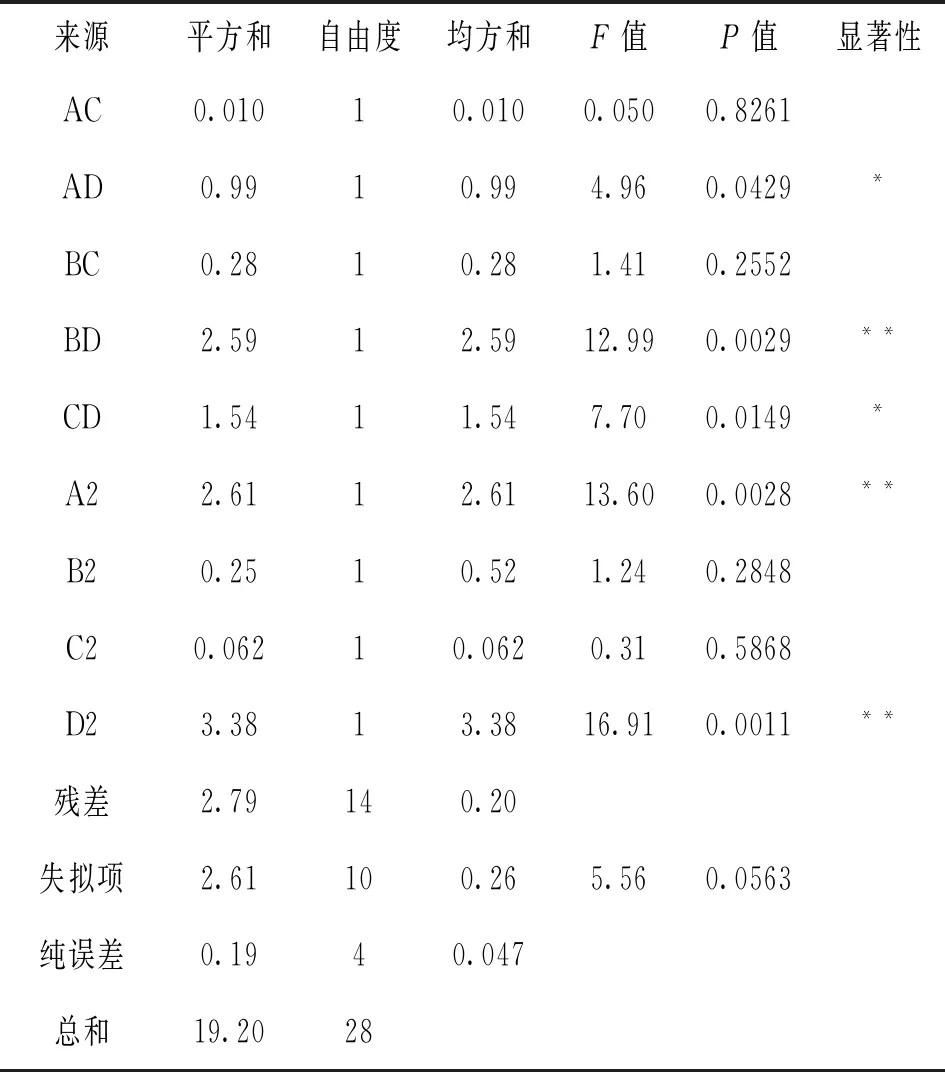
来源平方和自由度均方和F值P值显著性AC0.01010.0100.0500.8261AD0.9910.994.960.0429*BC0.2810.281.410.2552BD2.5912.5912.990.0029**CD1.5411.547.700.0149*A22.6112.6113.600.0028**B20.2510.521.240.2848C20.06210.0620.310.5868D23.3813.3816.910.0011**残差2.79140.20失拟项2.61100.265.560.0563纯误差0.1940.047总和19.2028
注:*.差异显著,P<0.1;**.差异极显著,P<0.01。
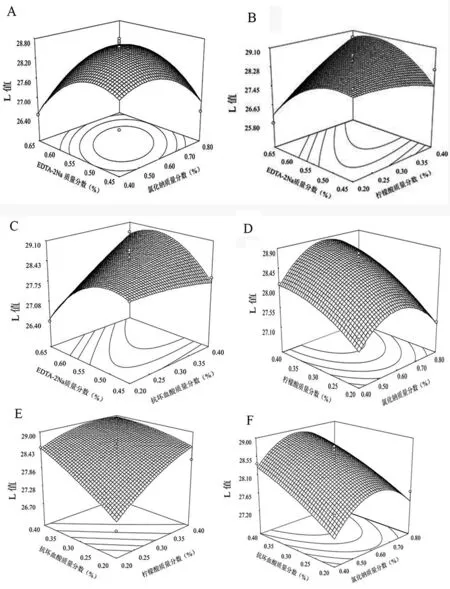
A:EDTA-2Na和氯化钠对山丹干L值的影响;B:EDTA-2Na和柠檬酸对山丹干L值的影响;C:EDTA-2Na和抗坏血酸对山丹干L值的影响;D:柠檬酸和氯化钠对山丹干L值的影响;E:抗坏血酸和柠檬酸对山丹干L值的影响;F:抗坏血酸和氯化钠对山丹干L值的影响。
图5不同组合护色液对山丹干L值的影响
响应面图形是一种空间曲面图,体现了各影响因子对响应值的交互作用。依据Box-Behnken试验回归模型作图,检验交互项对响应值的影响,可分析评价各影响因子对山丹L值的两两交互作用[16,17]。氯化钠、柠檬酸、抗坏血酸和EDTA-2Na等因子之间交互作用对响应值的影响如图5所示,响应面坡度越陡峭,表示响应值对试验条件的改变越敏感,该因子对山丹色L值的影响越大;反之则该因子对其影响越小[18]。在交互项对山丹干L值的影响中,EDTA-2Na和柠檬酸之间的交互作用极显著(图5-B),EDTA-2Na和氯化钠之间的交互作用及EDTA-2Na和抗坏血酸之间的交互作用显著(图5-A,C),而其它因素之间的交互作用无明显影响(图5-D,E,F),这和方差分析的结果相吻合[19]。
依据Design Expert软件得出数学模型的二次回归方程,结合回归方程计算的最佳护色剂配方(质量分数)为氯化钠0.69%、柠檬酸0.40%、抗坏血酸0.40%、EDTA-2Na 0.65%,此时山丹干的预测L值为29.65。重复响应面二次回归所得条件3次,得到山丹干实测L值平均为29.15,与预测值无显著差异,证明该模型正确,使用响应面分析助于山丹干无硫护色剂配方的优化筛选。
3 结论
本研究首先对氯化钠、柠檬酸、抗坏血酸和EDTA-2Na 4种护色因子进行了单因素护色效果探讨,依次确定了这些因子发挥作用的最佳范围。在此基础上又进一步展开四因素三水平Box-Behnken响应面分析研究,构建山丹干L值对这4种护色因子的数学模型,最终结果表明该模型回归拟合效果较好。据此模型优化筛选的最佳护色因子配方(质量分数)为氯化钠0.69%、柠檬酸0.40%、抗坏血酸0.40%、EDTA-2Na 0.65%,此时山丹干L值的实测值为29.15。该配方对指导无硫脱水生产山丹干具有一定的理论价值。
