痘苗病毒致炎兔皮提取物促进小胶质细胞M1向M2极化、抑制炎性因子分泌的体外研究
2020-07-01龚诗立杨翠翠胡朝英王明洋张兰
龚诗立,杨翠翠,胡朝英,王明洋,张兰
1.遵义医科大学基础药理教育部重点实验室,特色民族药教育部国际合作联合实验室,贵州遵义市 563000;2.首都医科大学宣武医院药学部,北京市100053
缺血性脑卒中是指由于脑的供血动脉(颈动脉和椎动脉)狭窄或闭塞、脑供血不足导致的脑组织坏死的总称,可导致突发的单侧肢体麻木、力弱、眩晕等。静脉溶栓疗法是目前唯一临床证实有效的治疗方法,但该方法具有时间窗局限性,且存在引起严重脑出血的风险。缺血后的炎症反应加快缺血性损伤的形成,并影响神经元死亡和神经组织再生。神经炎症的特征是小胶质细胞激活和促炎细胞因子增加。针对炎症反应的干预被认为是缺血性脑卒中的有效治疗手段。
小胶质细胞是巨噬细胞的一种,约占成年脑细胞的5%~10%,是大脑中最大的免疫细胞群[1]。在外来微生物刺激或缺血缺氧后,小胶质细胞激活后表现为经典的M1表型。M1型小胶质细胞不仅可产生促炎细胞因子,而且具有抗原加工和呈递的作用,也是细胞毒性和炎症反应的促进剂[2-4]。除了经典的促炎M1 表型,小胶质细胞亦可以呈现抗炎的M2 表型,该表型同时还具有促血管生成和免疫抑制、诱导效应T 细胞失效和细胞毒性等诸多生理效应。与M1 型小胶质细胞相反,M2型小胶质细胞表达抑炎症因子[5-6]。
痘苗病毒致炎兔皮提取物(analgecine,AGC)是从牛痘病毒致炎的日本大耳白兔的兔皮组织中提取的一种生物活性制剂,含有多种多肽、氨基酸、核苷酸等物质[7];临床用于颈肩腕综合征的治疗、腰痛患者疼痛等症状的缓解以及症状性神经痛[8-10]。前期研究结果显示,在大鼠中脑动脉栓塞模型中,静脉给予AGC后,可以抑制炎症因子的分泌,显著缩小梗死面积,减轻脑水肿系数,提高大鼠行为学评分。但其作用机制不明确。本研究观察AGC 调控小胶质细胞极化,从而抑制炎症反应。
1 材料与方法
1.1 材料
BV2 小胶质细胞:中国医学科学院基础医学研究所基础医学细胞中心。DMEM 高糖培养基、胎牛血清:GIBCO公司。青链霉素混合液:THERMO FISHER 公司。连二亚硫酸钠(Na2S2O2)、脂多糖(lipopolysaccharide,LPS):SIGMA 公 司。CD16+CD32抗 体、CD206抗体:ABCAM 公司。4%细胞固定液、PBS:HYCLONE 公司。PBST:自制。Alexa Fluor 488 山羊抗大鼠IgG (H+L)、Alexa Fluor 594 山羊抗兔IgG (H+L):INVITROGEN 公司。山羊血清、含DAPI的封片剂:北京中杉金桥公司。干扰素-γ(interferon,IFN-γ)、白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α ELISA 试剂盒:R&D systems。IL-4:PEPROTECH 公司。FITC CD16/32 抗体、PE CD206抗体:BIOLEGEND 公司。流式管:CORNING公司。
1.2 方法
1.2.1细胞培养
BV2 细胞于10%胎牛血清和1%青链霉素混合液配制的DMEM-HIGH Glucose 培养基中,37 ℃饱和湿度培养箱培养。待细胞生长至90%细胞汇合时,加0.25%胰酶消化液消化传代。
在氧糖剥夺再恢复(oxygen-glucose deprivation/reoxygenation,OGD/R)模型中,将BV2 细胞悬液以6×104/ml 接种于6 孔培养板中,以3×104/ml 接种于放有已灭菌细胞爬片的24 孔板中。生长至80%细胞汇合时,更换为含10 mmol/L Na2S2O2的DMEM 无糖培养基培养。细胞分为6 组。对照1 组:单用无血清DMEM 高糖培养基培养。AGC1组:用无血清DMEM高糖培养基培养1.5 h 后,换为含0.5 U/ml AGC 的DMEM 高糖培养基。OGD/R 组:用含10 mmol/L Na2S2O2的DMEM 无糖培养基置于37 ℃、5%CO2培养箱中培养1.5 h 后复氧复糖培养3 h。L1 组、M1 组、H1 组:在氧糖剥夺1.5 h 后分别换为含0.25 U/ml、0.5 U/ml、1 U/ml AGC 的DMEM 高糖培养基培养3 h。复氧3 h后,6孔板小心吸出上清备用。
采用IL-4 刺激将小胶质细胞诱导成M2 型,再加入LPS+IFN-γ将其从M2型向M1型转化的模型中,将BV2 细胞悬液以6×104/ml 接种于6 孔培养板中。细胞分为7 组。对照2 组:生长至80%细胞汇合时,单用DMEM 高糖培养基培养。AGC2 组:用含0.5 U/ml AGC 的DMEM 高糖培养基培养24 h。IL-4 组:用含20 ng/ml IL-4的DMEM 高糖培养基培养24 h后,换为完全培养基培养48 h。IFN-γ 组用含20 ng/ml IL-4 的DMEM 高糖培养基培养24 h 后,换为含100 ng/ml LPS 和20 ng/ml IFN-γ 的DMEM 高糖培养基培养18 h后,换为DMEM 高糖培养基培养24 h。L2 组、M2组、H2 组:用含20 ng/ml IL-4 的DMEM 高糖培养基培养24 h 后,换为含100 ng/ml LPS 和20 ng/ml IFN-γ的DMEM 高糖培养基培养18 h 后,分别换为含0.25 U/ml、0.5 U/ml、1 U/ml AGC的DMEM 高糖培养基培养24 h。
1.2.2ELISA检测
将OGD/R 后的培养上清液吸出,4 ℃3000 r/min离心5 min,取上清液。取出酶标包被板,每孔加入RD1-14 或RD1-63 50 μl,然后加入标准品或样品50 μl,密封后拍打混匀,室温孵育2 h。吸弃液体后,加入洗液反复洗涤4 次,拍干。每孔加入IL-6 或TNF-α酶连物100 μl,密封,室温孵育2 h。吸弃液体后,加入洗液反复洗涤4 次,拍干。每孔加入底物溶液100 μl,室温避光孵育30 min,加入终止试剂100 μl,用酶标仪测量吸光度值,计算细胞培养上清液中TNFα、IL-6的含量。
1.2.3免疫荧光染色
取出24孔板,加4%细胞固定液室温固定20 min,PBS 洗涤,PBST 室温透膜20 min,PBS 洗涤,37 ℃、5%山羊血清封闭30 min,加入CD16+CD32、CD206抗体(1∶200) 4 ℃孵育过夜,PBS 洗涤,加山羊抗兔、山羊抗大鼠荧光二抗(1∶500)37 ℃孵育1 h,PBS 洗涤,封片剂封片,拍照。
1.2.4流式细胞术检测
IL-4、LPS 和IFN-γ 处理后,收集细胞,3000 r/min 离心5 min,PBS 离心洗涤,计数,流式检测的各组细胞浓度调整为1×106/ml。采用细胞表面直接免疫荧光染色方法,在细胞悬液中加入CD16+CD32、CD206抗体,室温避光孵育20 min,PBS 洗涤2 次,用PBS 重悬细胞,吹打混匀,将悬液转移至流式管中,用BD FACS Calibur流式细胞仪检测CD16+CD32、CD206的表达。采用Flowjo 10.0计算各指标阳性细胞率。
1.3 统计学分析
采用GraphPad Prism 5.0 软件进行数据分析。组间比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 AGC对OGD/R细胞模型炎症因子分泌的影响
OGD/R 组IL-6、TNF-α 的含量均明显高于对照组(P<0.01);L1 组、M1 组、H1 组IL-6、TNF-α 含量均明显低于OGD/R组(P<0.01)。见表1。
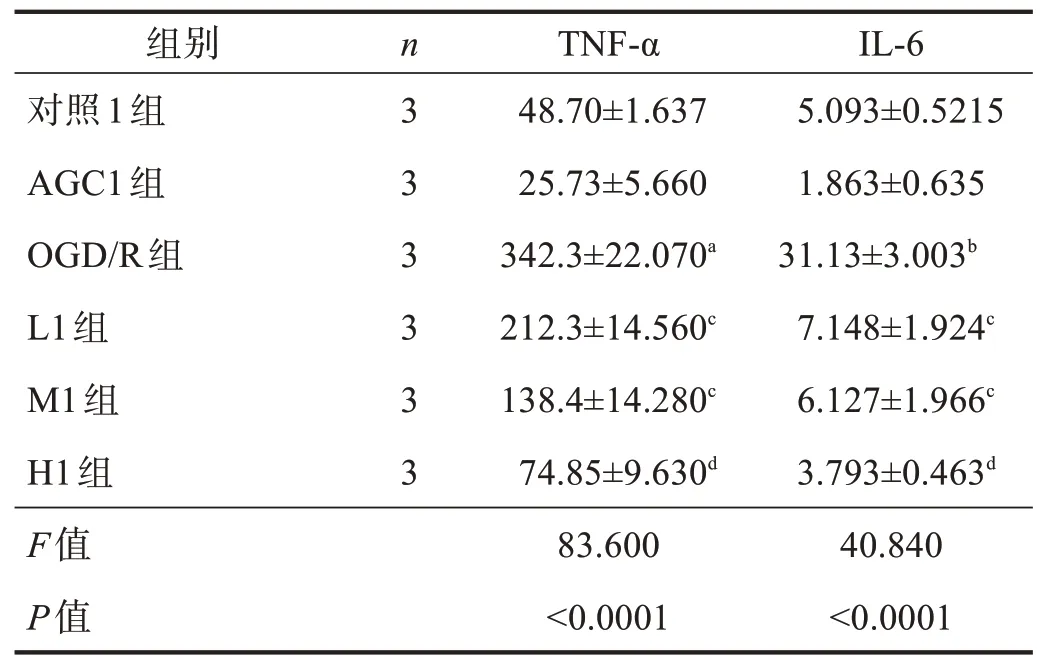
表1 各组细胞上清液中TNF-α和IL-6的含量比较(pg/ml)
2.2 AGC 对OGD/R 后M1 和M2 型小胶质细胞数量的影响
与对照1 组相比,OGD/R 组CD16++CD32+细胞数增多,CD206+细胞数减少;与OGD/R 组相比,L1 组、M1 组、H1 组CD16++CD32+细胞数减少,CD206+细胞数增多。见图1。
2.3 AGC对BV2细胞活化后M1和M2型小胶质细胞数量的影响
与对照2 组比较,IL-4 组CD206有增多趋势,CD16+CD32有降低趋势;与IL-4 组比较,IFN-γ 组CD206有降低趋势,CD16+CD32有增多趋势;与IFN-γ组比较,L2 组、M2 组、H2 组CD16+CD32表达有降低趋势,L2 组、M2 组CD206有增多趋势,H2 组CD206表达增多(P<0.05)。结果见图2、3、表2。
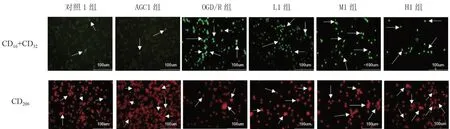
图1 AGC对OGD/R后CD16+CD32、CD206的影响(免疫荧光染色,正置荧光显微镜,×200)
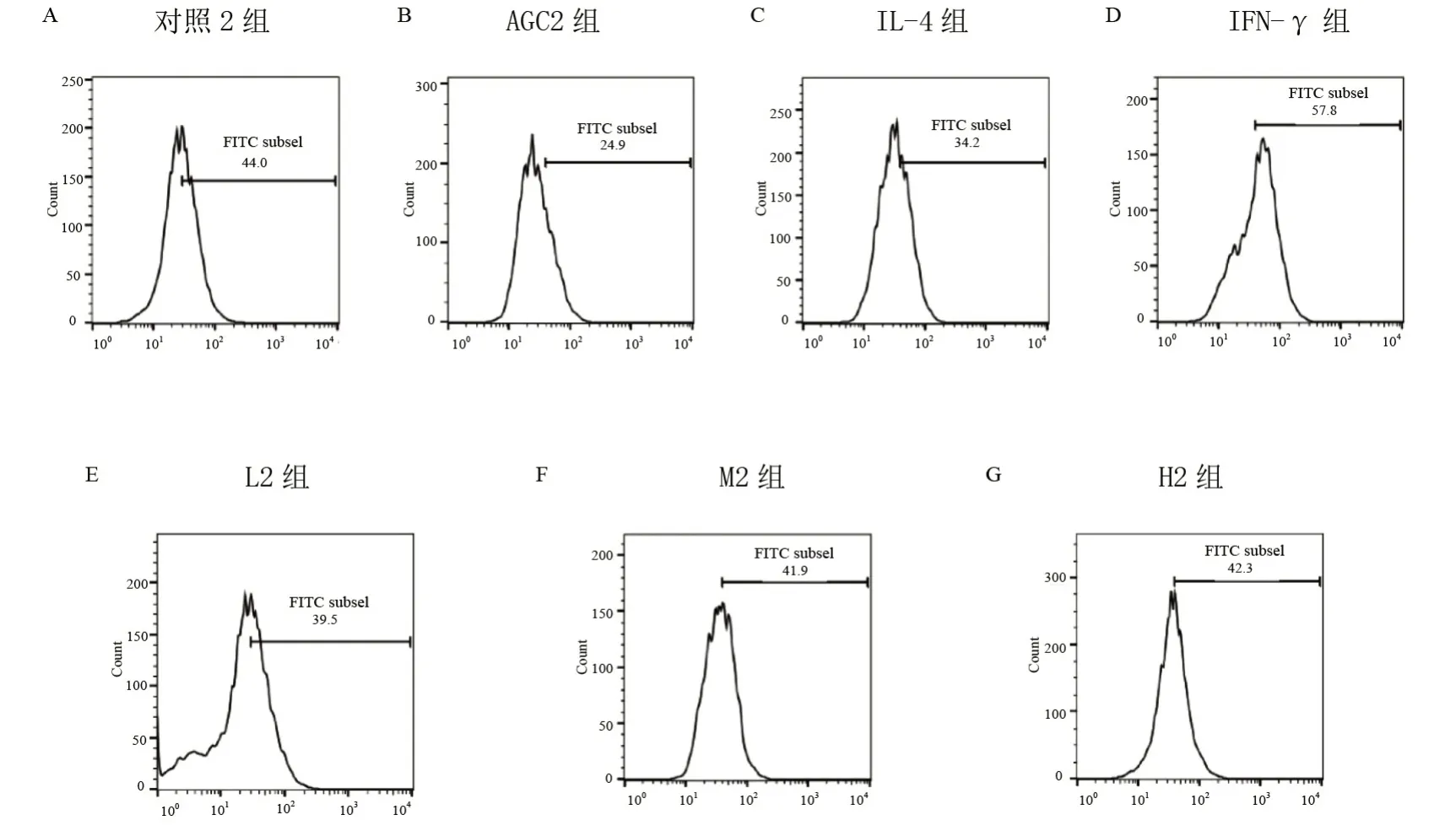
图2 AGC对IL-4刺激BV2细胞CD16+CD32表达的影响
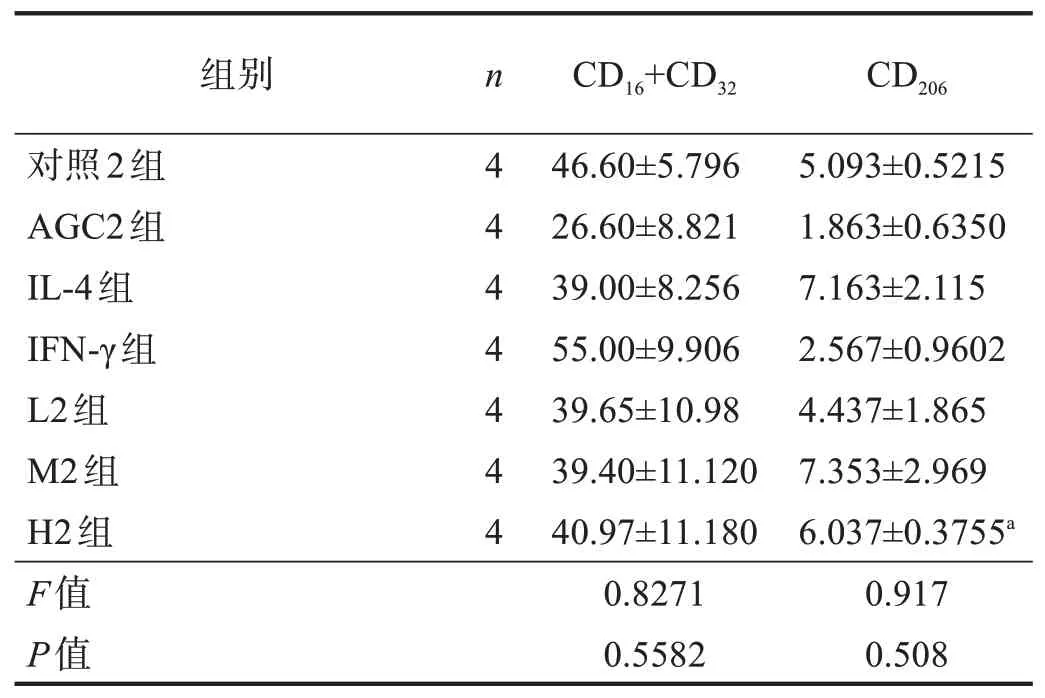
表2 AGC对IL-4刺激BV2细胞CD16+CD32、CD206表达的影响(%)
3 讨论
缺血性脑卒中发生后,小胶质细胞被激活,趋化免疫细胞迁移,细胞因子级联瀑布效应导致持续的炎症反应[11-12]。小胶质细胞是巨噬细胞的一种,广泛存在大脑中。OGD/R模型简便、易行,是公认的体外脑缺血模型[13-14]。细胞因子的过表达是炎症损伤病理的经典特征,TNF-α 能激活中性粒细胞和淋巴细胞,调节其他组织代谢活性,并促使其他细胞因子的合成和释放。它能预测复发性缺血性脑卒中,可能与其参与动脉粥样硬化形成和动脉粥样硬化血栓形成有关[15-16]。IL-6 能诱导B 细胞分化和产生抗体,并诱导T 细胞活化增殖、分化,参与机体的免疫应答,是炎性反应的促发剂[17-22]。本研究显示,AGC 能够有效减少IL-6、TNF-α的分泌,抑制炎症反应。
在缺血性脑卒中病理过程中,小胶质细胞M1 表型和M2表型影响疾病的过程和发展:促炎的M1表型虽然能分泌炎症因子,对抗感染,但过度活化会加重炎症反应[23-25];抗炎的M2表型虽然分泌一系列保护因子,但其一般在最初3 d内大量表达,之后M1型占据主导地位[5-6,26]。调控小胶质细胞的表型极化能够抑制炎性因子的过量分泌。CD16+CD32是M1型小胶质细胞表型标记物,而CD206是M2 型小胶质细胞表型标记物。在氧糖剥夺模型中,AGC 能诱导OGD/R 后小胶质细胞向M2型极化。
本研究采用IL-4 将小胶质细胞诱导为M2 型,然后加入LPS+IFN-γ 将其诱导为M1 型,AGC 干预能够在一定程度上抑制M2 向M1 极化,但是无统计学意义。以上结果表明,AGC主要通过诱导小胶质细胞向M2型转化来减少炎症反应,抑制小胶质细胞向M1极化作用较弱。
本实验从细胞分子水平上初步阐明AGC 抑制细胞缺糖缺氧损伤后炎症反应的机制,即AGC 能够通过促进小胶质细胞向M2 转化,减少炎症因子分泌,抑制炎症反应发生。

图3 AGC对IL-4刺激BV2细胞CD206表达的影响
