MTA1表达与食管癌侵袭转移的相关性及调控作用的研究
2020-07-01王学培翟杨生韩雪华
王学培 翟杨生 韩雪华
作为临床最常见的恶性消化道肿瘤之一,食管癌(esophageal cancer,EC)具有发生发展迅速、侵袭范围广、转移速度快、病死率高的特点[1]。依据现今的外科医疗条件,早期EC可通过根治性手术切除得到理想的治疗效果[2],而晚期EC一般采用手术与化疗相辅助的治疗方案,但是EC患者的术后再次复发以及癌细胞的不可控性转移是导致EC患者死亡的最重要的因素之一[3]。随着分子病理学在临床应用技术上的突破,肿瘤细胞侵袭、转移相关的分子研究逐渐应用在EC的诊断、治疗中[4]。恶性肿瘤的基本特征就是侵袭和转移,肿瘤相关蛋白1(metastasis-associated gene 1,MTA1)作为肿瘤转移相关基因,其在多种肿瘤中过表达,且与肿瘤侵袭和肿瘤血管形成有关[5]。有文献报道称实体肿瘤发生的主要因素就是缺氧,局部缺氧会诱导激活缺氧诱导因子(hypoxia inducible factor-1α,HIF-1α)等,进而开启血管生成开关,血管内皮生长因子(vascular endothelial growth factor,VEGF)通路被激活,进而刺激血管和淋巴管生成[6]。有报道MTA1在大肠癌中表达与HIF-1α呈正相关,且能通过调节VEGF促进淋巴管生成[7]。而在EC中其促进转移的机制笔者尚未见报道。本研究探讨MAT1在EC中的表达,并探讨肿瘤发生发展过程中的作用机制,旨在为临床诊治EC提供新的靶点。
1 资料与方法
1.1 一般资料 收集2016年3月至2018年5月于我院接受手术治疗的62例EC患者癌组织及距离癌组织>2 cm处的正常组织,所有病例标本经组织病理学检测证实为原发性EC,其中腺癌32例,鳞癌30例;年龄35~76岁,中位年龄55岁。所有患者同意本研究并签署知情同意书,且经医院伦理委员会审核。
1.2 细胞及主要试剂和仪器 人正常食管上皮细胞HET-1A,人食管癌细胞株Eca-109、SHEEC1、Ec-9706、EC8712、TE-1均购自上海博古生物技术有限公司。慢病毒过表达载体RSK4-MTA1及阴性对照RSK4-NC由上海吉玛生物技术有限公司提供;DMEM培养基(TOYOBO);Trizol 试剂盒(TaKaRa);Ⅰ、Ⅲ型胶原兔多克隆抗体(美国Abcamn公司),MTA1抗体、HIF-α抗体、VEGF抗体、鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)、辣根过氧化物酶标记的IgG二抗(美国Jackson公司),Transwell小室(美国BD公司);CCK-8试剂盒、反转录试剂盒、Western blot试剂盒(美国migma公司)全蛋白抽提试剂盒(德国QIAGEN公司),Lipofectamine-3000转染试剂(美国vector公司);PBS缓冲液(美Amresco公司)苏净Airtech超净工作台(北京六一仪器厂),SANYO MCO-15AC细胞培养箱(美国强生公司);Nikon Ti-U/Ti-s倒置荧光显微镜(日本三菱公司);5810R 型高速离心机(日本岛津公司);Roche R480实时荧光定量PCR仪(美国Promega公司),Multiskan MK3酶标仪(美国Corning公司)。
1.3 细胞培养以及转染 将Eca-109细胞接种于含有灭活的10%胎牛血清的DMEM培养基中,置于生化培养箱中培养,条件37℃,5%CO2,融合度达85%时,胰蛋白酶消化传代。取对数生长期细胞进行转染,采用Lipofectamine 3000通过脂质体介导法,将浓度均为100 nmol/L的RSK4-MTA1和RSK4-NC慢病毒载体转染至细胞,转染操作完成后,37℃,5%CO2常规培养细胞48 h后进行后续实验。细胞分为RSK4-MTA1组、RSK4-NC组以及空白对照组(仅有Eca-109细胞,只加入Lipofectamine 3000试剂)。
1.4 组织及细胞RNA提取及qRT-PCR检测MTA1的mRNA的表达 组织液和各细胞中总RNA依据Trizol法提取,并进行反转录,按照PrimeScrip反转录试剂盒进行反转录成cDNA,所有操作严格按照试剂盒要求执行。采用SYBR Premix Ex Taq说明书配置PCR反应体系,反应条件为:①预变性:75℃,120 s;②变性:90℃,5 min;③退火:60℃,60 s;④延伸72℃,30 s;⑤ PCR仪采集荧光信号40个循环,U6作为内参(上游引物为 5’-CTCGCTTCGGCAGCACA-3’,下游引物为 5’AACGCTTCACGAATTTGCGT-3’),MTA1 mRNA(上游引物为 5’-ACTGTCTCCCAACCCTTGTA-3’,下游引物为5’-GTGCAGGGTCCGAGGT-3’),相对表达量用2-ΔΔCT表示。每个样本独立重复实验3次。
1.5 平板克隆实验检测细胞增殖 调整细胞浓度,按每孔5×103个密度铺6孔板继续培养,隔周更换新鲜培养液,2周后用考马斯亮蓝染色,以>30个细胞的克隆记为1个菌落,在显微镜下观察并拍照记录菌落形成数量,每组设3个复孔,重复实验3次。
1.6 Transwell小室检测细胞侵袭 实验前12 h更换为无血清培养基,将40 μl matrigel基质胶铺于Transwell小室中,消化细胞并用1 μl PBS清洗2遍,将500 μl 无血清培养基加入24 孔板,取5×105细胞重悬,向Transwell小室中加200~250 μl 细胞悬液,保证下层完全培养基与Transwell小室间无气泡。置于培养箱内正常培养 24 h,加用甲醇配制、PBS 稀释的0.1%结晶紫染液500 μl进行染色,室温避光15 min,PBS 漂洗后用棉棒擦Transwell小室内部,倒置晾干,置于倒置荧光显微镜下观察显穿过膜的细胞并拍照计数。
1.7 划痕实验检测细胞迁移 调整细胞浓度,以5×104个/孔接种于24孔培养板中,分组处理同上,继续培养48 h,弃掉培养液,用10 μlsterile pipette 枪头沿直线做划痕,加入100 μl PBS将细胞碎片冲洗掉,然后无血清培养基,37℃、5%CO2温箱培养,分别于0 h和24 h在倒置显微镜下观察细胞运动情况以及划痕宽度,计算细胞迁移的距离和细胞迁移率。
1.8 小管形成测定 按照文献[8]方法进行小管形成实验,即将50 μl Matrigel水平铺板至96孔板, 37℃下固化0.5 h。将胰腺癌各细胞系细胞(2×104个细胞/孔)接种在基质胶上并在含有MTA1 miRNA的DMEM培养基中培养。 细胞在37℃含5%CO2的培养箱中孵育16 h,倒置显微镜下进行计数。
1.9 Western blotting检测 将各组细胞浓度调整至1×106个/ml,加入适量的RIPA裂解液,裂解30 min,12 000 r/min 4℃离心10 min,收集上清,采用ECA试剂盒检测蛋白浓度,将蛋白样品和Loading buffer混合,100℃水域变性5 min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入相应一抗, 4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h后加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
2 结果
2.1 MTA1在EC不同组织和细胞中的表达 qRT-PCR结果显示,EC组织中MTA1的表达水平高于癌旁正常组织(P<0.05); MTA1在肿瘤细胞中的表达高于人正常食管上皮细胞HFT-1A(P<0.05),其中在Eca-109细胞中表达量最高(P<0.01)。见表1、2。


类别MTA1EC组织0.956±0.537癌旁组织0.119±0.068*
注:与EC组织比较,*P<0.05


细胞MTA1HET-1A0.915±0.120Eca-1092.227±0.137*SHEEC11.666±0.122*#Ec-97061.712±0.084*#EC87121.407±0.062*#TE-11.366±0.088*#
注:与HET-1A比较,*P<0.05;与Eca-109比较,#P<0.05
2.2 细胞系构建 qRT-PCR结果显示,RSK4-MTA1组细胞中MTA1的表达量明显高于空白对照组和RSK4-NC组(P<0.05),空白对照组和RSK4-NC组MTA1的表达差异无统计学意义(P>0.05)。见表3。


组别MTA1空白对照组 1.019±0.054*RSK4-NC组 0.906±0.110*RSK4-MTA1组1.586±0.097
注:与RSK4-MTA1组比较,*P<0.05
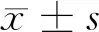
2.3 过表达MTA1对Eca-109细胞株增殖能力的影响 平板克隆实验结果显示,与空白对照组和RSK4-NC组相比,过表达MTA1后,RSK4-MTA1细胞克隆数明显增多(P<0.05)。见表4,图1。
2.4 过表达MTA1对Eca-109细胞株侵袭能力的影响 Transwell小室结果显示,与空白对照组和RSK4-NC组相比,过表达 MTA1后,RSK4-MTA1组Eca-109细胞通过matrigel基质胶的数量明显增多,差异有统计学意义(P<0.05)。见表5,图2。

表4 MTA1的表达对Eca-109细胞株增殖能力的影响 个,
注:与RSK4-MTA1组比较,*P<0.05
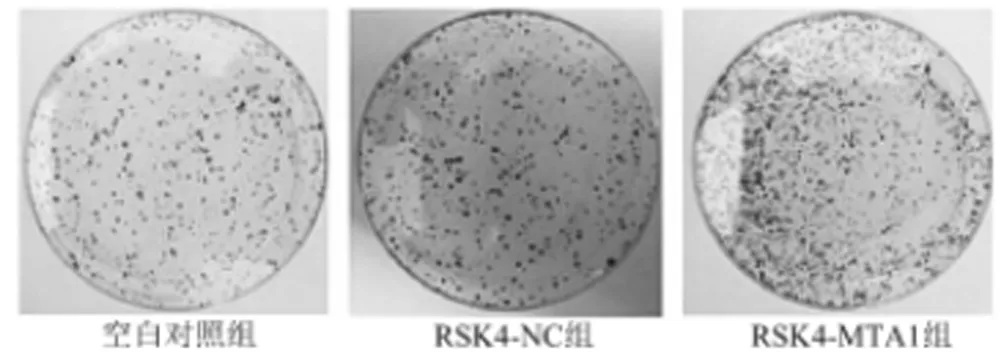
图1 MTA1的表达对Eca-109细胞株增殖能力的影响(平板克隆实验检测细胞增殖)

表5 MTA1的表达对Eca-109细胞株的侵袭能力的影响 个,
注:与RSK4-MTA1组比较,*P<0.05
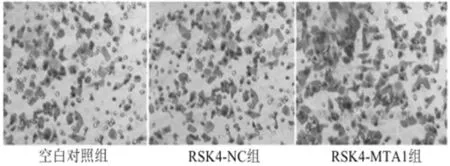
图2 MTA1的表达对Eca-109细胞株的侵袭能力的影响(Transwell小室检测细胞侵袭能力)
2.5 过表达MTA1对Eca-109细胞株迁移能力的影响 细胞划痕实验结果,与空白对照组和RSK4-NC组相比,过表达MTA1后,RSK4-MTA1组细胞运动能力明显增强,差异有统计学意义(P<0.05)。见表6,图3。
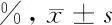

细胞细胞迁移率空白对照组 52.144±4.622*RSK4-NC组 55.534±4.279*RSK4-MTA1组91.499±5.218
注:与RSK4-MTA1组比较,*P<0.05
2.6 MTA1对Eca-109细胞株小管形成的影响 评估MTA1对Eca-109细胞血管形成的影响,在空白对照组和RSK4-NC组中,细胞不能建立管状结构网络,而在RSK4-MTA1组中,16 h内 MTA1诱导癌细胞快速形成管状结构网络。小管形成测定的定量分析显示,与空白对照组相比, MTA1过表达细胞中血管的数量明显
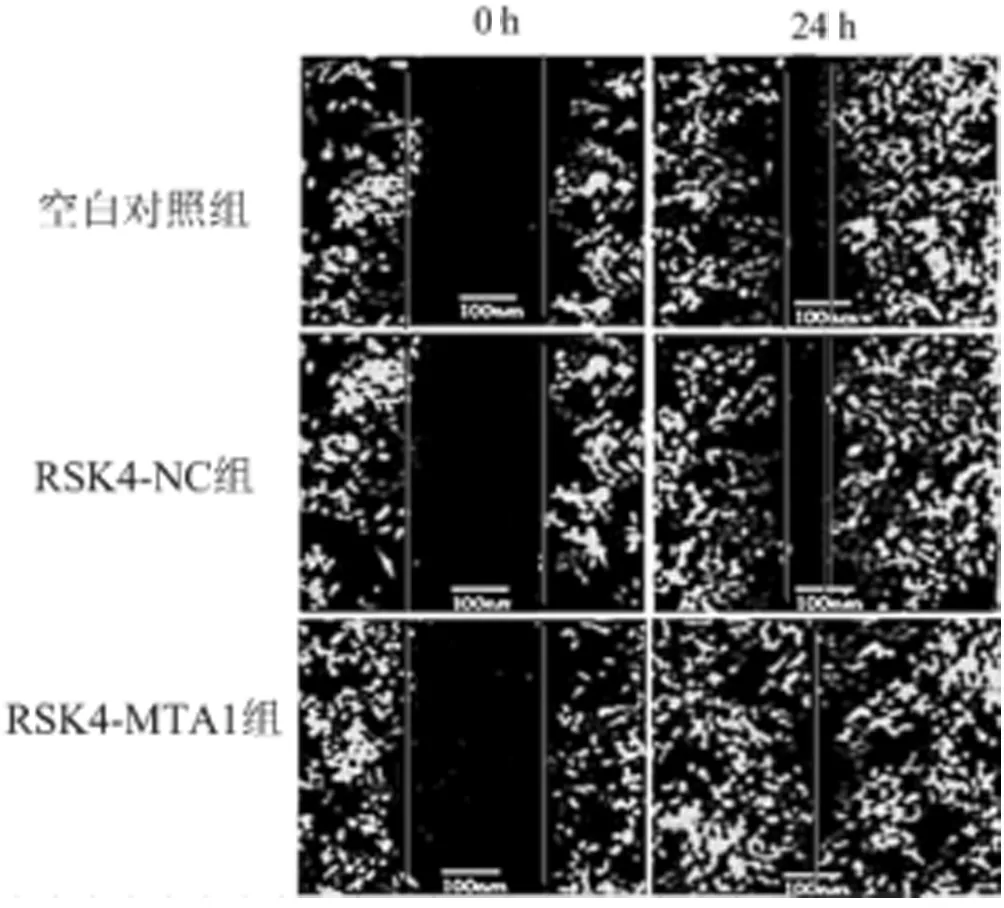
图3 MTA1的表达对Eca-109细胞株迁移能力的影响图(划痕实验检测细胞迁移能力)增加(P<0.05)。见表7,图4。

表7 MTA1对Eca-109细胞系小管形成的影响 个,
注:与RSK4-MTA1组比较,*P<0.05
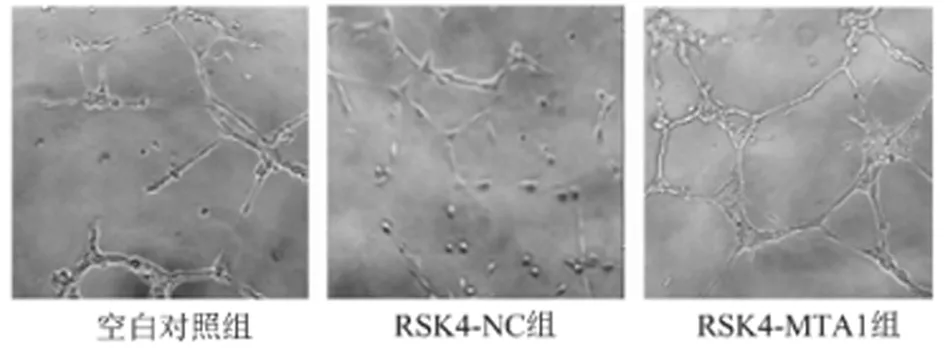
图4 MTA1对Eca-109细胞系小管形成的影响(小管形成的情况)
2.7 过表达MTA1对HIF-α/VEGF通路相关蛋白HIF-α、VEGF表达的影响 Western-blot检测过表达MTA1对Eca-109细胞系中HIF-α/VEGF通路相关蛋白HIF-α及VEGF的影响,结果显示,与空白对照组和RSK4-NC组比较,RSK4-MTA1组HIF-α及VEGF蛋白的表达量明显增加(P<0.05)。见表8,图5。


组别HIF-αVEGF空白对照组 1.209±0.386*1.064±0.134*RSK4-NC组 0.942±0.222*1.006±0.106*RSK4-MTA1组2.001±0.1872.330±0.391
注:与RSK4-MTA1组比较,*P<0.05
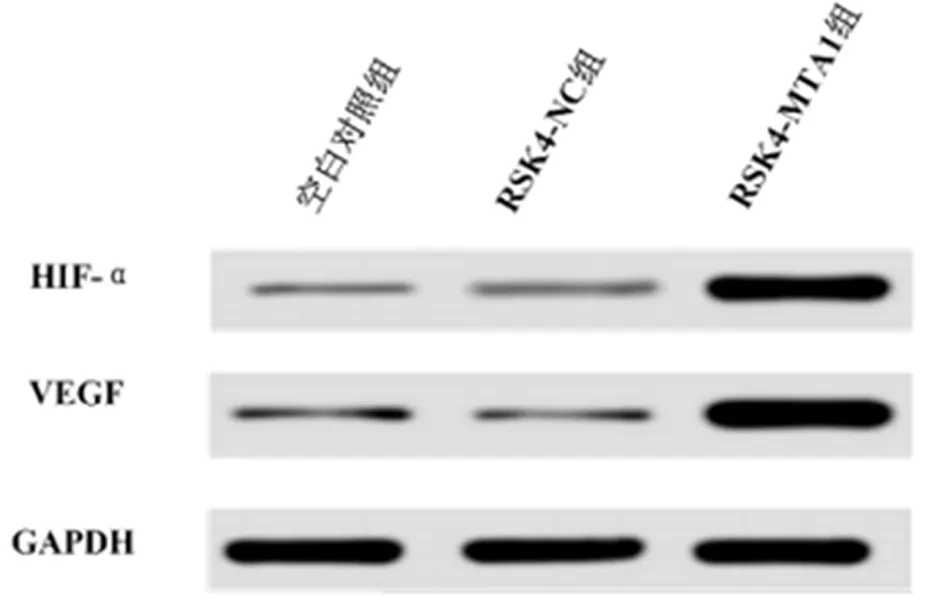
图5 MTA1与HIF-α/VEGF的作用关系(Western blotting检测HIF-α/VEGF在Eca-109细胞中的表达)
3 讨论
近年来,由于环境和日常膳食结构的变化,EC的发病率和致死率不断攀升,严重危害人类的健康。目前缺乏根治性治疗的外科手段,而EC的靶向治疗尚处于起步阶段[8]。有研究证实细胞内多种信号分子调控或者参与EC细胞的发生及癌细胞的侵袭和迁移,因此从分子基础生物学角度出发寻找EC的发生、侵袭和转移的标志物,为患者提供有效的治疗方法有着重要的意义[9]。
MTA1是一种与肿瘤转移相关的蛋白,其在多种上皮性恶性肿瘤中过表达,Toh等[10]从mRNA和蛋白水平研究发现MTA1在大肠癌组织中过表达,且其阳性表达率与淋巴结转移成明显正相关关系。有报道MTA1可与Ral-GTPase 结合激活原癌基因,导致细胞癌变的发生[11]。在对大量的前列腺癌、大肠癌、乳腺癌的临床标本的研究中发现,MTA1 异常表达所引起的恶性肿瘤占很大比重[12]。另外,Xu等[13]研究发现下调MTA1的表达能明显抑制前列腺癌细胞的生长、侵袭以及对外迁移。目前尚无明确的报道研究MTA1的表达与EC的侵袭转移的关系。
本研究采用qRT-PCR检测MTA1的mRNA在EC组织和癌旁组织中的表达发现,MTA1的mRNA在EC组织中表达水平高于癌旁组织(P<0.05),且在食管癌细胞中的表达高于正常是管上皮细胞(P<0.05)。提示MTA1在EC的发生发展中可能起着重要作用。为观察MTA1对食管癌的转移的影响,本研究以EC细胞系Eca-109作为研究对象,通过慢病毒感染构建稳定MTA1过表达菌株,结果显示RSK4-MTA1组细胞的增殖、侵袭和迁移能力明显增强(P<0.05)。
有研究发现MTA1能够促进大肠癌旁淋巴管生成,而HIF-1α和 VEGF是肿瘤转移和淋巴管形成的关键蛋白,正常供氧情况下,HIF-1α易被泛素蛋白酶降解,当缺氧时,HIF-1α降解缓慢,蛋白出现增多[14]。文献报道HIF-1α可通过调控靶基因来影响淋巴生成,从而促进肿瘤转移[15],在大肠癌癌、乳腺癌以及口腔鳞状细胞癌中已有文献报道其能够促进VEGF的表达,促进淋巴管生成[16]。本研究显示在空白对照组和RSK4-NC组中,细胞不能建立管状结构网络,而在RSK4-MTA1组中,16 h内 MTA1诱导癌细胞快速形成管状结构网络,且与空白对照组相比, RSK4-MTA1组中血管的数量明显增加(P<0.05)。Western-blot检测MTA1过表达对Eca-109中HIF-α/VEGF通路相关蛋白HIF-α及VEGF的影响,结果显示,与空白对照组相比较,RSK4-MTA1组HIF-α及VEGF蛋白的表达量明显增加(P<0.05),提示MTA1过表达能促进HIF-α及VEGF的表达。
综上所述,食管癌组织中MTA1的表达较正常组织明显增加,MTA1过表达可促进食管癌细胞Eca-109的增殖和侵袭能力,促进肿瘤细胞血管的形成,MTA1对食管癌肿瘤进展和血管形成可能通过调节HIF-α/VEGF信号通路实现的。
