叶酸缺乏对人肺腺癌细胞增殖、迁移及凋亡的影响
2020-07-01张敏聪王晓芳贾友超商琰红
张敏聪 王晓芳 贾友超 商琰红
叶酸是人体必需营养物质,其辅酶形式为四氢叶酸,参与一碳基团转移等多种生化反应,从而影响DNA的合成、修复及甲基化。有研究者发现,动物及人类叶酸状态与某些组织癌症发生息息有关,其机制可能与叶酸缺乏诱导了DNA损伤、不稳定、甲基化异常有关[1-3]。本实验将人肺腺癌细胞H1299在无叶酸培养基中培养12 d后,探讨叶酸缺乏与肺腺癌之间的关系。
1 材料与方法
1.1 细胞株与试剂 人NSCLC细胞株H1299由中国科学院干细胞库提供;RPMI 1640培养基、无叶酸PRMI 1640培养基、胎牛血清、0.25%胰酶购自Gibco公司;FITC Annexin V凋亡试剂盒购于美国BD公司;台盼蓝染料购于美国Sigma公司;吉姆萨原液、周期检测试剂盒均购自Solarbio公司。
1.2 细胞培养 将处于对数生长期的H1299细胞分为2组,分别置于含叶酸浓度为0 mg/ml(实验组)、1 mg/ml(对照组)的RPMI-1640培养基中,并将细胞培养于5% CO2、37℃孵箱内,定期换液传代。
1.3 细胞计数 实验组与对照组均以相同细胞计数(7×105个细胞)传代,且每3天传代1次。传代时将细胞用PBS清洗2次,加胰酶消化至细胞回缩,制备单细胞悬液,台盼蓝染色,相差显微镜下计数活细胞,再以相同细胞计数(7×105个细胞)传代,继续接种培养。
1.4 细胞形态学观察 分组后,镜下观察不同时期(3 d、6 d、9 d、12 d)2组细胞形态变化。
1.5 平板克隆形成实验 取实验3 d的2组对数生长期细胞2 000个,接种于6 cm培养皿中,持续培养6 d 后,4%多聚甲醛固定细胞15 min,吉姆萨染色30 min,PBS洗至无背景后室温风干。镜下观察细胞克隆数及形态,计算克隆形成率,克隆形成率=(克隆数/接种细胞数)×100%。 实验重复3次。
1.6 细胞划痕实验 分别取2组H1299细胞30万个,接种于6孔板中。待细胞愈合率达90%后,用无菌200 μl枪头在6孔板中均匀划线,PBS液清洗6孔板中悬浮的细胞后,加入相应无血清培养基,37℃、5% CO2孵箱继续培养。显微镜下观察不同时间(0 h、24 h、48 h、72 h)划痕面积,并在固定划痕处拍照。 使用Image-Pro plus 6.0软分析划痕面积。划痕愈合率(%)=(0 h 划痕面积-0 h、24 h、48 h及72 h划痕面积)/0 h划痕面积×100%。实验重复3次。
1.7 流式细胞术检测细胞周期 收集2组第6疙瘩细胞制备单细胞悬液,70%乙醇固定,-20℃过夜,PBS洗去固定液,加入1%RNA酶,37℃水浴30 min,加入PI 避光孵育30 min后,上流式细胞仪检测。实验重复3次。
1.8 Annexin/PI 标记法检测凋亡 分别收集2组6 d、9 d、12 d细胞,PBS洗涤,制成1×106/ml细胞悬液,将细胞悬液中加入FIT Annexin V和PI,混匀室温避光孵育15 min,最后加入Binding buffer,1 h内上机检测,每组设置3个平行样品,实验重复3次。
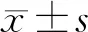
2 结果
2.1 叶酸缺乏对H1299细胞形态的影响 光镜下观察2组细胞,对照组细胞呈贴壁生长,粘附性强,细胞轮廓清楚,胞膜完整,胞质清亮,悬浮死细胞及细胞碎片少,细胞增殖旺盛。实验组细胞随无叶酸培养时间延长,细胞贴壁粘附能力逐渐减弱,生长减慢,细胞轮廓模糊不清、胞膜破裂,细胞肿胀、体积增大,不规则形态的细胞增多,细胞核碎裂、胞质中颗粒物质逐渐增多。由此可见,叶酸缺乏会造成细胞形态及胞核的异常,导致细胞死亡增加。见图1。
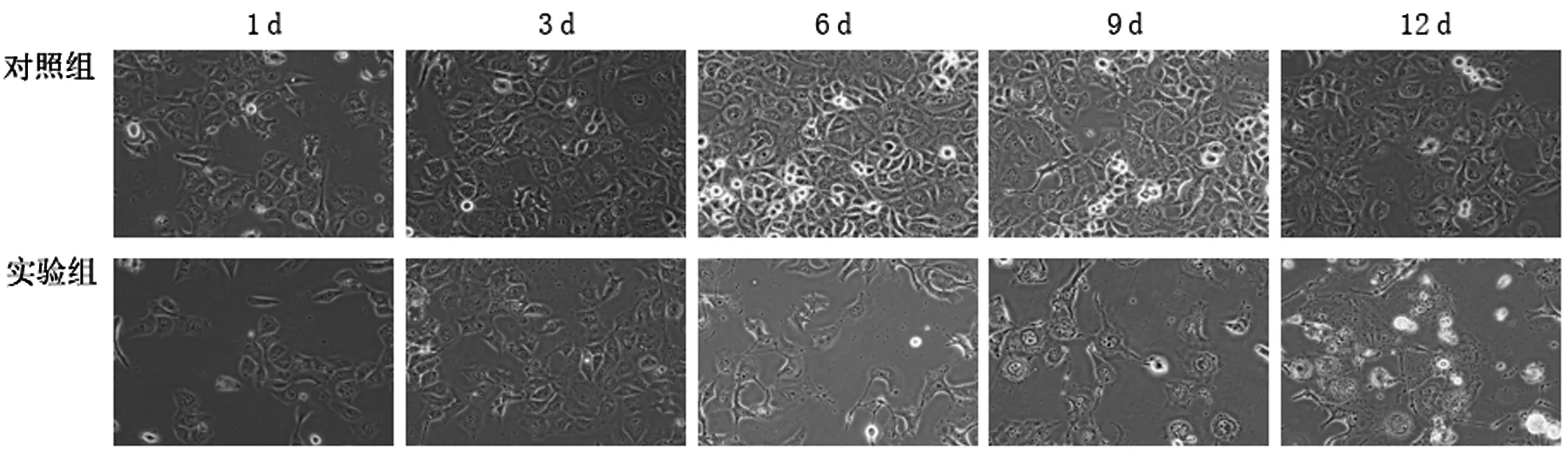
图1 显微镜下观察基底动脉改变(×200)
2.2 叶酸缺乏对H1299细胞增殖能力的影响 根据H1299细胞每次传代前进行细胞计数结果分析得出:对照组与实验组细胞H1299在有无叶酸培养基中生长的前3 d细胞计数结果无明显区别。但在6 d后,实验组细胞数明显低于对照组,且随无叶酸培养时间延长,2组间的差距越发显著,实验组可见大量漂浮死亡细胞。可见叶酸缺乏可致肺腺癌细胞H1299增殖减慢,具有时间依赖性。见表1,图2、3。
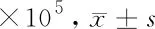

实验时间实验组对照组P值3 d39.02±2.3241.66±2.81>0.056 d30.98±1.7643.12±2.22<0.019 d6.36±0.5562.80±1.18 <0.0112 d2.08±0.1834.40±1.10 <0.01
2.3 叶酸缺乏对H1299细胞克隆形成率的影响 无叶酸培养H1299细胞后,克隆形成能力较对照组明显减弱,实验组克隆形成率为(3.16±0.48)%,对照组为(34.46±2.22)%,2组差异有统计学意义(P<0.05);且实验组克隆体积显著小于对照组(P<0.05)。在最初的3 d,镜下可见对照组单个细胞分裂增殖活跃,但实验组偶可见细胞分裂、增殖,在平板克隆实验的6 d,实验组可见部分细胞死亡,细胞分散,克隆数进一步减少。由此可见叶酸缺乏可抑制肺腺癌细胞体外增殖能力。见表2,图4。
图2 细胞计数
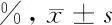

组别克隆形成率对照组34.46±2.22实验组3.16±0.48*
注:与对照组比较,*P<0.05
2.4 叶酸缺乏对H1299细胞迁移能力的影响 细胞划痕实验结果显示:无叶酸培养6 d、9 d、12 d后的H1299细胞,在24 h、48 h、72 h的划痕愈合率均显著低于对照组细胞(P<0.05)。随着无叶酸培养时间延长,愈合率均呈下降趋势,但差异并无统计学意义(P>0.05)。可见在叶酸缺乏早期就可显著抑制H1299细胞迁移,但其抑制细胞迁移能力并未随叶酸缺乏时间延长发生明显变化。见图5,表3。
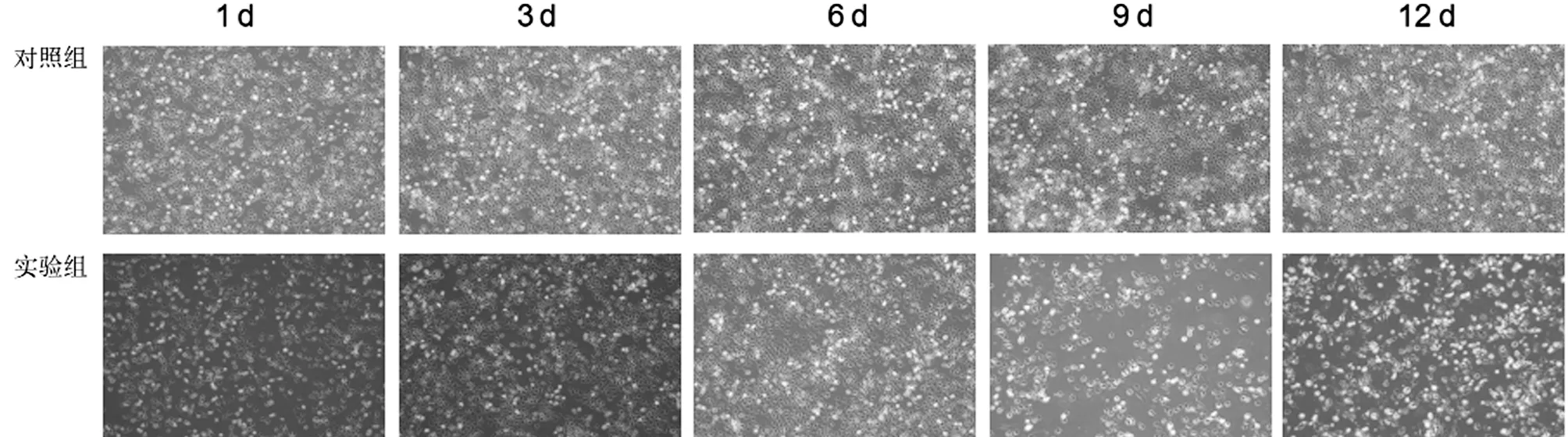
图3 显微镜下观察实验组和对照组H1299细胞,培养不同时期的生长情况(×40)

对照组实验组对照组(×40)对照组(×40)
图4 平板克隆形成实验检测叶酸缺乏对H1299细胞克隆形成率的影响
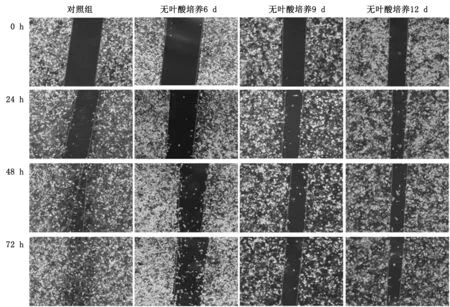
图5 划痕实验观察叶酸缺乏对H1299细胞迁移能力的影响

时间对照组无叶酸培养6 d无叶酸培养9 d无叶酸培养12 d24 h32.80±10.5716.90±3.21*14.98±3.51*11.77±0.64*48 h81.90±12.2122.65±6.75#20.00±2.12#14.15±2.97#72 h99.53±0.8121.44±2.68#22.40±1.63#16.45±2.68#
注:与对照组比较,*P<0.05,#P<0.01
2.5 叶酸缺乏对H1299细胞周期的影响 对照组细胞在无叶酸培养6 d后增殖显著减慢、细胞形态改变,为此我们检测2组细胞在实验6 d的细胞周期各时项比例。结果显示:与对照组处于S期、G2/M期细胞百分率50.44%、8.03%相比,实验组处于S期的细胞比率增加,G2/M期减少,其百分比分别为56.43%、5.83%,差异有统计学意义(P<0.05)。可见实验组细胞周期阻滞于S期,DNA复制及有丝分裂受阻,不能顺利进入细胞周期的下一阶段。由此可进一步证明,叶酸缺乏抑制了细胞增殖。见图6,表4。

图6 流式细胞术检测有、无叶酸对细胞周期的影响

组别G0/G1期S期G2/M期对照组41.53±1.1850.44±0.808.03±0.41实验组37.74±0.7756.43±0.86*5.83±0.39*
注:与对照组比较,*P<0.05
2.6 叶酸缺乏对H1299细胞凋亡的影响 无叶酸培养6 d后,H1299细胞发生了明显的凋亡,细胞凋亡率增加1.10%;随无叶酸培养时间延长,早凋及晚凋均显著增加,且以早期凋亡为主,2组差异有统计学意义(P<0.05)。见表5,图7。
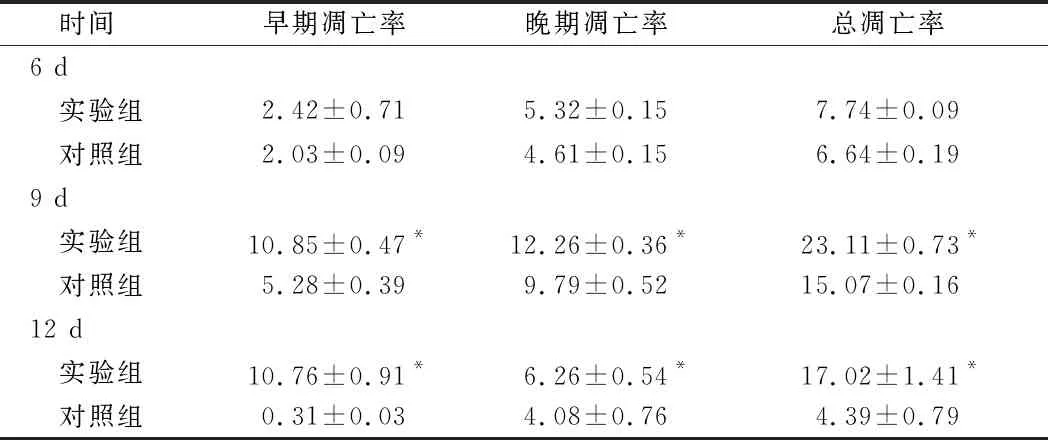
时间早期凋亡率晚期凋亡率总凋亡率6 d 实验组2.42±0.715.32±0.157.74±0.09 对照组2.03±0.094.61±0.156.64±0.199 d 实验组10.85±0.47*12.26±0.36*23.11±0.73* 对照组5.28±0.399.79±0.5215.07±0.1612 d 实验组10.76±0.91*6.26±0.54*17.02±1.41* 对照组0.31±0.034.08±0.764.39±0.79
注:与对照组比较,*P<0.05
3 讨论
叶酸在体内通过二氢叶酸还原酶(DHFR)还原为四氢叶酸后,在亚甲基四氢叶酸还原酶(MTHFR)参与下生成5-甲基四氢叶酸,其作为一碳单位的载体,一方面参与嘧啶环的合成以及将dUMP还原为dTMP,完成了dTMP的从头合成途径,参与核酸的生成;另一方面与同型半胱氨酸反应,生成S-腺苷甲硫氨酸(SAM),参与DNA、RNA、组蛋白的甲基化反应[4-6]。一旦叶酸缺乏或代谢障碍,将造成DNA合成、修复障碍及甲基化异常。可见叶酸在调节细胞内甲基化反应和保持基因组稳定性方面发挥着重要作用[7]。本次实验结果,无叶酸培养的H1299细胞增殖能力低、活性差、形态异常、凋亡增加,其生化机制可能与此有关。
有研究表明叶酸缺乏可使宫颈癌发病风险上升[8,9]。在人类的食道、胃、胰腺、乳腺等癌症中,叶酸的摄入具有预防作用[10,11]。但也有部分研究结果与之相反[12]。邓尚新等[13]曾对叶酸预防结直肠腺瘤复发作用进行Meta分析,补充叶酸不仅不能减少结直肠腺瘤复发风险,还可促进进展期腺瘤的复发。由此可见,不同的癌种研究结果不一致,提示叶酸缺乏与癌症风险的关系与癌症种类有关。在细胞学水平,叶酸缺乏可致正常细胞癌变,而在癌细胞中可抑制细胞生长。曾有报道,无叶酸培养正常人肝细胞系QSG-7701后,出现细胞增殖加快、衰老受阻,进而促进肿瘤形成,认为这与叶酸参与LCN2基因启动子区H3K9Me2的甲基化调控有关[14]。而人肝癌细胞株HepG2经无叶酸培养后,出现细胞生长抑制、细胞周期阻滞、凋亡率增加,认为与细胞周期特异性有关[15]。头颈部肿瘤中的研究也出现类似结果[16,17]。虽然有报道认为低浓度的血清叶酸水平与肺癌有关[18],但在叶酸缺乏下肺腺癌细胞功能方面的研究仍是空白。
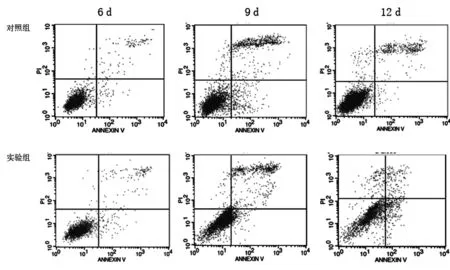
图7 流式细胞术监测无叶酸培养H1299细胞6 d、9 d、12 d后,细胞凋亡率的变化
该实验中无叶酸培养早期,细胞形态及生长速度无明显变化,仍可见部分细胞分裂、增殖,这可能与短时间内细胞中叶酸含量尚能维持其正常生物学行为有关,随着无叶酸培养时间延长,细胞内叶酸含量严重缺乏,逐渐出现了细胞形态异常、增殖受限,克隆能力进一步下降,乃至细胞死亡。在平板克隆实验中,就很好的体现了这一动态过程。
流式细胞术提示,叶酸缺乏早期H1299细胞凋亡不明显,但已出现S期阻滞,S期主要进行DNA合成,而作为核酸的原材料——叶酸缺乏,阻碍了DNA合成及复制;S期关卡又是细胞周期关卡之一,使细胞不能顺利进入G2/M期,导致细胞周期中断,进而阻碍了细胞分裂增殖;在后续实验中可通过检测细胞周期S期相关蛋白CyclinA、CDk2、PCNA等表达情况,进一步明确H1299细胞周期阻滞情况。在平板克隆实验早期,实验组出现少量的细胞克隆,也支持了叶酸缺乏在早期是通过抑制细胞增殖来发挥作用。随着无叶酸培养时间延长,2组细胞凋亡率的差距更加显著,且以早期凋亡为主;在平板克隆实验中,早期形成的克隆细胞已消失。可见叶酸缺乏早期,细胞计数的减少可能以细胞增殖能力降低为主,后期以凋亡为主。在叶酸缺乏的环境下,生长抑制、S期阻滞、凋亡增加的动态发展,提示DNA复制、有丝分裂的阻断,细胞周期的分离可能参与了凋亡诱导过程。
出现以上现象的分子机制可能涉及叶酸缺乏破坏了DNA完整性、限制了DNA修复[19]。叶酸缺乏可影响dUMP合成dTMP,使dTMP生成减少,由于大多数DNA聚合酶不能有效区分dUTP及dTTP,这就造成了更多的dUTP错误掺入DNA中,进而启动DNA错配修复系统,而在修复过程中会出现DNA单链及双链断裂,影响了DNA的完整性.叶酸缺乏所致的dNTP池失衡和尿嘧啶在DNA中的错误插入,导致DNA修复系统受损,DNA甲基化异常在DNA链的错配修复过程中也起着重要作用[20],可见叶酸缺乏引起的DNA甲基化紊乱,也会影响DNA错配修复。可见叶酸在核酸水平就发挥了细胞增殖、诱导凋亡的作用。
除此之外,有报道指出叶酸缺乏诱导HepG2细胞凋亡与周期特异性有关[15],完整的细胞周期分离,也被认为是触发细胞死亡的原因;还有报道认为,叶酸缺乏还可通过下调凋亡相关基因bcl-2诱发人外周血淋巴细胞凋亡[21]、触发内质网应激促进小鼠精母细胞GC-2凋亡[22]、上调肝癌细胞SK-Hep1、Mahlavu内活性氧(ROS)水平抑制细胞增殖[23]。肺腺癌细胞的凋亡除与DNA复制、修复抑制、S期阻滞有关外,还涉及了哪些凋亡相关机制仍需研究。
由于细胞死亡包括细胞坏死、细胞凋亡和细胞自噬;细胞自噬的诱因之一是营养物质的缺乏,董小欢[24]提出,叶酸缺乏可诱导小鼠胚胎干细胞发生自噬,所以,无叶酸培养的H1299细胞是否也存在自噬行为,仍需探讨。
张艳军[25]发现叶酸缺乏可通过上调E-cadherin及下调间叶细胞标志物a-SMA、Vimentin和PKM2的表达抑制肝星状细胞HSC-T6的迁移.本研究发现,实验组较对照组细胞迁移能力显著降低,且在叶酸缺乏早期其抑制作用就已十分突出,随无叶酸培养时间延长,迁移能力只是有下降趋势,我们推测,H1299细胞的迁移能力对叶酸缺乏十分敏感,其抑制能力在早期就发挥了强大作用,叶酸的持续缺乏可能在维持抑制迁移能力方向发挥了作用。曾有报道指出叶酸缺乏可使miRNA-34a表达上调[26],而miRNA-34a在NSCLC中的表达可抑制其转移[27]。所以叶酸缺乏抑制H1299细胞的迁移作用可能与此有关。但也有报道指出,叶酸缺乏所致的肿瘤微环境可促进肿瘤细胞上皮-间质转化并出现肿瘤干细胞表型,增强了肿瘤细胞的转移和侵袭能力[23]。由此可见,在不同细胞系中,叶酸缺乏可导致不同的生物学行为。人体内,肿瘤细胞所在的内环境错综复杂,叶酸的改变可能牵一发而动全身,叶酸缺乏对肺癌的利弊仍需探讨。
综上所述,叶酸缺乏抑制了人肺腺癌细胞株H1299细胞的增殖、迁移,诱导细胞凋亡,可能与细胞周期阻滞有关,也可能涉及DNA损伤、配错修复系统紊乱、自噬作用增强等生物学行为。
