乙酰水杨酸对三角褐指藻岩藻黄质含量的影响及其分子机理研究
2020-07-01龚一富朱帅旗李申睿谢志浩王何瑜
章 丽 龚一富 朱帅旗 刘 浩 李申睿 谢志浩 王何瑜
(宁波大学海洋学院,浙江 宁波 315800)
岩藻黄质(fucoxanthin)是一类主要存在于褐藻、硅藻中的脂溶性天然类胡萝卜素,占类胡萝卜素总量的10%以上[1]。该色素与几种蛋白质以及叶绿素a结合,在类囊体中形成岩藻黄质-叶绿素a/c-蛋白复合体(fucoxanthin chlorophyll a/c protein,FCP),可通过叶绿素a 将激发能传递到光合电子传递链,具有光捕获和光保护能力[2]。岩藻黄质具有一个丙二烯键、一个共轭羰基以及一个5,6-环氧化物特殊结构[3],这些结构赋予岩藻黄质多种生物活性,包括抗肥胖、抗糖尿病[4]和抗肿瘤活性[5-9]。其中岩藻黄质的多烯发色团的类胡萝卜素端是抗肥胖作用的关键结构,它含有一个烯键和两个羟基,能够调节腹腔白色脂肪组织(white adipose tissue,WAT)线粒体产生解偶联蛋白1(uncoupling protein 1,UCP1),促进脂肪酸的氧化以及WAT 的产热;岩藻黄质还能通过调节WAT 分泌的细胞因子来改善胰岛素抵抗以及降低血糖水平[10]。在抗肿瘤方面,岩藻黄质在胶质瘤[5]、乳腺癌[6]、肺癌[7]、结肠癌[8]和大肠癌[9]等多种癌症中具有抗增殖作用。Yu 等[11]发现岩藻黄质能够调控胃癌细胞(MGC-803细胞)周期停滞在G2/M 期,同时通过降低酪氨酸激酶/转录激活因子(JAK/STAT)通路中CyclinB1 基因的表达,抑制MGC-803 细胞的增殖。此外,研究表明岩藻黄质可诱导Hela 细胞凋亡,并能通过提高人宫颈SIHA 细胞对肿瘤坏死因子(TNF)相关的凋亡诱导配体(TNFrelated apoptosis-inducing ligand,TRAIL)敏感性,选择性诱导肿瘤细胞凋亡[12-13],因此岩藻黄质与TRAIL 联合预防或治疗宫颈癌具有很大潜力。
岩藻黄质具有潜在保健、抗癌功能,且可进行微藻培养,因此对微藻的岩藻黄质合成调控研究具有重要意义。三角褐指藻(Phaeodactylum tricornutumBohlin)作为主要产岩藻黄质的微藻之一,已报道可通过培养条件、营养成分的改变或诱导子来提高岩藻黄质含量。如Kosakowska 等[14]发现三角褐指藻在缺铁的培养条件下,岩藻黄质含量降低,而在氮源充足的条件下,三角褐指藻的岩藻黄质含量提高[15];张南南等[16]利用高光处理三角褐指藻6 h 后,岩藻黄质含量较对照组提高近1 倍;朱帅旗等[17]发现低浓度硫酸铈(0.2~0.4 mg·L-1)能提高三角褐指藻岩藻黄质含量。水杨酸(salicylic acid,SA)是植物发育以及胁迫耐受性相关信号传递的酚类物质,作为植物内源性诱导子参与并调节植物重要的生理生化活动;而SA 对三角褐指藻岩藻黄质合成影响的相关研究尚鲜见报道。本研究通过向对数期三角褐指藻中添加一定浓度乙酰水杨酸(acetylsalicylic acid,ASA),并对诱导过程中的三角褐指藻的生长、岩藻黄质含量及相关合成基因表达水平进行检测,以期为三角褐指藻岩藻黄质的研究和利用提供一定的理论依据和技术指导。
1 材料与方法
1.1 三角褐指藻的培养
三角褐指藻(Phaeodactylum tricornutumBohlin)由宁波大学海洋生物工程重点实验室藻种室提供。经过f/2 固体培养基培养,挑斑纯化扩大培养,以1×105cells·mL-1初始浓度接种到f/2 液体培养基中,置于20℃、62.5 μmol photons·m-2·s-1、12 h/12 h(黑光暗)条件下培养。
1.2 ASA 处理
待三角褐指藻生长至对数期(1×106cells·mL-1),采用0(CK)、10、25、50、100 mg·L-1的ASA 对其进行处理,每个处理设3 组平行。
1.3 三角褐指藻生长曲线测定
取1 mL 对数期藻液,通过6800 型双光束紫外可见分光光度计(英国bibby 科技有限公司)进行全波段扫描,确定藻液最大吸收峰波长。将藻液稀释成浓度梯度,测定最大吸收峰的OD 值,同时用XB-K-25 型血球计数板(玉环县求精医用仪器厂)计算相应浓度的藻细胞密度。通过OD 值和藻细胞密度建立光密度回归方程。以加入ASA 为初始时间,处理持续到第8天,期间每隔24 h 取1 mL 三角褐指藻溶液并测定OD680值,每组均设3 个平行。根据光密度回归方程,绘制三角褐指藻的生长曲线。
1.4 岩藻黄质的提取
培养第6 天收集三角褐指藻细胞,参考Kim 等[3]的方法提取三角褐指藻的岩藻黄质,4℃、52 000×g离心10 min 收集藻体,冷冻干燥并研磨后加入无水乙醇重悬,然后静置1 h,4℃、52 000×g离心10 min 后取上清液过一次性针头式滤器(0.22 μm,Millipore),得高效液相色谱(high performance liquid chromatography,HPLC)检测液,备用。
1.5 岩藻黄质含量的测定
精确称取0.1 mg 岩藻黄质标准品溶于1 mL 无水乙醇,依次稀释成不同浓度的标准品。色谱系统为Aliance e2695 separations module HPLC 系统(Waters,美国),Waters 2998 二极管阵列检测器。洗脱程序:先用甲醇/水(9∶1,v/v)洗脱30 min,再用100%甲醇洗脱10 min,最后用甲醇/水(9∶1,v/v)洗脱15 min。进样量10 μL,检测波长445 nm。通过岩藻黄质标准品积分峰面积与浓度作回归曲线,根据色谱图中的色谱峰保留时间以及相应强度,计算样品中岩藻黄质含量。
1.6 岩藻黄质生物合成相关基因的表达分析
收集不同浓度ASA 处理24 h 后的藻液,采用试剂盒(Plant RNA Kit,美国OMEGA-Bio-Tek 公司)提取RNA,PrimeScript RT reagent Kit(Perfect Real Time)试剂盒(TaKaRa,大连)进行反转录。采用SYBR Premix Ex TaqTMⅡ(Perfect Real Time)(TaKaRa,大连)进行荧光定量PCR 检测,目的基因[17-19]和参照基因[20](表1)采用同一扩增程序,应用2-ΔΔCT法计算目的基因的相对表达量。

表1 定量PCR 引物序列Table 1 The primer sequences of quantity PCR
1.7 岩藻黄质含量的主成分分析
以不同浓度ASA 处理下PSY、PDS、ZDS、CRTISO、LYCB和ZEP基因表达量和岩藻黄质含量作为数据集,利用SAS 9.0 统计软件进行主成分分析(principal component analysis,PCA)。
1.8 数据分析
采用Microsoft Office Excel 2012 进行数据处理,SPSS 19.0 进行单因素方差分析,LSD 法进行显著性差异分析。
2 结果与分析
2.1 ASA 对三角褐指藻细胞生长的影响
对数期的三角褐指藻最大吸收峰的波长为680 nm,对数期的三角褐指藻密度与OD680呈良好的线性关系,回归方程为y=0.009 5x- 0.000 5(y为OD680值,x为1 mL 藻液的细胞密度,R2=0.996 2)。由图1可知,各试验组三角褐指藻生长曲线趋势相似,培养第1~第6 天维持高速生长,且在培养第6 天时出现一个生长高峰,培养第7 天时藻细胞数量急剧下降。与CK 不同的是,不同浓度ASA 处理的三角褐指藻在培养第2 天时生长速度下降,培养第3 天又出现较大程度的增长。总体上,ASA 各处理组的三角褐指藻藻细胞数量始终低于CK,表明ASA 抑制了三角褐指藻的生长。
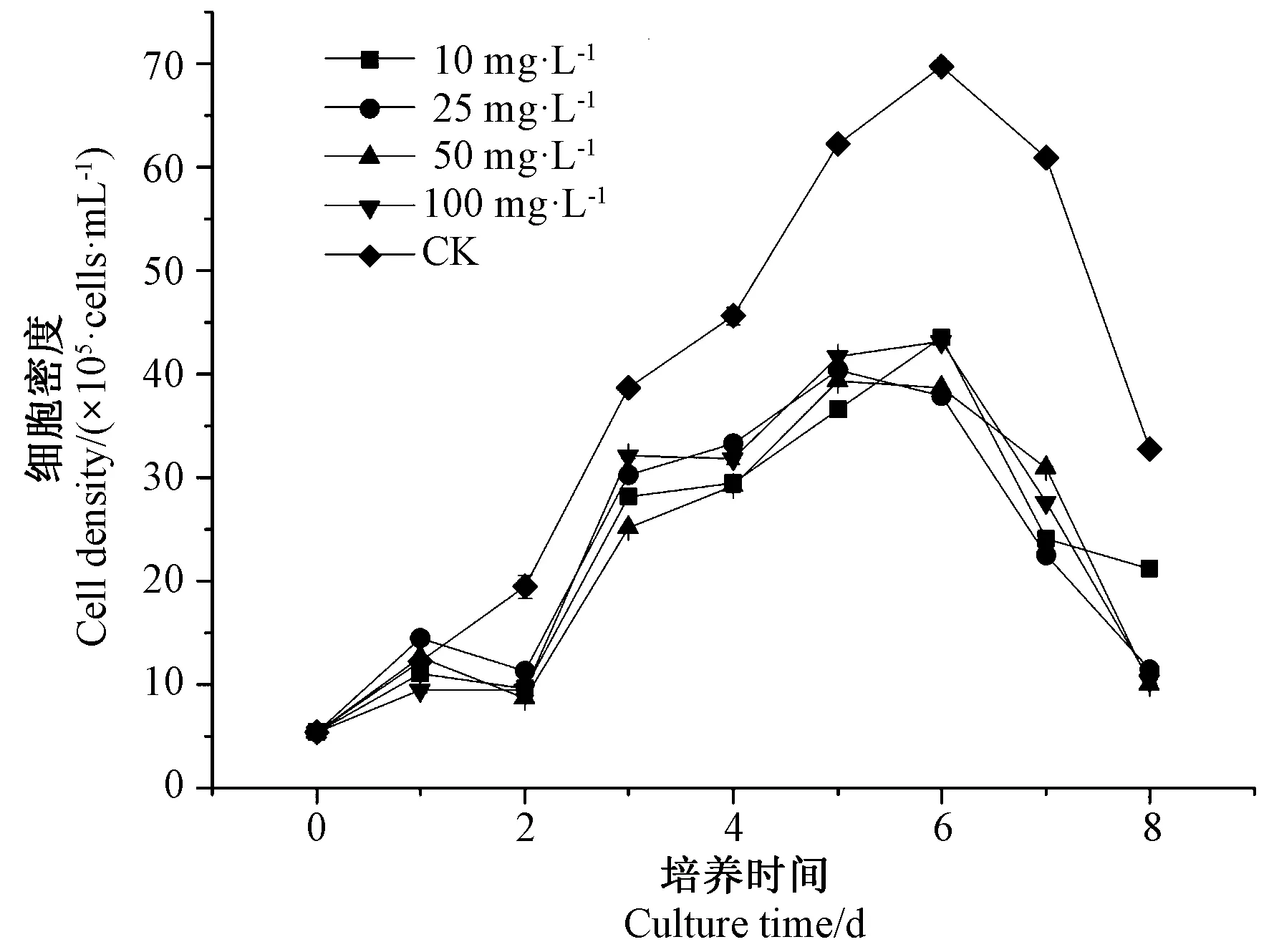
图1 ASA 对三角褐指藻细胞生长的影响Fig.1 Effect of ASA on the growth of Phaeodactylum tricornutum cell
2.2 ASA 对三角褐指藻岩藻黄质含量的影响
根据HPLC 检测发现,标准品和样品的出峰时间均为13.5 min(图2)。以岩藻黄质浓度与HPLC 峰面积作回归方程为y=0.107 4x+0.013 8(y为积峰面积,x为岩藻黄质标准品不同浓度,R2=0.999 9)。根据回归方程得出的岩藻黄质含量(图3),结果显示,三角褐指藻岩藻黄质含量对不同浓度的ASA 均有一定程度的响应。与CK 相比,10、25、50 mg·L-1ASA 处理组中三角褐指藻岩藻黄质含量分别极显著提高了91%、77%、30%(P<0.01),但100 mg·L-1ASA 处理组中岩藻黄质含量略低于CK。
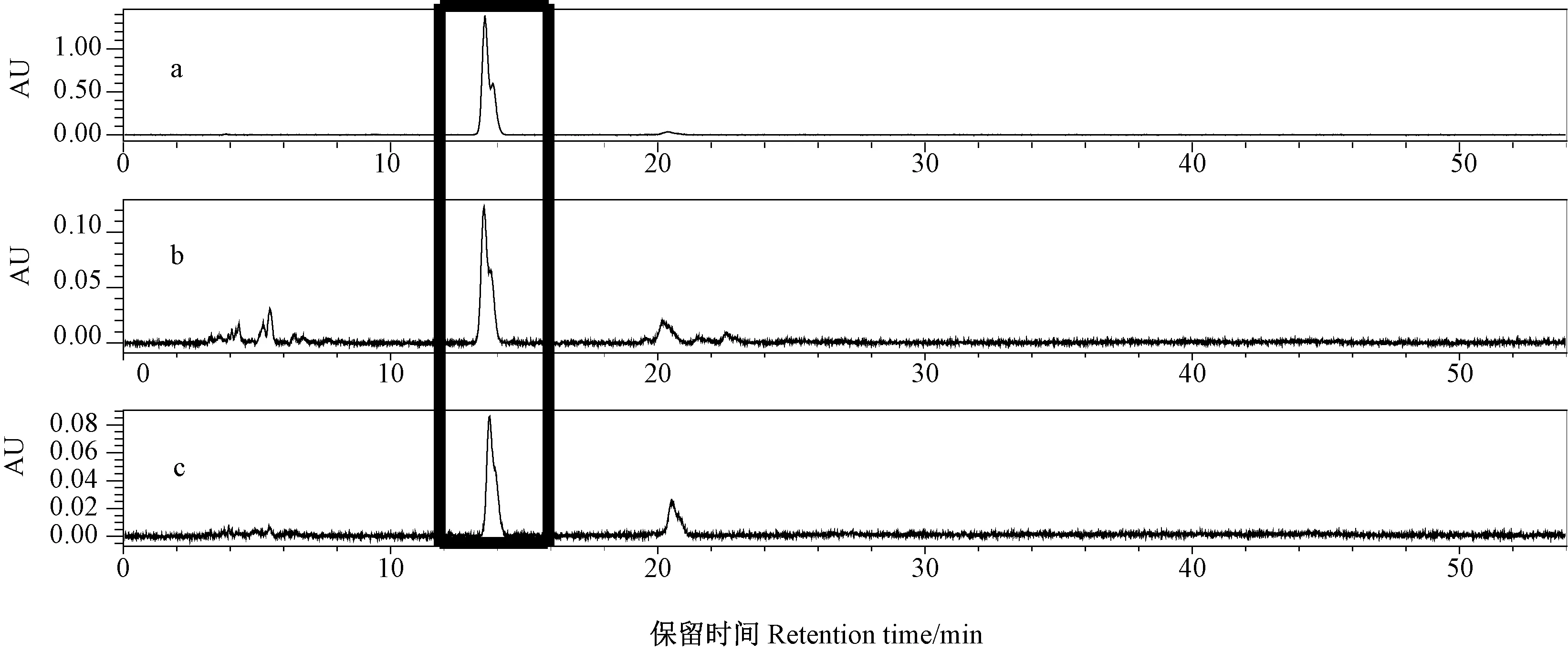
图2 445 nm 光谱下岩藻黄素的HPLC 图Fig.2 HPLC diagram of fucoxanthin in Phaeodactylum tricornutum under spectrum of 445 nm
2.3 ASA 对三角褐指藻岩藻黄质生物合成相关基因表达的影响
比较不同浓度ASA 对三角褐指藻岩藻黄质合成相关基因表达的影响,结果如图4所示。随着ASA 浓度的增加,PSY、PDS、ZDS、CRTISO、LYCB和ZEP基因的相对表达量均呈现先增加后减少的趋势,其中10 mg·L-1ASA 处理组的6 个基因表达量均最高,且极显著高于CK(P<0.01);25 mg·L-1ASA 处理组,6 个基因的表达也得到显著或极显著上调。当ASA 浓度上升到100 mg·L-1时,大部分目的基因的表达仍然上调,但上调趋势渐缓。这可能是因为,低浓度ASA 诱导藻细胞产生信号分子,调控岩藻黄质途径基因的表达,但随着ASA 浓度的增加,造成了藻细胞膜系统和功能受损,导致基因调控作用减弱。

图3 不同浓度ASA 处理下三角褐指藻中岩藻黄质含量的变化Fig.3 Variation of the content of fucoxanthin in Phaeodactylum tricornutum treated with different concentrations of ASA
2.4 三角褐指藻岩藻黄质生物合成相关基因的主成分分析
利用荧光定量所检测到的与岩藻黄质相关的5 个基因表达数据,结合5 种不同浓度ASA 处理下岩藻黄质的含量,构成原始数据集,进行主成分分析,得到了主元向量中5 个主成分特征值的贡献率(表2),其中,第一主成分(PC1)贡献率(90.05%)和第二主成分(PC2)累计贡献率(97.07%)超过85%,以第一主成分和第二主成分作图(图5)。结果表明,变量(PSY、PDS、ZDS、CRTISO、LCYB和ZEP)与岩藻黄素含量存在正相关关系,其中,ZEP基因对三角褐指藻中岩藻黄素含量的贡献最高。

表2 6 个主成分的贡献率和累积贡献率Table 2 The Proportion and cumulative proportion of six principal components
3 讨论
岩藻黄质在抗氧化、抗肥胖[4]和抗癌[5-9]的治疗中有重要的作用,三角褐指藻作为具有丰富岩藻黄质的单细胞藻,其生长速率以及岩藻黄质含量均优于大型藻,如海带(Laminaria japonica)、裙带菜(Undaria pinnatifida)等,目前已经对其进行商业规模化养殖[21]。SA 是植物抗逆的关键激素,其结构类似物ASA 的诱导作用也得到了证实。目前国内外已有学者报道了SA 对微藻生长的影响,Czerpak 等[22]研究结果表明,10-6、10-5、10-4mol·L-1SA 可促进小球藻的生长。而在微拟球藻和水华鱼腥藻中,SA 对其生长影响呈现低促高抑的现象[23-24]。SA 在2.5~40 mg·L-1以及40~120 mg·L-1浓度范围内分别对三角褐指藻和铜绿微囊藻有抑制作用,且抑制作用与浓度呈正相关[23,25]。由于藻类之间的差异,SA 对微藻生长的影响没有统一的规律,但外源SA 作为酚酸类化感物质之一,可通过不同途径来影响植物和藻类的生长,除了造成质膜过氧化,最常见的是阻碍叶绿素合成,从而影响植物光合作用[26-27]。在高等植物中,叶面施用SA后,大麦和黑吉豆叶片的叶绿素含量均降低[28-29]。Moharekar 等[30]用不同浓度SA 处理小麦后,其叶绿素a/b 值随着SA 浓度的升高而下降,由此推测SA 改变了捕光天线的尺寸。在微藻中,张诚鹏等[23]发现外源ASA 抑制了三角褐指藻光合效率。胡利静等[25]发现SA 抑制了铜绿微囊藻叶绿素a 的合成,且高浓度的水杨酸(0.12 g·L-1)对叶绿素a 的降解作用更明显。本试验结果也表明,ASA 处理的三角褐指藻细胞数量低于对照组,10~40 mg·L-1ASA 抑制了三角褐指藻的生长。因此推测,ASA 能抑制三角褐指藻叶绿素a 的合成,影响光合作用,抑制藻细胞的生长。

图4 不同浓度ASA 处理下三角褐指藻种各基因转录差异Fig.4 Transcriptional levels induced by different concentrations of ASA in Phaeodactylum tricornutum
大量研究表明,外源SA 能够诱导高等植物和微藻中类胡萝卜素等次级代谢产物的积累。Moharekar等[30]用不同浓度的SA 处理小麦和芒苗种子后,发现两种植物中类胡萝卜素的含量、叶黄素库大小以及脱环氧化速率均显著增加。Vidhyavathi 等[31]用SA 处理雨生红球藻,在低光条件下,10、50 和100 μmol·L-1的SA 能促进虾青素和β-胡萝卜素的合成。SA 处理不仅能促进天然类胡萝卜素的积累,还能增强抗氧化酶的活性,进而提高植物的抗逆性。Hu 等[32]发现,ASA能显著增加番茄叶片的多酚氧化酶和过氧化物酶的活性;经过SA 和ASA 处理后的甜樱桃,其抗氧化物浓度和抗氧化酶活性提高[33]。张颖等[34]用外源SA 处理苹果,发现过氧化氢酶(catalase,CAT)、多酚氧化酶(polyphenol,PPO)、过氧化物酶(peroridase,POD)和苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活性显著提高。以上抗氧化酶都是植物防止膜脂过氧化、维持细胞膜正常代谢的重要酶。本研究中,岩藻黄质的含量随着ASA 浓度的增加呈先上升后下降的趋势,在10 mg·L-1ASA 下岩藻黄质含量最高(P<0.01),100 mg·L-1ASA 对三角褐指藻岩藻黄质含量的影响不显著(P>0.05)。推测10 mg·L-1ASA 作为诱导子,通过影响藻岩藻黄质合成途径中相应基因表达,对岩藻黄质的合成进行调控,进一步减轻膜脂过氧化。100 mg·L-1ASA 可能对藻细胞产生氧化胁迫,加剧膜质过氧化,导致藻细胞数量减少甚至岩藻黄质含量降低。
本研究中6 个岩藻黄质含量合成相关酶表达水平与岩藻黄质含量存在相关性,其中ZEP对岩藻黄质合成贡献度最大。张南南等[35]采用高光处理三角褐指藻6 h 后,ZEP1 和PSY表达量相对于对照组提高近2倍,岩藻黄素含量提高了2.16 倍,ZEP1 可能是编码岩藻黄素合成途径中的限速酶。本研究中,主成分分析也得出ZEP基因对岩藻黄质合成贡献度最高。ASA对三角褐指藻岩藻黄质合成的促进作用,表现在合成途径关键酶基因表达水平和岩藻黄质含量上,其作用机理还需进一步研究。
目前,在岩藻黄质的生物合成途径中,紫黄素到岩藻黄质的合成,仍然存在假说和分歧的观点,一种是由Wilhelm 和Christian 提出紫黄质通过硅甲藻黄素转化成岩藻黄质[36],而另外一种推断是新叶黄质先后经过酮醇化和乙酰化两步修饰,最终转化为岩藻黄质[37]。本研究通过ASA 处理三角褐指藻,从生长、含量以及分子方面对其进行了探究,为岩藻黄质的生产实践提供了基础。
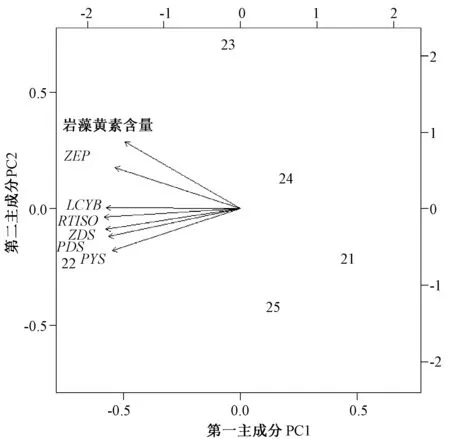
图5 岩藻黄质生物合成通路中的基因与其含量的主成分分析Fig.5 The principal component analysis between the contents of fucoxanthin and gene involved in pathway of fucoxanthin biosynthesis
4 结论
本研究探究了不同浓度ASA 诱导对三角褐指藻生长和岩藻黄质合成的影响,结果显示,ASA 处理抑制了对数期三角褐指藻的生长,但10 mg·L-1ASA 对三角褐指藻岩藻黄质合成途径相关酶基因的表达具有促进作用,且10 mg·L-1处理组三角褐指藻中岩藻黄质含量显著高于对照组,表明ASA 可能通过影响三角褐指藻岩藻黄素合成的基因的表达从而调控岩藻黄质的合成。本试验为进一步研究外源诱导子对三角褐指藻的岩藻黄质积累及分子机理奠定了一定的理论基础。
