三尖瓣隔叶下消融治疗特发性右侧His束旁室性心律失常∗
2020-07-01王新华孔令璁李峥聂鹏卜军
王新华 孔令璁 李峥 聂鹏 卜军
大多数特发性室性心律失常起源于心室流出道,导管消融疗效良好[1-2]。His束(His bundle,HB)旁室性心律失常的定义是室性早搏(简称室早)或室性心动过速(简称室速)的起源部位可以记录到HB电位或距离HB<1 cm[3],临床较少见,占所有特发性室性心律失常的3%~9%[4-5]。由于HB旁室性心律失常的起源部位非常靠近房室结和HB,因而消融并发房室传导阻滞(AVB)的风险较高、消融成功率较低[5]。
解剖学上三尖瓣隔叶(The septal leaflet of the tricuspid valve,SLTV)将右侧HB 旁区域分为SLTV 上方(A-SLTV)和SLTV 下方(U-SLTV)。早期研究中,常规采用A-SLTV 消融治疗右侧HB旁室早和室速[6-8]。最近,新型U-SLTV 消融方法被用于治疗HB旁旁路和室上性心动过速[9-10],但较少应用于治疗HB旁室早和室速。本研究旨在评价U-SLTV 消融方法较A-SLTV 方法在右侧HB旁室性心律失常消融有效性和安全性方面的优越性。
1 资料与方法
1.1研究对象 连续入选2014年6月至2018年5月期间接受导管消融的右侧HB旁室性心律失常患者30例,男性17例,女性13例,年龄(51.4±7.9)岁。根据体表心电图诊断右侧HB旁室性心律失常[3-5]。研究纳入标准:特发性、症状性、单形性室性心律失常;每日室早数占总心搏比例>10%;对至少一种抗心律失常药物无效或不能耐受。排除标准:缺血性心脏病;原发性心肌病和充血性心力衰竭;既往心脏手术;先天性心脏病。30例患者中高血压11例,2型糖尿病5例,轻度冠状动脉粥样硬化2例。2017年前采用常规的A-SLTV 方法,之后采用新型U-SLTV 方法,将入选病例分为A-SLTV 组(n=14)和U-SLTV 组(n=16)。所有患者签署书面知情同意书。
1.2心电图分析 根据每例患者的术前12导联体表心电图,分析室早/室速时的QRS波形态和胸导联移行。若下壁导联(Ⅱ、Ⅲ、a VF)均有占主导性的R 波,则计算RⅡ/RⅢ比值;若下壁>1个导联无主导性R 波,则判为下壁导联极性不一致,其定义为Ⅱ导联QRS波正向而Ⅲ导联QRS波负向[5]。统计RⅡ/RⅢ>1、下壁导联极性不一致的病例数及所占比例。
1.3电生理检查 2%利多卡因局麻下穿刺双侧股静脉和左锁骨下静脉,放置4极HB电极和10极冠状静脉窦电极。经右股静脉放置1 根Swartz鞘(SR0 型,雅 培 公 司),送 入3.5 mm ThermoCool Navistar盐水灌注导管(美国Biosense Webster公司),在CARTO 3系统(美国Biosense Webster公司)引导下进行三维重建、标测和消融。经左股静脉放置Carto Sound心内超声心动图导管(美国Biosense Webster公司),以指导消融导管放置。观察室早/室速是否自发,如无自发室早、室速,则静脉滴注异丙肾上腺素(2~5μg/min)以诱发临床型室性心律失常。
首先进行激动标测,重建三维激动图。在右室基底部前间隔区域,可以记录到“HB电位云”,其中双极电位最大的部位被标记为“HB”。测定最早激动部位的HB电位和A 波的振幅(如果存在上述两种电位的话)。若在右侧HB 旁区域未记录到明显提早的电位,则在邻近部位(低位右室流出道、主动脉窦和主动脉瓣下左侧HB 旁区)进行激动标测[11]。然后以周长550 ms、略高于舒张期夺获阈值进行起搏标测。“起搏匹配”定义为12个导联中至少有11个导联的起搏QRS波形态与临床QRS波形态相同。
1.4消融导管到位方法 在A-SLTV 组中,经Swartz鞘送入标测导管直接放置于右侧HB 旁A-SLTV 区 域(图1 A 和1B)。在U-SLTV 组 中,消融导管经Swartz鞘进一步送至右室,边顺时针旋转边打弯导管以达到U-SLTV 区域,并适当后撤导管以靠近三尖瓣环,形成所谓导管倒置的形态(图1C和1D)。为避导管到位过程中机械刺激损伤HB和右束支,导管也可预先在右心房打弯使头端形成“袢”状,接着将此“袢”推送入右室中部,然后边顺时针旋转导管边回撤导管,可使导管头端自然贴靠于U-SLTV 区域。透视下可见导管头端与导管体部不在一个平面(头端更指向室间隔)、且在导管不松弯的情况下无法撤出导管,据此判定导管位于U-SLTV 区域;必要时可通过血管内超声(ICE)影像进一步证实导管头端位于U-SLTV 区域(图1E)。
1.5射频消融 在右侧HB 旁和邻近结构进行详细激动和起搏标测后,以局部激动最提前且起搏匹配的部位为消融靶点。用CARTO 3软件测量消融靶点到HB 的距离。如果靶点距HB >5 mm,以30~35 W、盐水流速17 ml/min放电消融。如果靶点距HB<5 mm,则从20 W 开始进行能量滴定,如果没有房室传导损伤的表现,功率逐步增加到30~35 W(图2)。如果室性心律失常在放电15 s内消失,则延长放电至90~120 s,否则停止放电并重新寻找消融靶点。若出现PR 间期延长或快交界性心律时,应立即停止放电以避免房室传导阻滞的发生。若右侧HB 旁消融失败,则尝试在主动脉窦和左侧HB 旁进行标测和消融。消融即刻成功定义为最后一次消融后观察30 min,静脉滴注异丙肾上腺素(2~5μg/min)无室性心律失常复发。
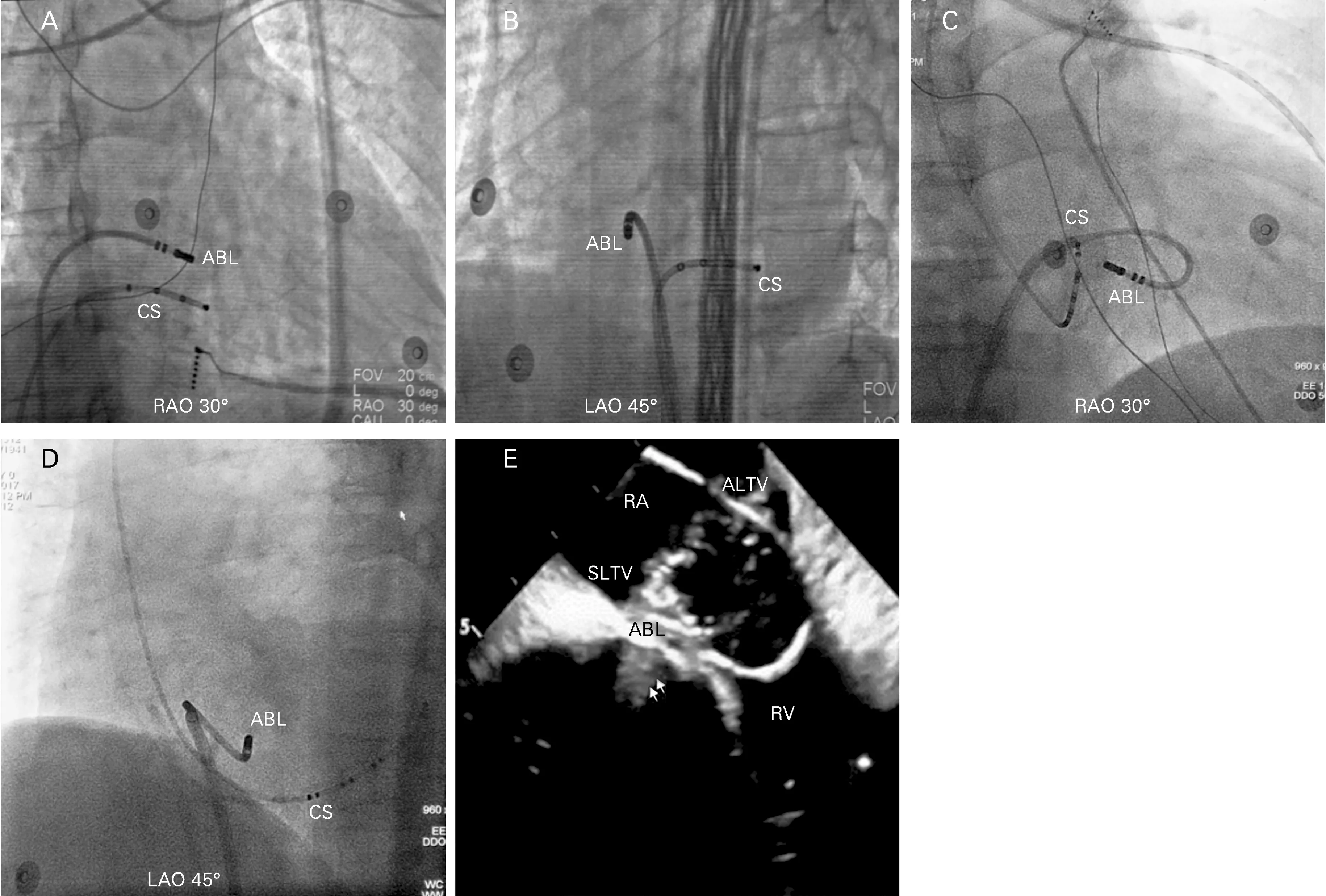
图1 两组不同消融导管到位方法的影像学表现
1.6术后随访 患者术后第2天出院,门诊定期随访1年。如果未发现复发,则停用所有抗心律失常药物。术后3、6和12个月或出现症状时进行体表心电图和24 h动态心电图检查。临床成功定义为术后随访1年,未服抗心律失常药物无HB 旁室性心律失常的复发。
1.7统计分析 采用SPSS16.0 软件进行统计分析。连续变量用均数±标准差表示,用t 检验进行组间比较;分类变量以率或构成比(%)表示,用χ2检验或Fisher′s精确检验进行组间比较。双侧检验P<0.05为差异具有显著性。
2 结果
2.1两组患者临床特征 30例右侧HB 旁室性心律失常患者的基线临床特征数据,见表1。两组患者在年龄、性别、日平均室早总数、临床合并症等方面均无显著性差异。
2.2消融结果 术中24例患者HB旁室性心律失常自发,其余6 例经静脉滴注异丙肾上腺素诱发。A-SLTV 组有2例消融部位在HB 水平以上(分别高于HB 4 mm 和5 mm),12例低于HB 或与HB齐平。U-SLTV 组1例高于HB(高于HB 6 mm),15例低于HB 或与HB 齐平。A-SLTV 组有1 例合并房性心动过速,标测发现界嵴中部的异位灶并成功消融。
电生理检查和射频消融结果见表2。两组VQRS时间(局部电图提前QRS时间)、靶点-HB 距离、放电次数、放电时间和即刻成功率均无显著性差异,但A-SLTV 组消融过程中交界性心律的比例明显高于U-SLTV 组(50%比12.5%,P=0.05)。ASLTV 组14例中有4例经右侧HB旁消融后室早短暂消失,但因有导致AVB风险而未能持久消除,尝试在主动脉窦和左侧HB 旁区消融无效;另外2例,右侧HB 旁下方可以标测到最提前激动,但左、右侧HB 旁消融均无反应。U-SLTV 组16例中有2例因AVB风险而放弃消融。

图2 A-SLTV 法(A-C)和U-SLTV 法(D-F)消融右侧HB旁室早两例

表1 患者的基线临床特征
A-SLTV 组14例中8例(57.1%)消融靶点可记录到小HB电位(振幅<0.1 m V),U-SLTV 组16例中有1例(6.3%)消融靶点可记录到小HB电位,P=0.004。A-SLTV 组消融成功部位的A 波平均振幅显著大于U-SLTV 组,P=0.05。
2.3心电图分析 右侧HB 旁室性心律失常的心电图特点为左束支阻滞形态,V1导联呈“QS”型28例,呈“rS”型2 例。QRS 波移行位于V2导联10例,位于V3导联20例。Ⅰ导联表现为单相高R 波30例;a VL导联为单相R 波25例,RR′波5例。下壁导联RⅡ/RⅢ>1 3 例,下壁导联极性不一致27例。
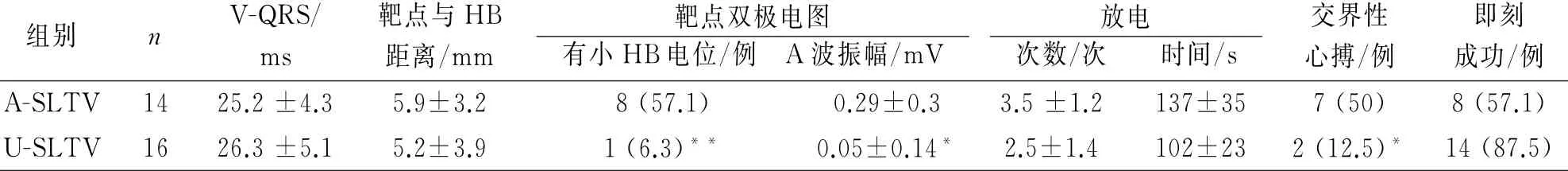
表2 电生理检查和射频消融数据
3例HB水平以上起源患者中V1导联表现为“rS”型2例,表现为“QS”型1例,但此3例下壁导联均表现为RⅡ/RⅢ>1;27例HB水平以下起源患者,心电图均表现为V1导联呈“QS”型且下壁导联极性不一致。
2.4并 发 症 A-SLTV 组 有1 例 在HB 下 方4 mm 25 W 放电时出现一过性AVB,停止放电即刻AVB完全消失。然而该患者术后1个月因完全性AVB而安置永久起搏器。
2.5随访结果 术后随访12个月,A-SLTV 组14例中5例(35.7%)取得临床成功,U-SLTV 组16例中13例(81.3%)取得临床成功,P=0.02。无其它迟发性并发症发生。
3 讨论
一项纳入105 例HB 标本的大体解剖研究发现:79%标本的HB 沿着或略远离室间隔膜部下缘走行,并有心肌覆盖;然而21%标本的HB 走行很浅且没有心肌被层覆盖(“裸HB”)[13]。另一项相关研究也发现,致密房室结远端和HB 近端没有心肌层覆盖[14]。两项研究说明HB 区域的解剖存在一定的变异性。解剖学上,SLTV 将右侧HB 旁区域分为SLTV 上方和SLTV 下方两部分,SLTV 下方区域位于房室结和HB的远端。当导管头端位于SLTV 下方时,SLTV 可防止导管与房室结和HB的直接接触。相反,当导管头端位于SLTV 上方时处于游离状态,导管可以自由移动,可能会与房室结和HB直接接触。本研究发现U-SLTV 方法消融靶点的A 波振幅明显低于A-SLTV 方法、靶点记录小HB电位的概率亦显著低于A-SLTV 方法,这可能表明导管头端位于SLTV 下方时电学上距离房室结和HB更远。
因为解剖学上右侧HB 旁区域与房室结和HB非常接近,所以此区域起源室性心律失常的消融安全性具有较大挑战。多数研究通常采用所谓“能量滴定法”来降低AVB的风险[5-10,12]:消融通常从20 W 开始,如果放电时没有发生AVB,则能量逐渐增加到30~35 W。虽然能量滴定消融可能比固定功率消融更安全,但可能会增加组织水肿的可能性,影响消融深度。本研究发现,虽然大多数病例即刻取得消融成功,但随访中出现晚期复发,能量滴定造成的组织水肿可能是室性心律失常晚期复发的原因之一。此外,SLTV 本身也可能阻碍有效损伤灶的形成:心脏舒缩时SLTV 强烈的开、合运动,导致采用A-SLTV 方法贴附于此的导管头端间歇性移位;SLTV 附近的快速血流也可带走消融热量,导致损伤深度不足。
U-SLTV 方法提高消融疗效因素包括:导管头端与心肌的良好接触和稳定的导管位置。导管头端在SLTV 下方,直接与局部心肌致病局灶接触,消融能量直接释放而不是通过纤维性SLTV 的热传递。此外,SLTV 下方空间狭小,导管一旦到位后即可产生类似“导管卡顿”的效应,使得在放电过程中均能保持非常稳定的导管位置。
U-SLTV 方法也可能有助于降低AVB 的风险。一项动物研究证实,SLTV 上方放电会造成心房侧和心室侧的损伤,导致10只实验狗中的1只出现完全性AVB。相反,SLTV 下方放电仅造成局限于心室侧的损伤,尽管10只狗中有3只出现右束支阻滞,但没有引起AVB[15]。本研究也发现,与ASLTV 方法相比,U-SLTV 方法消融靶点记录到小HB电位的概率以及放电时交界性搏动的发生率均显著降低。此外,位于STLV 下方的导管头端位置非常稳定,明显降低了放电时导管移位误伤房室结和HB的可能性。
除上述发现以外,本研究1例HB 水平以上起源的室早,其体表心电图V1导联表现为“QS”型而不是“rS”型,这似与先前的研究结果不一致[3-5]。然而,该患者中存在RⅡ/RⅢ>1的特征,表明后者可能比V1导联QRS 波形态更有助于预测室性心律失常起源部位相对于HB的高低。
本研究受限于回顾性设计,入选4 年内右侧HB旁室性心律失常消融患者30例,研究样本数比较有限;本研究根据时间顺序入组,因此不能排除研究方法上的“学习效应”。众所周知,HB 旁室性心律失常的消融极具挑战性,既往研究消融成功率不理想,具有较高的AVB风险。本文初步研究认为,传统A-SLTV 消融方法中,SLTV 可能成为阻碍消融疗效和安全性的重要因素,而新型U-SLTV 消融方法有助于克服A-SLTV 消融方法的局限性,提高疗效、改善安全性。尽管如此,仍需要进行前瞻性、多中心的随机对照研究来深入评价U-SLTV 方法在右侧HB旁室性心律失常消融中的价值。
综上所述,特发性右侧HB 旁室性心律失常具有特征性的心电图形态。与常规A-SLTV 方法相比,新型U-SLTV 方法有助于提高消融成功率,并可能改善安全性。
