实时荧光定量PCR结合探针检测MP的临床价值及MP耐药情况分析
2020-06-30杜金龙李恒涛
杜金龙, 冯 燕, 李恒涛
(1.上海市奉贤区奉城医院检验科,上海 201411;2.上海市奉贤区奉城医院儿科,上海 201411)
肺炎支原体(Mycoplasma pneumoniae,MP)感染可发生在不同年龄段儿童,据相关流行病学研究报道,MP年感染发生率为10.6%~67.6%,是儿童急性上、下呼吸道感染的病原体之一[1]。目前临床常用大环内酯类抗菌药物(如阿奇霉素)对儿童MP感染进行治疗,但临床报道MP对此类抗菌药物的耐药性呈阶梯式增高。早期准确诊断对减少抗菌药物滥用及降低患儿病死率有着重要意义[2]。目前MP感染诊断主要依靠实验室MP培养,但是MP培养不仅技术要求高、耗时长而且阳性率低,在临床早期诊断中应用受限[3]。近年来,MP核酸检测[实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)]在临床上应用的报道越来越多,而核酸扩增技术对提高病原检出率有着积极作用,但因MP-DNA序列突变所致的对大环内酯类抗菌药物的耐药现象愈发严重[4]。因此,有必要对MP耐药突变开展核酸鉴定。本研究评价实时荧光定量PCR技术结合探针检测MP-DNA及耐药突变位点的方法对MP感染诊断的准确性,并分析相关影响因素及耐药突变率,为临床早期诊断与目标用药提供参考依据。
1 材料和方法
1.1 研究对象
选取上海市奉贤区奉城医院儿科2017年9月—2019年8月收治入院的70例MP感染患儿作为MP组,选取同期入院的30例非MP感染患儿作为对照组。此次研究在上海市奉贤区奉城医院伦理委员会指导下开展,入组患儿家长均签署知情同意书。
1.2 纳入标准与排除标准
1.2.1 纳入标准 (1)MP感染儿童纳入标准。均符合《儿童肺炎支原体肺炎诊治专家共识》(2015年版)[5]中相关诊断标准;以发热、咳嗽为主要症状,且多为阵发性干咳;胸X线检查结果可见肺实质阴影、肺门淋巴结肿大或全肺野弥漫性阴影等;单份血清标本MP-IgM抗体滴度≥1∶160,或急性期及恢复期(间隔2~4周)血清标本抗体滴度呈4倍或4倍以上变化(升高或降低);未合并其他病原体感染。(2)对照组患儿纳入标准。经临床胸X线检查与症状诊断,排除MP感染的其他类型肺炎;单份血清标本抗体滴度≤1∶80;其肺炎类型均能检测出确切的病原体。
1.2.2 排除标准 (1)MP感染患儿排除标准。因反复呼吸道感染入院;合并免疫缺陷性疾病;经实验室检测合并病毒或细菌感染;结核病患儿。(2)对照组患儿排除标准。合并免疫缺陷性疾病;排除MP感染但病原体不明。
1.3 患儿治疗与基本资料采集
采集入组患儿的性别、年龄、入院时病程、入院前大环内酯类抗菌药物治疗史以及治疗4周内单份/双份血清抗体滴度等临床资料,进行定义与分组:(1)长病程组。入院时病程超过7 d患儿;(2)短病程组。入院时病程在7 d及以内患儿;(3)完成1个疗程组。入院前已接受阿奇霉素治疗,单次给药10 mg/(kg·d),首剂加倍,规律服药>3 d,末次服药距首次服药时间满5 d,或连续服用其他大环内酯类抗菌药物(如红霉素)推荐剂量满5 d患儿;(4)未完成1个疗程组。口服阿奇霉素或其他大环内酯类抗菌药物不足1个疗程患儿;(5)未服用组。未服用大环内酯类抗菌药物治疗患儿;(6)双份血清4倍变化组。治疗期间急性期及恢复期血清抗体滴度呈4倍或4倍以上变化(增高或降低)患儿;(7)单份血清变化组。治疗期间单份血清标本抗体滴度≥1∶160,未出现双份血清滴度变化患儿。
1.4 方法
1.4.1 MP核酸检测 采集患儿入院12 h内咽拭子标本,置于无菌玻璃管,采用0.9%氯化钠溶液进行样本处理,保存于-20 ℃待测。采用MP核酸及耐药突变位点检测试剂盒(实时荧光定量PCR)(杭州美联生物科技有限公司)进行MP基因组DNA提取与检测。采用ABI 7500实时荧光定量PCR仪(美国ABI公司)进行扩增,扩增条件:50℃ 2 min,95 ℃ 2 min;91℃15 s,64℃ l min,40个循环。MP核酸及耐药突变位点检测试剂盒采用VIC、FAM与CY5这3种荧光进行实验,其中VIC信号指示MP,FAM信号指示23SrRNA2063位点或2064位点A:G突变,CY5信号指示内标。当待测样本FAM信号循环阈值(cycle threshold,Ct)<35.33、VIC信号Ct<35.01时指示MP检测阳性且发生A2063G和/或A2064G耐药突变;当待测样本FAM信号Ct≥35.33、VIC信号Ct<35.01时指示MP检测阳性但未发生A2063G或A2064G耐药突变;当待检测样本VIC信号Ct>35.01时判定为阴性。
1.4.2 MP-IgM抗体检测 抽取患者静脉血2 mL并分离血清,使用人肺炎支原体抗体IgM(MPIgM)酶联免疫吸附试验检测试剂盒[艾柏森(北京)生物科技有限公司]进行MP-IgM抗体检测,检测过程严格按照试剂盒检测说明书进行。
1.5 统计学方法
采用SPSS 18.0软件对数据进行统计分析,其中计数资料以[例(百分比)]表示,组间阳性率比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患儿基本资料
根据本研究纳入标准,MP组患儿共70例,其中男38例 (54.3%)、女32例(45.7%),年龄0.5~17.2岁,中位年龄7.4岁,平均病程9.4 d。MP组患儿中长病程患儿38例,短病程组32例;完成1个疗程患儿28例 ,未完成1个疗程患儿29例,未服用患儿13例;单份血清变化患儿45例,双份血清4倍变化患儿25例。对照组(非MP感染)患儿共30例,其中10例为细菌性肺炎,12例为病毒性肺炎,8例为肺结核。
2.2 实时荧光定量PCR结合荧光探针诊断MP的准确性及其影响因素分析
70例MP感染患儿中MP-DNA阳性56例,阳性率为80.0%。患儿性别、病程、大环内酯类抗菌药物治疗史对检出率均无明显影响(χ2=0.001、0.705、1.103,P>0.05);双份血清4倍变化组MP-DNA阳性检出率(92.0%)明显高于单份血清变化组MP-DNA阳性检出率(71.1%),组间比较差异有统计学意义(χ2=4.165,P<0.05)。见表1。
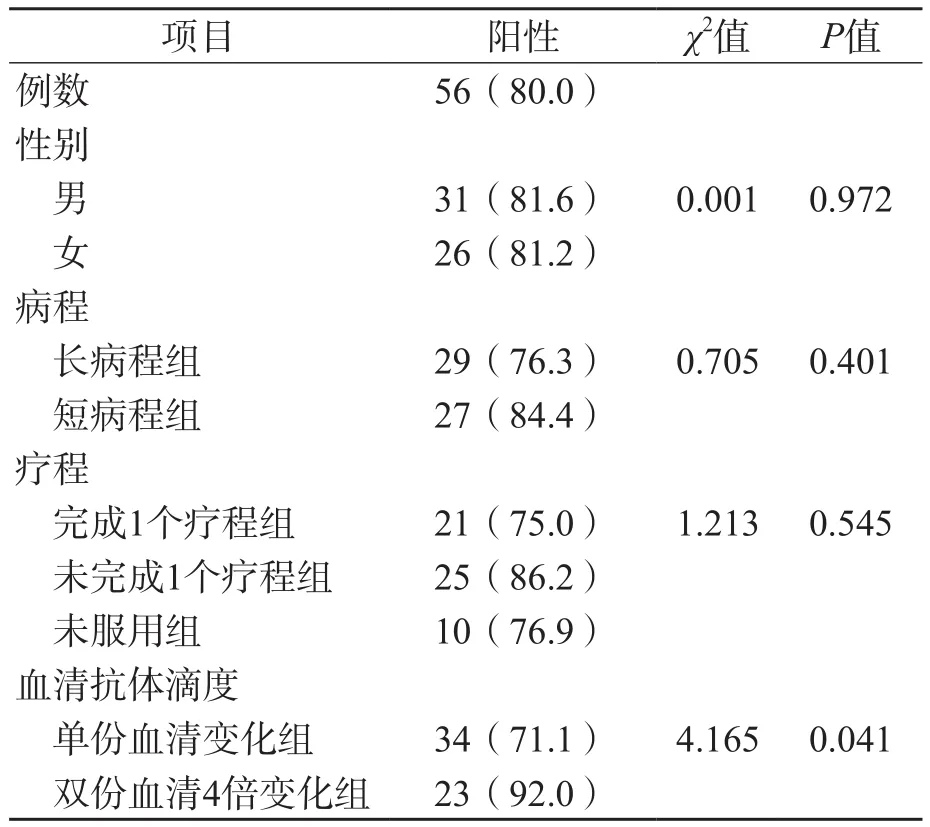
表1 MP感染患儿MP-DNA阳性检出率比较例(%)
2.3 56例MP-DNA阳性患者耐药突变分析
56例MP-DNA阳性患儿中有48例检测出耐药突变,其MP耐药突变阳性率高达85.7%;不同性别之间的MP耐药突变阳性率差异无统计学意义(χ2=2.550,P=0.110);完成1个疗程组、未完成 1个疗程组及未服用组的MP耐药突变率分别为90.5%(19/21)、80.0%(20/25)及50.0%(5/10),3个组比较差异有统计学意义(χ2=6.646,P=0.036)。见表2。
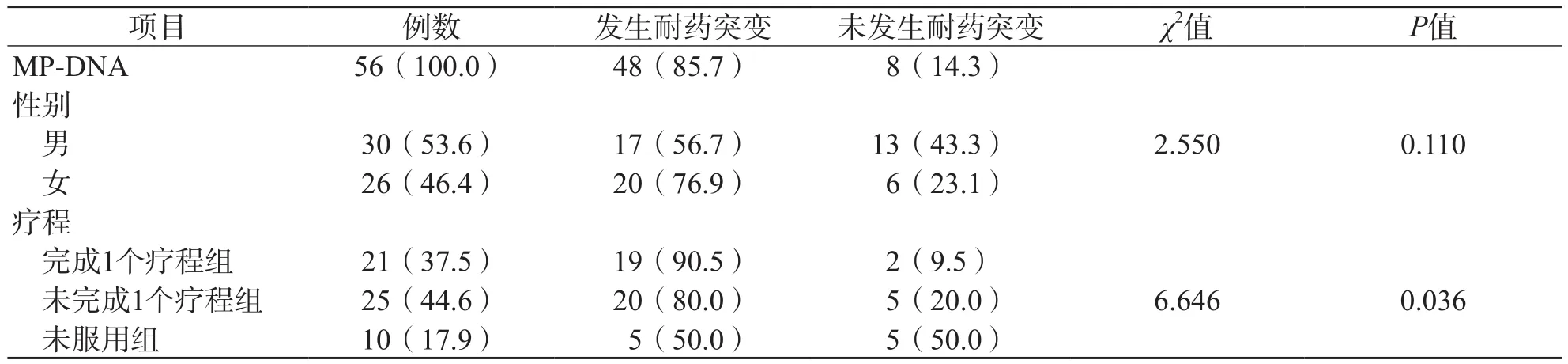
表2 56例MP-DNA阳性患者耐药突变分析 例(%)
3 讨论
MP是引起儿童呼吸道感染的主要病原体之一。近3年来,上海市奉贤区奉城医院接诊的MP感染患儿数量呈上升趋势,且发现MP对大环内酯类抗菌药物的耐药率由2008年的3.2%增至2018年的30.5%。2016年冯真英等[6]和2018年倪珊珊等[7]先后报道培养分离到对大环内酯类抗菌药物耐药的MP,且其耐药率远高于以往文献报道。早期、准确地诊断是否有MP感染及耐药情况对避免抗菌药物滥用、提高临床疗效和促进患儿预后意义重大。
MP培养是目前公认的诊断MP感染的金标准,但由于实验室培养敏感性、特异性差,且所需时间较长,故不适用于早期诊断[8]。核酸检测因具有诊断准确性高、检测步骤简单、耗时短等优点已被广泛应用于临床[9-10]。本研究采用实时荧光定量PCR结合探针检测的方法对MP患儿进行诊断,其结果显示,PCR结合探针诊断MP感染的阳性率为80.0%(56/70),相比于其他MP核酸检测方法,PCR扩增结合探针显示出相近或更高的诊断准确性。冯雪莉等[11]探讨恒温扩增检测MP-RNA在儿童MP感染中的诊断价值,结果其敏感性达75.0%,特异性达89.7%。顾文婧等[9]采集MP感染患儿鼻咽抽吸物进行MP-DNA检测,发现病程≤1周患儿检出率为69.0%。虽然MP-DNA检测的诊断准确性较高,但应考虑到在病原微生物死亡后DNA还可以在体内存留一定时间,此时MP-DNA检测结果阳性并不代表病原体处于存活状态,因而在对患儿进行诊断与用药时,临床医生还应根据临床症状来进行综合性判断[12]。
本研究还对PCR结合探针诊断准确性的影响因素进行了分析,发现有81.4%(57/70)的患儿入院前已在其他医疗机构接受大环内酯类抗菌药物治疗。有研究报道患儿发病初期MP-DNA的阳性率较高,提示MP在机体内有感染与复制[13]。本研究中完成1个疗程组、未完成1个疗程组及未服用组的MP-DNA阳性检出率差异无统计学意义(χ2=1.213,P=0.545)。入院前使用大环内酯类抗菌药物进行治疗的患儿,入院时的MP-DNA阳性检出率未见有效降低,这也有可能是我们接诊的MP肺炎患儿携带的MP耐药菌株比例较高。
目前对MP的诊断主要依赖于血清学抗体检测,具有敏感性高、特异性强的特点,但耗时长、价格昂贵、对技术人员要求高,制约了其在临床中的普及。患儿MP感染后,机体内最早产生的抗体即为MP-IgM抗体,然而其形成尚需一段时间,一般在感染后7~10 d可被检测到,3~4周达高峰,并可持续数月,采集急性期与恢复期双份血清标本进行MP-IgM抗体检测对临床诊断具有参考价值。双份血清MP-IgM抗体滴度呈4倍或4倍以上升高或降低对MP感染的早期诊断有意义。在本研究中,双份血清4倍变化组MP-DNA阳性检出率(92.0%)明显高于单份血清变化组(71.1%),组间比较差异有统计学意义(χ2=4.165,P=0.041)。此外,顾文婧等[9]也报道,实时荧光定量PCR对MP-DNA的阳性检出率与双份血清抗体滴度呈4倍变化的一致性较高,提示临床诊断MP肺炎时以双份血清抗体滴度呈4倍或4倍以上升高或降低作为诊断标准,可获得更高的诊断准确率。
近年来,国内外均有文献报道分离出对大环内酯类抗菌药物耐药的菌株。根据目前对MP耐药机制的研究发现[14],其主要机制是抗菌药物作用靶位基因的点突变,主要为核糖体的23SrRNA V区中心环的点突变,而MP在23SrRNA基因的A2063G与A2064G碱基突变通过使大环内酯与MP核糖体亲和力降低而产生耐药。本研究结果显示,56例MP-DNA阳性患儿中有48例检测出A2063G和/或A2064G突变,其中检测出单纯A2063G突变65例、单纯A2064G突变68例、A2063G联合A2064G突变35例,其MP耐药突变阳性率高达85.7%,另规律完成大环内酯类治疗1个疗程组的MP耐药突变率为90.5%,明显高于未完成1个疗程组(80.0%)及未服用组(50.0%),3个组比较差异有统计学意义(χ2=6.646,P=0.036)。该结果提示,MP肺炎对大环内酯类抗菌药物具有严重的耐药性,其耐药机制主要是23SrRNA基因位点突变,也进一步证实了MP肺炎患儿对大环内酯类抗菌药物的耐药形势相当严峻,提示MP核酸检测可为临床用药调整提供依据,具有较为广阔的临床应用价值。
综上所述,应用实时荧光定量PCR结合探针对MP肺炎进行诊断,其敏感性和特异性均较高,从本研究结果来看,MP-DNA耐药突变率较高,临床对MP患儿的治疗用药应根据耐药性予以调整。
