西兰花叶中生物活性成分的测定
2020-06-30赵登奇孙亚天黄建颖宋亦超
赵登奇 孙亚天 黄建颖 宋亦超
(浙江工商大学食品与生物工程学院/浙江省食品安全重点实验室,浙江 杭州 310018)
西兰花(Brassica oleraceaL.var.italicPlanch.),又名青花菜、花椰菜、意大利芥蓝等,为两年生十字花科(Brassicaceae)草本植物。 西兰花中生物活性成分含量丰富[1-2],种类繁多,营养价值极佳[3-4],对癌症以及一些慢性疾病的预防和治疗具有一定的作用[5-7],深受消费者青睐,已成为日常饮食以及医药产品生产中的常见原料之一[8-9],其需求量呈不断上升的趋势[10]。 然而在西兰花相关产品的开发生产过程中,由于观念不一致、产地设备条件和规则制度不完善等,造成西兰花茎叶等大量废弃物的产生[11],这些废弃物除小部分被用于生产动物饲料和提取萝卜硫苷外[12],大部分都未得到应有的开发利用,不仅造成了巨大的经济损失,而且也引发相应的环境问题。
研究表明,西兰花茎叶废弃物与其可食用部分相比,同样含有丰富的营养物质和生物活性成分[13-14]。Jo 等[15]在西兰花小花和花梗中发现了大量植物活性物质;Liang 等[16]研究发现西兰花种子中含有大量萝卜硫素;Mihailovic 等[17]发现十字花科植物的根、茎、梗、叶柄和叶子中含有丰富的多酚,其中地上部分多酚含量达到59.42 mg·g-1DW,Domínguez-Perles 等[18]也得到类似的结果;Ferreira 等[19]研究发现西兰花叶中含有丰富的蛋白质。 若能将西兰花废弃物中的营养物质和潜在的功能性成分研制成具有附加价值的产品,既能实现资源的再利用,又可以减缓废弃物造成的众多负面影响。 目前,关于西兰花中活性成分的研究大多集中于其可食用部分,近几年对西兰花副产品的研究才逐渐深入,此外,对于西兰花叶中生物活性成分的研究大多只针对某一种,同时进行多种生物活性成分的研究尚鲜见。 本试验分别采取酶法、福林酚法、比色法、三氯乙酸/丙酮沉淀法等方法对西兰花叶中的4 种生物活性成分的组成和含量进行测定与分析,并选取尽可能接近田间废弃的西兰花叶,以期为西兰花叶进一步的开发利用提供一定的数据支持和参考。
1 材料与方法
1.1 材料与试剂
西兰花叶于9-10 月份在杭州勾庄蔬菜批发市场获得,所选西兰花叶大小均匀、颜色略发黄、叶片基本完整、无明显病斑。
萝卜硫素标品(纯度>95%),上海百灵威化学试剂有限公司;没食子酸(纯度>99%),β-巯基乙醇、福林酚均为分析纯,上海麦克林生化科技有限公司;石油醚、乙酸乙酯、三氯乙酸、丙酮,均为分析纯,上海国药集团化学试剂有限公司;牛血清白蛋白标品(纯度>99%)、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVPP)、三羟甲基氨基甲烷(trishydroxymethyl aminomethane,Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)均为分析纯,上海阿拉丁化学试剂有限公司;槲皮素(纯度>99%),上海麦克林生化科技有限公司。
1.2 仪器与设备
1100 液相色谱仪、Waters T3 色谱柱,美国沃特世公司;UV-2550 紫外-可见分光光度计,日本岛津公司;2-16KL 高速冷冻离心机,德国西格玛公司;Mini-PROTEIN Tetra System 电泳仪,美国Bio-Rad 公司;Labconco 立式冷冻干燥机,美国LABCONCO 公司;90-1 型恒温磁力搅拌器,上海科精实业有限公司;PHS-3C 型pH 计,上海仪电仪器有限公司;QL-861 漩涡震荡仪,海门其林贝尔仪器有限公司;KQ5200LH 超声波清洗器,昆山市超声仪器有限公司;XL-60C 中药粉碎机,杭州旭众机械设备有限公司。
1.3 试验方法
1.3.1 萝卜硫素提取及测定 参考Liang 等[16]和Campas-Baypoli 等[20]的方法并稍作修改。 西兰花叶于冷冻干燥机中-50℃冻干24 h,之后使用中药粉碎机打碎至粉末状(粒径为50 ~150 μm)。 称取冻干粉100.0 mg,加10.0 mL 石油醚脱脂过夜,用布氏漏斗真空抽滤得到滤饼,移入离心管中,加入5.0 mL 0.2 mol·L-1的磷酸盐缓冲溶液(pH 值6.0),塞好管塞,混合均匀后于45℃水浴2 h,待冷却至室温再向离心管加入20.0 mL 乙酸乙酯,于磁力搅拌器上2 000 r·min-1搅拌15 min,之后加入1.0 g 氯化钠促进两相分层,移取上层乙酸乙酯相于锥形瓶中;剩余组分继续用乙酸乙酯萃取2 次,随后合并乙酸乙酯相,加入适量的无水硫酸钠除去残留水分。 于35℃旋蒸去除乙酸乙酯,剩余物用1.5 mL 甲醇重新溶解,过0.22 μm 有机滤膜,待高效液相色谱法( high performance liquid chromatography,HPLC)分析。
HPLC 条件:waters T3 色谱柱(3 μm,3.0 mm×150 mm);紫外检测器,检测波长241 nm;柱温30℃;进样量5 μL;流速0.4 mL·min-1;流动相A:超纯水,流动相B:甲醇。 洗脱梯度:初始流动相10%甲醇,35 min 内线性变化至90%甲醇,35~45 min 甲醇保持90%。
1.3.2 总酚含量测定 参考Pajak 等[21]的方法,称取0.25 g 西兰花叶冻干粉于离心管中,加入5.0 mL 无水甲醇,以2 000 r·min-1磁力搅拌30 min,随后10 000×g、4℃离心20 min,收集上清液。 残余物再用5.0 mL无水甲醇重复提取2 次,合并上清液于4℃冰箱保存待测。
移取1.0 mL 提取液于10 mL 容量瓶中,加入1.0 mL 福林酚试剂和2.0 mL 15%碳酸钠溶液,加蒸馏水稀释至刻度,室温静置1 h,于760 nm 波长处测定吸光值,通过没食子酸标准曲线计算总酚含量,结果表示为mg·g-1DW。
1.3.3 总黄酮含量的测定 参照Guajardo-Flores等[22]的方法并稍作修改。 准确称取0.5 g 西兰花叶冻干粉,加入10 mL 60%乙醇溶液,以2 000 r·min-1磁力搅拌1 h,再经超声(70℃,100 W)提取1 h,5 000×g离心15 min,取上清液,残余物重复提取1 次,合并上清液待测。
移取0.6 mL 提取液于25 mL 容量瓶中,加入0.5 mL 5% 亚硝酸钠溶液,反应6 min 后加入0.5 mL 10%硝酸铝溶液,反应6 min 后加入4.0 mL 4% 氢氧化钠溶液,最后加入60%乙醇定容至刻度线。 室温静置15 min,于357 nm 波长处测定吸光值。 根据槲皮素标准曲线计算总黄酮含量,结果表示为mg·g-1DW。
1.3.4 蛋白质成分分析
1.3.4.1 总蛋白质提取 参照Xu 等[23]和Tenorio等[24]的方法,采用三氯乙酸/丙酮沉淀法提取总蛋白质。 准确称取0.4 g 西兰花叶冻干粉末于研钵中,加入0.2 g PVPP,再加入15.0 mL -20℃预冷的三氯乙酸/丙酮溶液(10%,v:v),冰浴研磨10 min,随后转移至50 mL 离心管,-20℃冰箱中静置过夜。 将混合物于10 000×g、4℃离心20 min,取沉淀用预冷丙酮(含0.07%β-巯基乙醇)洗涤1 ~2 次,将所得沉淀物在-50℃条件下冷冻干燥24 h,于-80℃超低温冰箱保存备用;将蛋白质冻干粉加入5.0 mL 蛋白溶解液{(7 mol·L-1尿素,2 mol·L-1硫脲,2% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐[(3-(3-cholamidopropyl)dimethylammonio ) propanesulfonate, CHAPS ), 40 mmol·L-1二硫苏糖醇( dithiothreitol, DTT), 5 mmol·L-1EDTA-Na2, 1 mmol·L-1苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)}复溶,振荡让其充分分散,于30℃水浴超声1 h(功率700 W),然后12 000 r·min-1离心20 min,取上清液,采用Bradford 法进行定量测定。
1.3.4.2 Bradford 法测定蛋白质含量 标准蛋白溶液的配制:准确称取10.0 mg 牛血清白蛋白以蒸馏水溶解并定容,得到浓度为100.0 μg·mL-1的标准溶液。
西兰花叶蛋白提取液蛋白质含量测定:移取1.0 mL 样品提取液,加入5.0 mL 考马斯亮蓝G-250 溶液(适当稀释),涡旋混匀,静置10 min 后于590 nm 波长处测定吸光值。
1.3.4.3 SDS-PAGE 电泳分析 采用5%浓缩胶、12%分离胶、电极缓冲液为Tris-甘氨酸(pH 值8.3)系统。 样品溶液按1 ∶1 比例与上样缓冲液混合,振荡混匀后加热,离心后取上清上样进行电泳[25]。
1.4 数据处理与分析
试验均进行3 次平行测定,数据采用Excel 2016统计分析,Origin 8.0 软件作图。
2 结果与分析
2.1 萝卜硫素含量分析
由图1 可知,萝卜硫素色谱分离效果较好,其出峰时间均为13.383 min。 以萝卜硫素标准溶液的浓度为横坐标,液相色谱峰峰面积为纵坐标绘制标准曲线,其线性回归方程为y=737.9x-12.996,R2=0.999 6,表明在此浓度范围内该方法测定萝卜硫素含量可以呈现良好的线性关系。 根据标准曲线计算得西兰花叶冻干样品中萝卜硫素转化提取量为92.5 μg·g-1DW。

图1 萝卜硫素液相色谱图Fig.1 HPLC chromatograph and the standard curve of sulforaphane
2.2 总酚含量分析
将提取得到的总酚样品和没食子酸标准溶液与福林酚试剂混合反应后,在200 ~800 nm 波长范围内进行紫外扫描。 由图2 可知,此方法在760 nm 波长处有最大吸收峰,因此选择760 nm 作为其测定波长。 吸光值关于没食子酸浓度的线性回归方程为y=112.62x-0.022,R2=0.999 5,表明此方法测定结果在该浓度范围内呈现良好的线性关系。 根据标准曲线计算总酚含量,冻干样品中总酚含量为3.15 mg·g-1DW。
2.3 总黄酮含量分析

图2 福林酚法测定总酚含量紫外-可见光谱Fig.2 UV/VIS spectra of total phenolic content measured by the Folin-Ciocalteu method
将提取得到的总黄酮样品及槲皮素标准溶液系列与各试剂依次反应后,在300 ~600 nm 波长范围内进行光谱扫描,结果如图3 所示,在357 nm 波长处出现最大吸收峰,因此选择357 nm 作为测定波长。 吸光值关于槲皮素浓度的线性回归方程为y=0.015 6x+0.676 6,R2=0.999 7,表明在此浓度范围内该方法的测定结果呈现良好的线性关系。 根据标准曲线计算得到冻干样品中总黄酮含量为2.48 mg·g-1DW。

图3 硝酸铝法测定总黄酮含量紫外-可见光谱图Fig.3 UV/VIS spectra of total flavonoid content measured by the Al (NO3)3 method
2.4 蛋白质成分分析
2.4.1 Bradford 法测定蛋白含量结果 将西兰花叶蛋白样品及牛血清白蛋白标准溶液系列与考马斯亮蓝试剂混合反应后,在200 ~800 nm 波长范围内进行光谱扫描。 由图4 可知,在590 nm 波长处有最大吸收峰,因此选择590 nm 作为测定波长。 吸光值关于蛋白质浓度的线性回归方程为y=0.005 9x+0.053 7,R2=0.998 5,表明在此浓度范围内该方法的测定结果呈良好的线性关系。 根据标准曲线计算得到西兰花叶中总蛋白含量为89.375 mg·g-1DW。
2.4.2 SDS-PAGE 电泳结果 由图5 可知,西兰花叶蛋白提取样品中条带众多,但浓度最大的为核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)的大、小亚基(箭头标注条带,分别为53 kDa 和14 kDa)。 表明西兰花叶在提取Rubisco 蛋白质方面具有巨大的潜力,若能采取适当的方法加以利用,既能充分利用资源又能带来可观的经济效益。

图4 Bradford 法测定蛋白紫外-可见光谱Fig.4 UV/VIS spectra of proteins measured by Bradford method
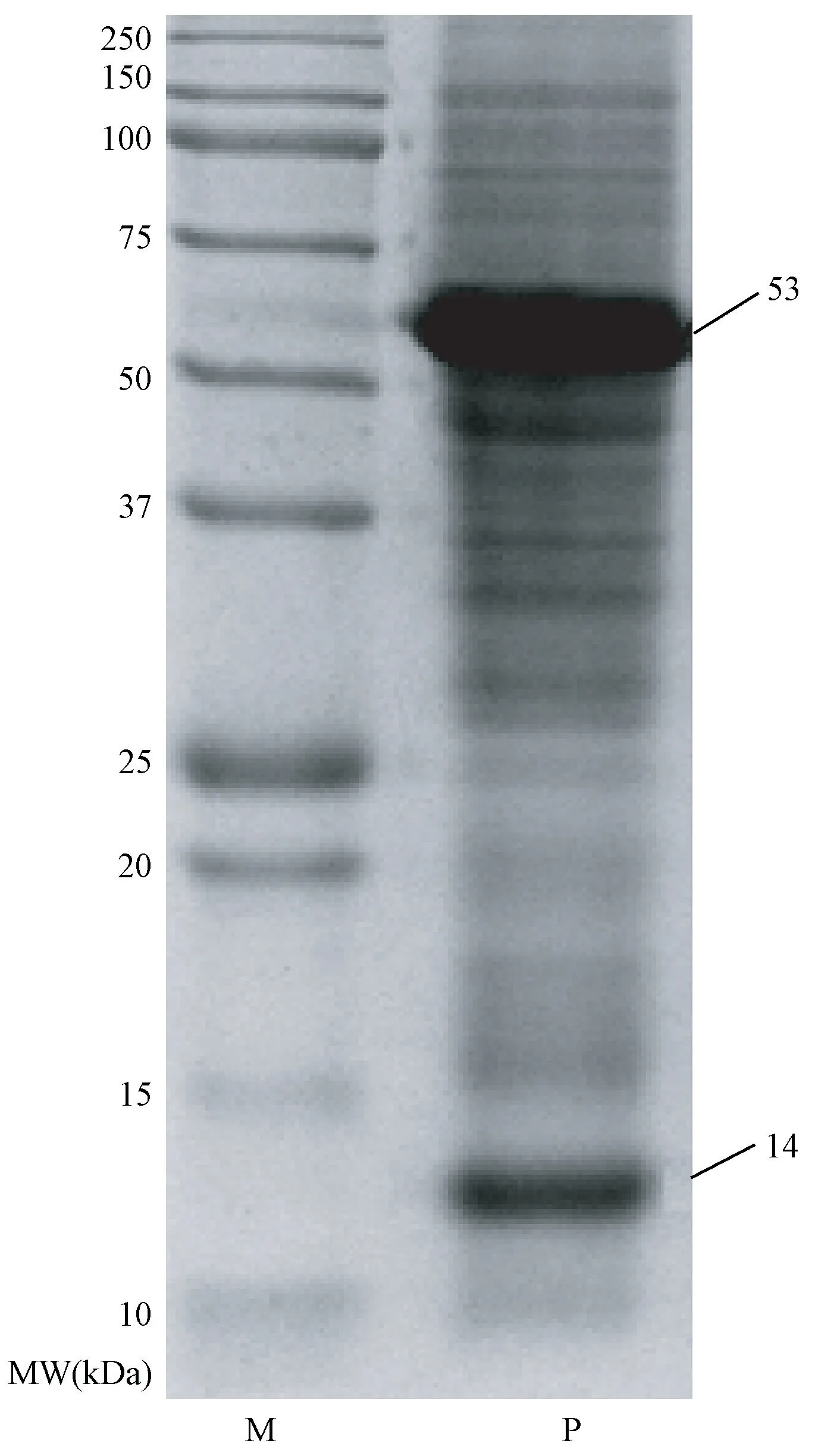
图5 西兰花叶SDS-PAGE 结果Fig.5 Result of SDS-PAGE analysis of broccoli leaves
3 讨论
西兰花和羽衣甘蓝均为甘蓝种(B. oleracea),但甘蓝叶为可食用部分,而西兰花叶却很少被食用。 通常西兰花被食用的部分不到农作物整体的50%,其余皆为西兰花废弃物(茎、花序和叶子等部分)。 事实上这些废弃物同样是营养物质的来源,均可以创造经济价值[26]。
本研究从西兰花叶中提取萝卜硫素采用的是酶法,与Bertelli 等[27]采用的溶剂萃取方法和季宇彬等[28]提及的化学合成方法相比,更利于工厂的大规模生产。 本研究结果表明,西兰花叶中萝卜硫素含量为92.50 μg·g-1DW,而Liang 等[16]研究发现,西兰花种子中萝卜硫素含量为3 200.00 μg·g-1DW;Matusheski等[29]从西兰花种子中制得萝卜硫素产量可达到4 000.00 μg·g-1DW; Campas-Baypoli 等[20]研究发现,西兰花花茎中萝卜硫素含量为97.00 μg·g-1DW,花序中最高为378.00 μg·g-1DW,说明西兰花其他部位中萝卜硫素含量普遍高于西兰花叶中萝卜硫素的含量,特别是西兰花种子。 另外,Campas-Baypoli 等[20]研究发现, 西兰花叶中萝卜硫素含量仅为 39.00 μg·g-1DW,低于本研究所测结果,这可能与西兰花产地、品种、栽培地气候等多种因素有关。 尽管西兰花叶中萝卜硫素含量低于其他部位,但西兰花叶子占据西兰花全部副产物的大部分,若合理利用也可创造出一定的经济价值。
本研究表明,西兰花叶中总酚和总黄酮的含量分别为3.15 和2.48 mg·g-1DW,这与Liu 等[30]、Thomas等[31]和Bhandari 等[32]的研究中得到的结果相差不大:Liu 等[30]对比了西兰花不同部位中总酚含量的差异, 发现西兰花叶中总酚含量最高( 4.14 mg·g-1DW),是花序总酚含量(2.51 mg·g-1DW)的1.6 倍,是花茎总酚含量(1.41 mg·g-1DW)的2.9 倍;Bhandari 等[32]研究发现,西兰花茎中总酚含量介于1.42~4.01 mg·g-1DW 之间,说明西兰花叶中总酚含量相对其他部位来说处于较高水平,因此有必要合理利用西兰花叶来提取总酚,这样不仅可以防止西兰花叶的浪费而且还能带来经济效益。 黄酮类化合物作为酚类物质中的一种,具有良好的抗氧化作用,Thomas等[31]研究发现西兰花加工业废弃物混合物中总黄酮含量为4.30 mg·g-1DW,而西兰花茎中总黄酮含量为2.40 mg·g-1DW,一般来讲,西兰花废弃物以叶、茎和花序为主要部分,结合本试验结果认为西兰花叶也可用来提取黄酮类物质。 因此,西兰花叶可作为总酚和总黄酮物质的丰富来源,以实现西兰花叶最大价值的利用。
总蛋白质的提取方法是三氯乙酸/丙酮沉淀法,采用Bradford 法测定蛋白质含量然后进行SDS-PAGE电泳分析,操作简单,能有效去除西兰花组织中的其他干扰物质。 本研究结果表明,西兰花叶中总蛋白含量为89.38 mg·g-1DW,SDS -PAGE 分析结果显示Rubisco 占比最大。 Ferreira 等[19]研究发现西兰花中含有大量的蛋白质,其中西兰花花茎中蛋白含量为92.00 mg·g-1DW,叶子(和花序)中则达到159.00 mg·g-1DW。植物叶蛋白作为一种功能性蛋白质,其营养价值极高,可能会成为食品产业新的蛋白质来源[33],同时众多研究显示Rubisco 具有良好的应用前景[34-35],因此西兰花叶是一种有较大潜力的植物蛋白源。 综上,西兰花叶中活性物质含量较为丰富,营养价值高,如果对其功能性成分采取适当的方法提取并工业化生产,将会产生非常高的经济价值。
4 结论
本研究着重进行了西兰花叶中4 种生物活性成分分析和含量测定,结果表明,西兰花叶是萝卜硫素、酚类、黄酮类物质和蛋白质的优秀来源,合理利用能带来较高的经济效益,为进一步开发利用西兰花叶提供了一定的数据参考。 本研究对西兰花叶中生物活性成分的研究存在局限,后续可利用多种方法对西兰花生物活性成分进行检测分析,进一步对其他营养物质进行研究,全面揭示西兰花废弃物的利用价值。
