丁香精油对甜樱桃采后优势致腐真菌的控制及其抑菌机理
2020-06-30贾晓曼
王 丹 张 静 贾晓曼 翟 浩
(山东省果树研究所,山东 泰安 271000)
甜樱桃(Prunus aviumL.)又名大樱桃,蔷薇科李属(Prunus salicina),于19 世纪70 年代在中国开始栽培,目前是中国北方地区露地栽培最早成熟的落叶果树[1]。 甜樱桃果大味美,具有较高的营养价值,已成为中国消费增长最快的水果之一[2]。 但甜樱桃皮薄、柔软、多汁,易受机械损伤,加之其采收多在高温高湿季节,致使采前及贮运过程中潜伏的微生物繁殖速率加快,易导致果实腐烂变质,失去商品价值[3-4]。 据报道,每年因病原真菌引起的甜樱桃采后腐烂损耗在25%以上[5]。 因此,对甜樱桃果实采后主要真菌致病菌的分离鉴定,是选择采后防腐保鲜方法的前提,明确甜樱桃采后病害种类和发生规律,对于制定有效的防治措施尤为重要。
目前,化学药剂防治仍然是降低果蔬采后病害的主要措施,但致病菌的耐药性不断增加,且易引发安全问题,因此研究人员将致病菌的防治转向来源广泛的植物源抑菌剂[6-7]。 植物精油(plant essential oil)是从植物中提取的含萜烯类、醛类、酯类、醇类等芳香化学成分的混合物,作用方式主要有熏蒸、喷施、浸泡[8-9]。研究表明,植物精油不仅具有较强的抑菌活性,而且其抑菌机制呈多靶点效应,因此,植物精油较化学杀菌剂更为安全高效,不易产生抗性[10]。 近年来,植物精油及其主要功能成分对果蔬采后病原菌的抑制作用在国内外已有诸多报道,证明其能显著降低采后病害的发生[11-13]。 丁香精油提取自植物丁香(Syzygium aromaticumL.)的叶子或花苞,具有抗菌和抗氧化作用,特别是对食源性细菌如金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、单增李斯特菌(Listeria monocytogenes)[14]和真菌如灰葡萄孢 菌(Botrytis cinerea)、扩展青霉(Penicillium expansum)、黑曲霉(Aspergillus niger)[15]等抑制效果显著。 此外,植物精油还具有一定的抗自由基及金属螯合作用,其主要作用组分为丁香酚(4-烯丙基-2-甲氧基苯酚)和一些其他酚类化合物[14]。
国内外报道的从采后甜樱桃果实分离到的主要真菌病原体有核盘菌(Sclerotinia sclertiorum)、链格孢菌(Alternaria alternata)、 螺旋聚孢霉(Clonostachyssp.)和毛霉菌(Mucorsp.)[10,16]。 关于植物精油作用于樱桃采后病原菌的报道不多,且缺乏较系统的深入研究。 本研究从山东泰安地区主栽品种红灯甜樱桃中分离优势致病菌,采用传统形态学鉴定方法并结合ITS 序列分析对病原菌进行鉴定;选用丁香精油对主要致腐菌的抑制作用及抑菌机理进行深入探讨,以期为甜樱桃采后病害的绿色防控提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试甜樱桃为山东泰安地区主栽品种红灯,于2017年5月22日采摘。 挑选无机械损伤、无腐烂且成熟度一致(八到九成熟)的果实,室温放置,待发病后分离病原菌进行后续试验。 丁香精油提取自丁香花苞,购自广州恒信香料有限公司。
1.2 主要仪器与设备
SPX- 320 生化培养箱, 宁波江南仪器厂;GR110DR 全自动高压灭菌锅,美国ZEALWAY 公司;PowerPac Basic 电泳仪、S1000 PCR 仪,美国BioRad 公司;3730XL全自动 DNA测序仪,美国 Applied Biosystems 公司;ChamlGel 6000 全自动凝胶成像分析系统,美国SAGE CREATION 公司;UV/Vis 分光光度计,日本岛津公司;SU8020 扫描电镜,日本日立公司。
1.3 试验方法
1.3.1 优势病原真菌的分离纯化 参照《植病研究方法》[17],采集自然发病果实上病健交界处约2 mm组织,用75%医用酒精表面消毒30 s,然后用无菌水冲洗孢子接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,26℃恒温培养,继续纯化至连续3 次纯化过程均无其他菌落出现。
1.3.2 形态鉴定 将纯化菌株接种于PDA 培养基,26℃恒温箱培养,光学显微镜下观察菌落颜色、形状及菌丝疏密性。 培养5 ~7 d,待产孢后观察并记录孢子形态和结构,并测量孢子大小。
1.3.3 ITS 序列鉴定 采用CTAB 法提取菌株DNA,应用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCG G-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对病原菌进行PCR 扩增。 扩增程序:94℃预变性5 min;94℃变性40 s,58℃退火40 s,72℃延伸1 min,35 个循环;72℃终延伸10 min。
PCR 产物经琼脂糖凝胶电泳检测后,由铂尚生物技术(上海)有限公司进行测序,测序结果在NCBI 数据库中进行BLAST 比对分析,搜索同源性较高的已知序列,用DNAMAN 软件对已知序列计算相似性;利用MEGA 5.2 软件以邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 丁香精油体外抑菌试验 熏蒸试验:将培养7 d 的直径7 mm 的菌饼接种于玻璃培养皿(直径75 mm×高度20 mm,加入12.5 mL PDA 培养基后,可提供37.5 mL 空间),取灭菌的滤纸片(直径30 mm)贴附于盖子内表面中心,将不同量的丁香精油(1.5 ~4.5 μL/皿)滴加于滤纸片,快速盖上盖子,精油的最终浓度分别为40、60、80、100、120 μL·L-1。 对照组除不加精油外,其他处理均一致。 所有平板于26℃条件下倒置培养4 d。
接触试验:使用10 mL 0.2%吐温80 分散适量的精油,在PDA 培养基倒入培养皿之前,迅速加入到50 mL PDA 中,使其最终体积为15 mL/皿,4 个重复,设置精油的最终浓度分别为200、400、600、800 μL·L-1。对照组用同样量的吐温80 与PDA 混合,不加精油。将培养7 d、直径7 mm 的菌饼接种于玻璃培养皿。 所有平板于26℃条件下倒置培养4 d。
以48 h 内抑制率100%的最低精油浓度为其最低抑菌浓度(minimal inhibitory concentration, MIC)。 每个处理4 次重复。 按照公式计算抑菌率:

1.3.5 孢子萌发试验 参照Singh 等[18]的方法。 吸取一定量的丁香精油溶于0.2% 吐温80 中,充分乳化,待用。 在PDA 平板上刮取孢子,加马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基稀释至浓度为2×105的菌悬液(血球计数法)。 各取2 mL 加入到15 mL 玻璃试管中,再加入乳化后的精油(0.5 mL/管),使精油最终浓度达100、200、400、800 μL·L-1,以未加精油为对照组。 所有试管置于28℃、200 r·min-1恒温回转摇床培养20 h,用普通光学显微镜观察至少200个孢子(每个平行),统计孢子萌发率及芽管长度。 每个处理3 个平行。
1.3.6 细胞膜透性试验 向0.2%吐温80 溶液中加入一定量的丁香精油,使其充分乳化。 取5 mL 加入到含有50 mL PDB 培养基的摇瓶中,使精油终浓度为100、200、300、400 μL·L-1,以未加精油为对照组。 向每个摇瓶中加入0.1 mL 孢子悬浮液(1×107mL-1)。将悬浮液于28℃、200 r·min-1孵育5 d。 将收集的样品4 000 r·min-1离心15 min 获得上清液,分光光度计测量260 nm 波长处的吸光度值。
同时,将具有相同重量的上述沉淀的菌丝研磨,于4 000 r·min-1离心5 min 获得上清液,采用考马斯蓝染色测定蛋白质含量。
1.3.7 丁香精油的气相色谱- 质谱联用(gas chromatography-mass spectrometer,GC-MS)成分分析 气相色谱条件:Agilent-7890 色谱柱(30 m×0.25 mm×0.25 μm),进样口温度为250℃,柱室温度以5℃·min-1的速率从50℃(保持2 min)升至260℃(保持10 min),进样量1 μL。
质谱条件:接口温度280℃,电离方式EI,电子能量70 eV,离子源温度230℃,四极杆温度150℃。 数据采集模式:全扫描模式,扫描范围10 ~550 amu。 精油的主要成分通过比较其相对保留时间来匹配其质谱库(D.01.00NlST98),从而确定具体对应的物质。
1.3.8 扫描电镜观察菌丝形态 取丁香精油(300 μL·L-1)接触处理YT3 菌丝3 h,用2. 5%戊二醛溶液固定24 h,然后依次放入浓度为50%、75%、100%的乙醇中逐级脱水20 min。 采用临界点干燥法进行样品的干燥,喷金处理。 在扫描电镜下观察样品并拍照。
1.4 数据分析与处理
采用Excel 2010 与DPS 16.05 软件对结果进行方差分析和显著性检验(Duncan 新复极差法)。 试验结果为平均值±标准差。
2 结果与分析
2.1 甜樱桃采后主要病原菌的鉴定
2.1.1 形态鉴定 由图1-A、B 可知,YT1 在PDA 培养基上,菌落呈圆形,边缘规则,菌丝初为白色绒状,后颜色变为浅褐色,形成黑色菌核。 分生孢子梗数根丛生,直立或稍弯曲,具隔膜,顶端呈1 ~2 次分枝,分枝的末端膨大,上密生小梗,小梗上聚生大量分生孢子。分生孢子无色至淡褐色,单孢,卵圆形、椭圆形或葫芦形,大小为(10.3~19.0) μm×(7.8~12.1) μm。
由图1-C、D 可知,YT2 在PDA 培养基上,菌落呈圆形,边缘规则,菌落初为灰色绒状,后颜色变为黑褐色,有同心圈。 菌丝透明,有分隔,分生孢子褐色,单生或2 个孢子形成短孢子链。 分生孢子顶端微曲,大小为(10. 1 ~55. 0) μm×(5. 2 ~10. 3) μm,倒棒锤形或卵圆形,有纵横分隔,纵隔1 ~2 个,横隔1 ~7 个,分隔处缢缩,具有圆锥状或圆柱状短喙,喙长2. 2 ~7. 1 μm。
由图1-E、F 可知,YT3 在PDA 培养基上,菌落呈圆形,边缘规则,有同心圈,菌丝初为白色绒状,后颜色变为浅灰至深灰色,菌落表面产生橘红色分生孢子团,菌落背面形成黑色斑点。 分生孢子无色,单胞,长椭圆形、短杆状,两端钝圆,大小为(15.5 ~22.4) μm×(4.3~6.0) μm。
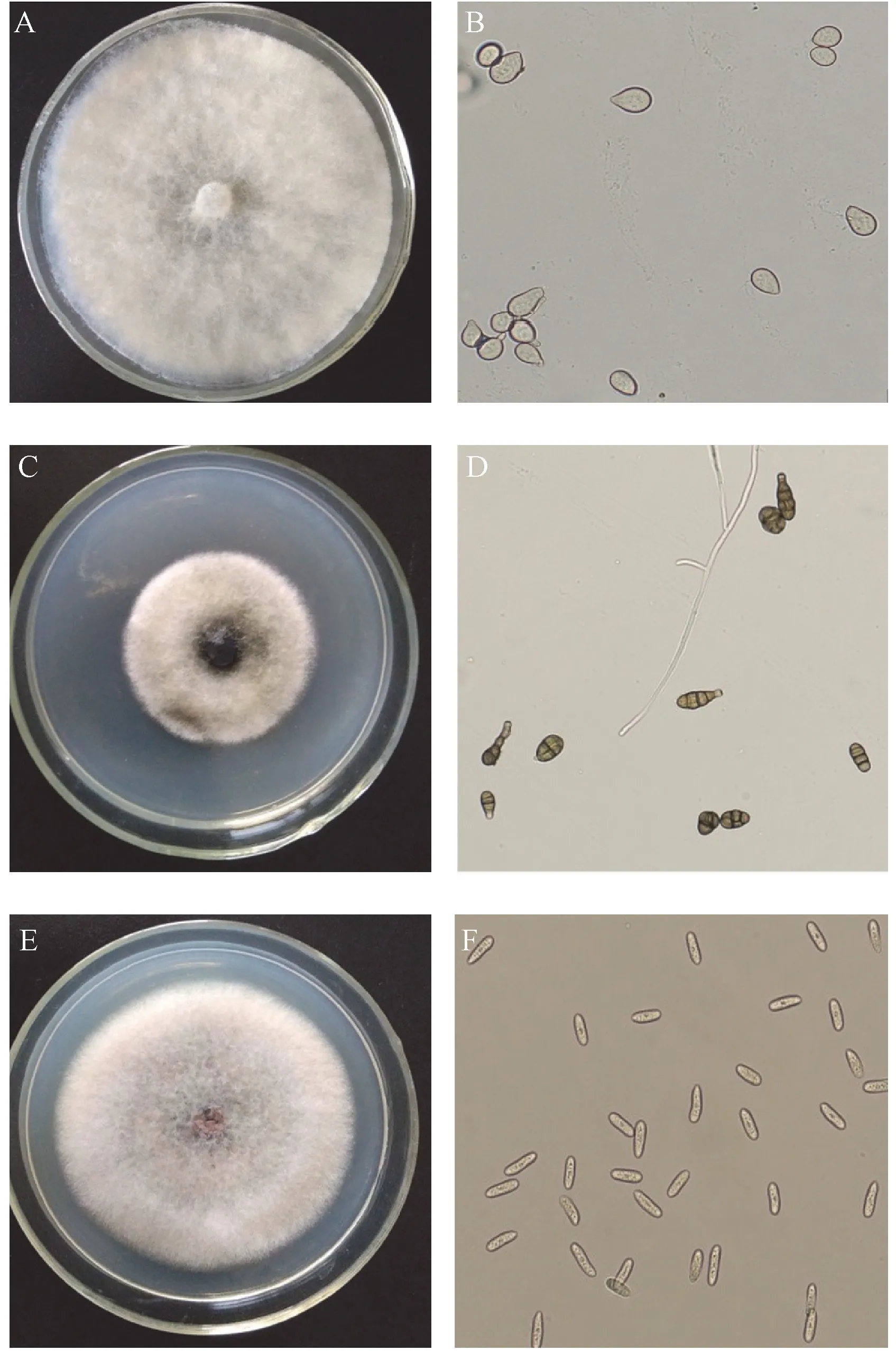
图1 3 种病原菌的菌丝及分生孢子的特征形态Fig.1 The morphological characteristics of conidia and hyphae for the three pathogens
2.1.2 ITS 序列比对鉴定 将所测序列在GenBank数据库中进行同源比对,将病原菌的序列及其相似序列用MEGA 5.2 软件的NJ 法构建系统发育树,以明确病原菌分类地位结果如图2 所示。
菌株 YT1 与美国寄生葡萄的灰葡萄孢菌(KR909190.1)聚在同一枝。 结合孢子形态特征,将菌株YT1 鉴定为灰葡萄孢菌(Botrytis cinerea)。 其中富氏葡萄孢盘菌为有性世代,灰葡萄孢菌为无性世代。
菌株YT2 与分离自印度毛地黄的芸苔链格孢(KU982593)、 澳大利亚本生烟的链格孢菌(KU059919. 1 )、 中国丹参的细极链格孢(JX406538)、 巴基斯坦番茄的早疫病菌(LC339939)、伊朗油菜的乔木链格孢(MF462297)聚为一类。 结合孢子的形态特征,鉴定菌株YT2 为链格孢菌(Alternaria alternata)。
菌株YT3 与分离自中国南天竹、巴基斯坦草莓、中国卫矛、中国枇杷、中国核桃、巴基斯坦柑橘、中国红叶石楠的胶孢炭疽菌( MF322895、MH168106、KY45484、JN704145、HQ845105、MH742312、MH311619)聚为一类。 结合孢子的形态特征,鉴定菌株YT3 为胶孢炭疽菌(Colletotrichum gloeosporioides)。
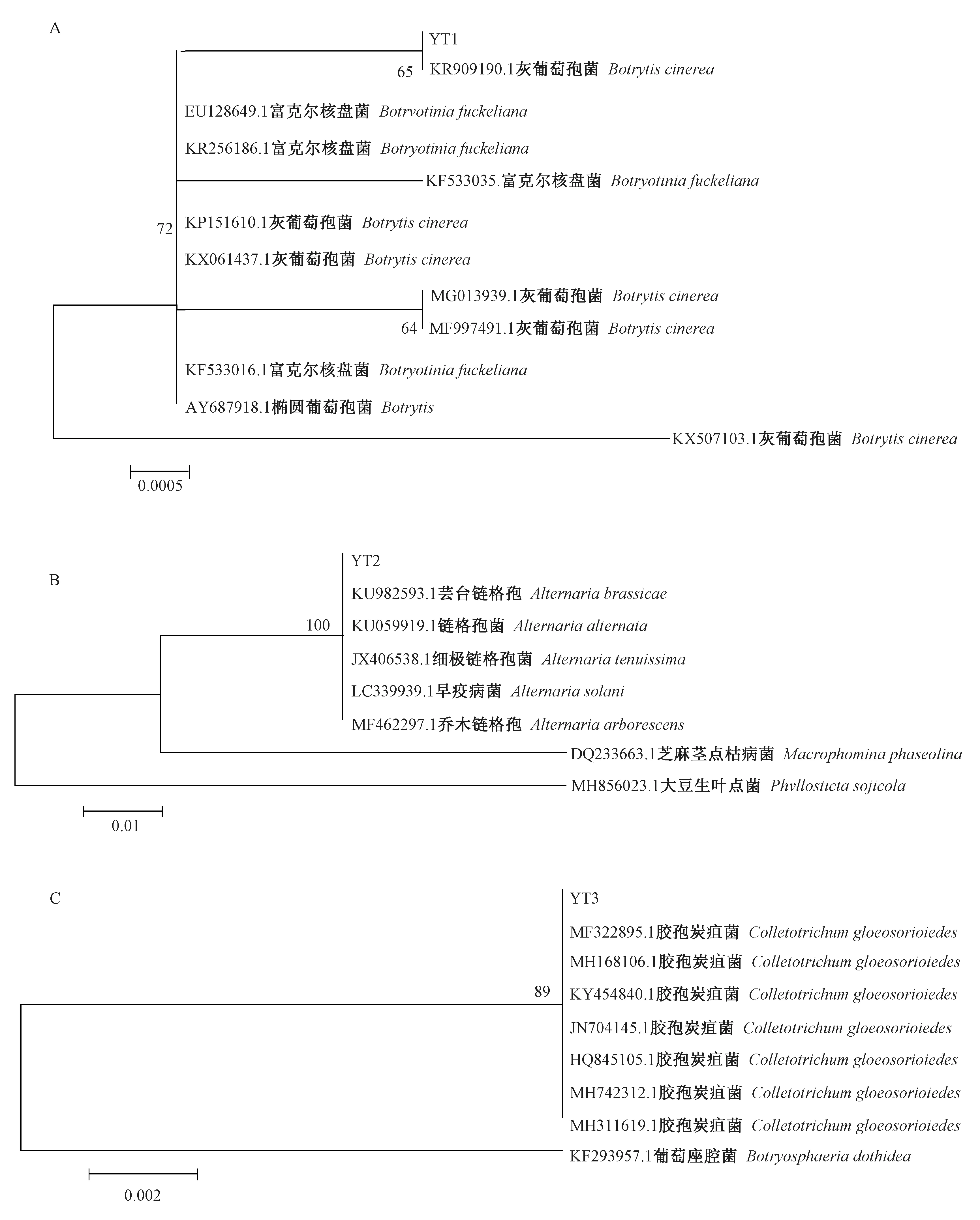
图2 基于ITS 序列和邻接法构建的系统发育树Fig.2 Phylogenetic tree derived from ITS domain sequences and neighbor-joining analysis
2.2 丁香精油不同作用方式对3 种病原菌的抑制作用
由表1、表2 可知,随着精油浓度的升高,无论是精油熏蒸还是接触处理,PDA 培养基上3 种病原菌的菌丝生长抑制率均逐渐增强,这与前人研究结果一致,即在体外试验中,抑菌效果依赖于精油的暴露浓度,即精油暴露浓度越高,抑菌效果越好[19]。 丁香精油对B.cinerea的MIC 较A. alternata、C. gloeosporioides更高,说明相比于其他2 株病原菌,B. cinerea对丁香精油的抗性更强,敏感性更高。 此外,要达到同样的抑制效率,熏蒸作用较接触作用的有效使用浓度更低,这主要是由于菌丝体具有较高的亲脂性,而熏蒸作用使得精油的主要作用成分充斥在菌丝周围的空间,作用的比表面积远大于菌饼本身,熏蒸作用较接触作用积累的精油量更多[20]。
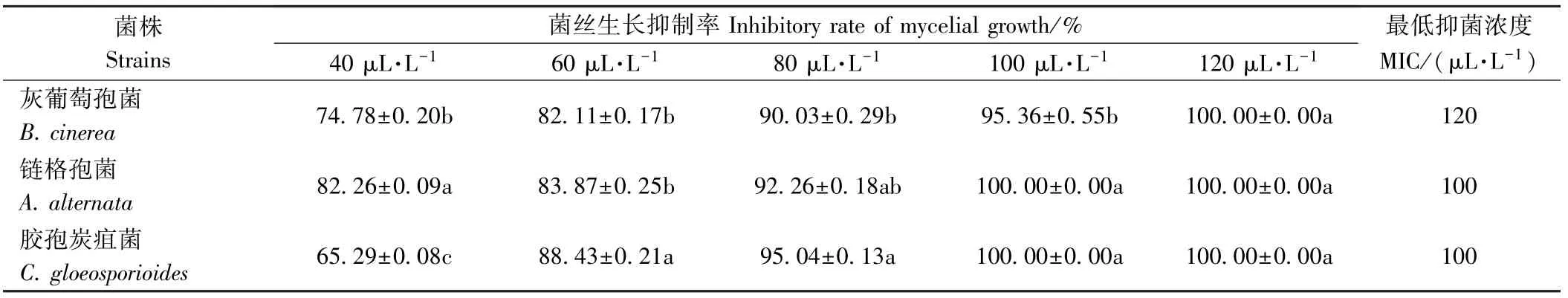
表1 丁香精油熏蒸处理对3 种病原菌的抑制活力(n=3)Table 1 Antifungal activity of clove oil on the three pathogens by fumigation (n=3)
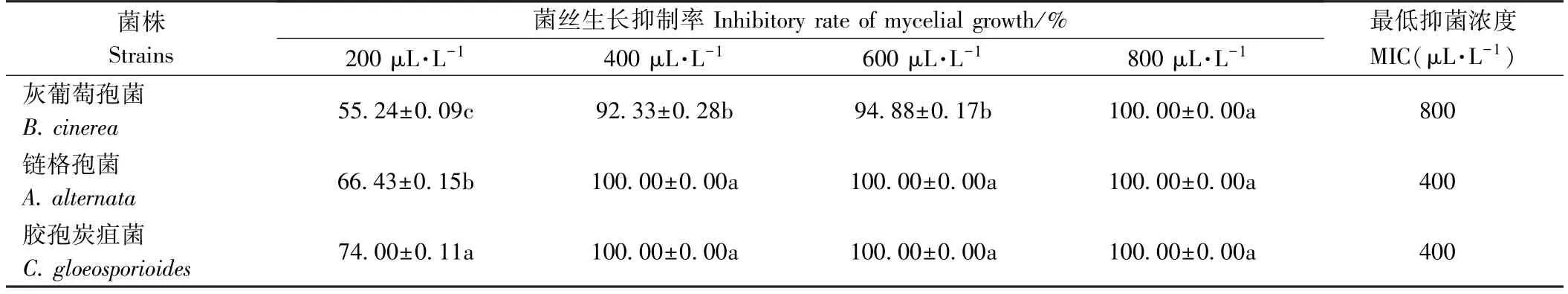
表2 丁香精油接触处理对3 种病原菌的抑制活力(n=3)Table 2 Antifungal activity of clove oil on the three pathogens by contact (n=3)
2.3 丁香精油对病原菌抑制作用的机理分析
2.3.1 丁香精油的化学组分 由表3 可知,丁香精油的主要成分是丁香酚(78.952%)和乙酸丁香酚酯(17.891%),与之前的报道一致,但具体含量以及次要组分存在一定差异[21]。 植物的生长条件、遗传因素、收获时期、营养状况及其他因素可能会影响所提取精油的组成,最终导致上述化学形式的多样性。

表3 丁香精油的主要化学组分Table 3 The main chemical components of Clove (Syzygium aromaticum L.) oil
2.3.2 丁香精油处理对YT3 孢子萌发的影响 由表4 可知,丁香精油有效抑制了C. gloeosporioides孢子的萌发及芽管的伸长。 经28℃恒温回转摇床培养20 h,对照组孢子几乎全部萌发(孢子萌发率97%),精油浓度为100 μL·L-1时孢子萌发率下降至52.9%,精油浓度为200 μL·L-1及以上时孢子萌发率在5%以下。 与对照组相比,精油浓度为100 μL·L-1时芽管长度略有减少,下降了9.5%;精油浓度为200、400 μL·L-1时,芽管长度分别较对照组显著降低了73.3%和94.7%,精油浓度为800 μL·L-1时孢子萌发全部受到抑制。

表4 不同浓度丁香精油处理对C. gloeosporioides孢子萌发率及芽管长度的影响(n=3)Fig. 4 Effect of different concentration of clove oil on spore germination and germ tube elongation of C. gloeosporioides (n=3)
2.3.3 丁香精油处理对YT3 细胞膜透性的影响 由图3 可知,关于细胞外核酸含量,丁香精油浓度为200、300、400 μL·L-1时,260 nm 波长处的吸光度值显著高于对照组及100 μL·L-1处理(P<0.05),表明200 μL·L-1以上浓度的丁香精油会导致C. gloeosporioides细胞膜透性增强,进而引起胞内核酸物质的外泄。 但200、300、400 μL·L-1处理间核酸含量无显著差异(P>0.05),这可能是由于随着精油浓度的升高,菌丝生长总量不断受到抑制,从而导致总的核酸含量变化不显著,这与Shao等[22]的结果不完全一致。 此外,在100~400 μL·L-1浓度范围内,随着精油浓度的升高,相同菌丝重量的胞内蛋白质含量呈显著下降趋势(P<0.05),这也进一步说明了精油处理对细胞膜结构的破坏作用。
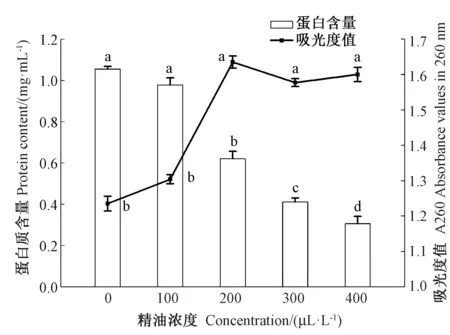
图3 丁香精油对C. gloeosporioides 核酸外泄和蛋白含量的影响Fig.3 Effect of clove oil on nucleic acid leakage and protein content of C. gloeosporioides
2.3.4 丁香精油处理对YT3 菌丝形态的影响 由图4 可知,丁香精油对YT3 菌丝微观结构形态有较大程度的破坏。 对照组(A)菌丝生长状态正常,健康饱满,表面平整光滑;处理组(B)菌丝出现严重变形并伴有褶皱、凹陷、不平整等现象。 表明丁香精油处理对YT3产生了严重影响,导致菌丝发生了类似脱水、皱缩等现象。
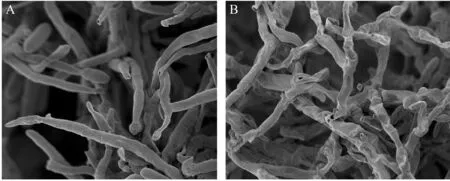
图4 对照组(A)与300 μL·L-1丁香精油处理组(B)菌丝的扫描电镜图像Fig.4 SEM images of (A) control and (B) 300 μL·L-1 clove oil-treated mycelia
3 讨论
结合形态和分子生物学(ITS 序列)鉴定,确定泰安产区红灯甜樱桃采后优势致病菌分别为B. cinerea、A. alternata和C. gloeosporioides,这与国内外学者的报道[23]略有差异,可能是产地、品种、管理条件、气候等的不同导致不同地区甜樱桃采后病原菌种群组成存在差别。
植物精油是一类安全、高效的天然杀菌剂,在果品采后腐烂控制中,发挥了独特的作用。 无论在体外抑菌还是体内防腐保鲜中,精油都可采用熏蒸和接触2种作用方式。 刘瑞玲等[24]采用接触及熏蒸方式比较了3 种精油对火龙果采后腐烂病原真菌的抑制作用,表明2 种作用方式下3 种精油的抑菌效果呈现出不同的变化。 本研究结果表明,丁香精油的浓度是其体外抑菌效力的决定要素之一,且体外熏蒸方式的有效施用浓度低于接触作用,这与熏蒸时被作用菌丝的比表面积较大有关[20]。 但在实际果品体内防腐保鲜应用中,除精油与病原菌的相互作用外,还应考虑精油对果品品质的影响,具体选择哪种精油处理方式及具体施用浓度都有待进一步确定,可以从以下几点作为参考:首先,要以精油的挥发气味不影响果品自身的风味和香气为前提,这与不同作用受体对气味的吸纳力存在差异有关[25];另外,精油的施用浓度既要起到抑制病害发生的效果,又不能对果品产生药害,Arras 等[26]研究表明,百里香精油浓度较高时,其对橘类水果青霉的防治效果更差,这与高浓度精油会破坏果实中氧化还原相关的代谢途径,从而导致对病原菌侵染的抗性能力减弱有关[27];另有学者建议,在实际使用精油时还应考虑果品同一树种不同品种间的抗性及理想储藏时间的差异[28]。 有研究表明,甜樱桃均适用于精油熏蒸和接触2 种处理方式,且抑菌效果显著[10,29],但在采后商品化处理中,精油具体的负载形式有待进一步研究,建议结合新型的生物活性物质或包埋技术,如壳聚糖涂层、皮克林乳液覆膜等[30-31],使得精油在延长果品贮藏期以及维持果品品质、营养成分保持、提高消费者接受度方面发挥更大作用。
精油是由一大类不同组分构成的混合物,其作用于病原菌的方式及靶点也有很多,因此,其抑菌机理较为复杂[32]。 有研究认为,精油的疏水性使它们能定位于微生物细胞膜及线粒体膜中的脂质成分,从而引起膜结构透性增强,胞内物质泄漏,并干扰微生物的各种生物进程[33]。 本研究结果表明,经一定浓度丁香精油处理的病原菌,其菌丝体生长和孢子萌发显著受到抑制,细胞内核酸及蛋白物质均出现了流失现象,其中,随着精油浓度升高,相同菌丝重量的蛋白质含量呈显著下降趋势,而较高浓度(200 μL·L-1及以上)精油处理时,上清液中核酸的含量差异不显著,可能是由于随着精油浓度的升高,菌丝生长总量不断受到抑制,虽然单个细胞的泄漏量增大,但总的核酸含量变化不显著。关于精油抑菌机理多集中在其与膜结构的相互作用方面,对精油功能成分具体靶向病原菌的代谢途径或信号通路以及关键调控基因的表达等尚未阐明。 另有研究表明,精油的抑菌性是其含量最多的成分起作用[34],经测定,本试验所用丁香精油主要成分是丁香酚,含量高达78.952%。 也有学者认为,精油作为混合物,其整体的抑菌性好于单一成分,推测不同组分之间有协同作用[35]。 因此,关于以上问题还需进一步深入研究。
4 结论
经形态和分子生物学(ITS 序列)鉴定明确了甜樱桃采后3 种主要致腐真菌,分别为灰葡萄孢菌(B.cinerea)、链格孢菌(A. alternata)和胶孢炭疽菌(C.gloeosporioides)。 体外抑菌试验表明,一定浓度的丁香精油能显著抑制3 种致病菌的菌丝生长和孢子萌发,且熏蒸处理较接触效果更好。 进一步试验表明丁香精油破坏了菌丝形态,可能是其疏水性引起微生物膜系统结构破坏,造成胞内主要内容物流失,生理代谢功能受到严重影响。
