聚合物涂覆的酶催化酯交换反应研究
2020-06-29段宝轩李诗浩王洪海李春利卢一凡
段宝轩,李诗浩,王洪海,李春利,卢一凡
(1.河北工业大学化工学院,天津 300130;2.河北工业大学化工过程集成与资源利用节能国家地方联合工程实验室;3.天津大学化工学院生化工程系和系统生物工程重点实验室(教育部))
基金项目:国家自然科学基金资助项目(21878066);河北省自然科学基金项目(B2019202167)。
酶促反应精馏(ERD)技术采用固定化酶替代传统的酸碱催化剂,具有反应条件温和、底物选择性高等优点,备受研究者们的青睐。但是ERD的工业应用受到酶催化剂成本和稳定性等因素的限制,研究人员开发了多种固定化酶的制备方法来克服上述限制因素[1-4]。固定化酶珠和溶胶-凝胶法是用于实验室规模ERD的两种常见的固定化酶制备方法[5-6]。固定化酶珠可以很好地保留酶的活性,因此其更适合于工业规模ERD的应用[5]。目前,用于实验室规模ERD的固定化酶珠主要是商业固定化脂肪酶Novozyme435,但是由于其成本和长效性限制,以及工业ERD规模庞大且反应条件苛刻,有必要开发可替代Novozyme435的具有成本和稳定性优势的新型固定化酶催化剂[7],使其在严苛的工业反应条件下,也能发挥良好的催化性能。
聚乙二醇化定义为聚乙二醇(PEG)与生物活性物质的共价结合,是一种经典的化学修饰方法,可用于对酶的性能改善[8-10]。由于酶表面没有足够的PEG连接位点,对酶进行PEG修饰时通常需要引入额外的功能化基团。酶表面的聚乙二醇涂层不仅可以提高酶在有机介质中的溶解度,而且可以改变酶结构的迁移率和构象,从而提高酶的催化性能。并且,由于酶失活通常是因为其疏水位点的暴露,导致其不期望的聚集、变性和失活,聚乙二醇化修饰可以增强酶的亲水性,从而减少其疏水位点的暴露,提高酶在反应过程中的稳定性。固定化酶良好的可重复利用性对于其工业应用尤为必要,通过开发可重复使用的酶催化剂来解决成本问题是经济可行的工业过程的重中之重[11]。
在ERD过程中,常用的反应模型是脂肪酶催化的合成乙酸正丁酯的酯交换反应[12]。本研究引入了南极假丝酵母脂肪酶B(CALB)与PEG大分子涂层,将大孔吸附树脂NKA用于固定CALB以制备具有成本优势的固定化酶珠NKA-CALB。然后,NKA-CALB通过葡萄糖-醛基介导的PEG涂层进一步强化,得到了经过一系列物理化学修饰后的固定化脂肪酶NKA-CALB-PEG。考察NKA-CALB-PEG与商业固定化脂肪酶Novozyme435的稳定性,然后将此固定化脂肪酶用于乙酸乙酯-正丁醇酯交换反应,探究NKA-CALB-PEG催化酯交换反应的最优工艺条件,得出动力学方程,为模拟计算及ERD工业应用提供数据参考。
1 实 验
1.1 试剂及材料
CALB,分析纯,由丹麦Bagsvaerd Novozyme公司提供;乙酸乙酯(EtAC)和正丁醇(BuOH)均为分析纯,购于中国天津市达茂化学试剂厂;右旋糖酐(40 000 Da),由上海笛柏生物科技有限公司提供;高碘酸钠和硼氢化钠均为分析纯,购于科密欧化学试剂技术有限公司;甲氧基聚乙二醇胺(mPEG-NH2,2 000 Da),分析纯,购于索罗门化学试剂技术有限公司;棕榈酸4-硝基苯酯(pNPP),分析纯,购于天津HEOWNS生物科技有限公司。大孔吸附树脂NKA,由天津腾盛化学试剂技术有限公司提供;聚乙烯亚胺,分析纯,购于罗恩化学试剂技术有限公司。
1.2 NKA-CALB的制备
将一定量的CALB和10 g NKA加入到容量为1 L的锥形瓶中,并用等体积的pH 为5.0的缓冲液稀释,然后将锥形瓶置于水浴振荡器中,在温度为30 ℃和转速为120 r/min的条件下温育8 h。用布氏漏斗对制备的产物进行纯化,并真空干燥4 h,得到固定化脂肪酶命名为NKA-CALB。
采用质量浓度为5 g/L的pNPP/乙醇溶液测定干燥后产物的水解活性。通过Bradford方法分析获得NKA-CALB的蛋白质含量[13]。NKA-CALB的水解活性为19 690 U/g,固定效率为82.5%,酶载量为49.5 mg/g。
1.3 NKA-CALB-PEG的制备
根据文献[14]的方法进行物理胺化:将2 g聚乙烯亚胺和20 mL磷酸盐缓冲液(摩尔浓度为25 mmol/L,pH为8.0)的混合物调节至pH为8.0后,向混合物中加入1 g NKA-CALB,并在4 ℃下孵育过夜。将混合物真空过滤,并用蒸馏水充分洗涤胺化的NKA-CALB。
采用聚乙二醇涂覆胺化的NKA-CALB:首先将右旋糖酐与高碘酸钠混合后,在室温下充分搅拌90 min,充分氧化后用蒸馏水透析得到葡聚糖-醛溶液;将胺化的NKA-CALB添加到此溶液中,并用硼氢化钠还原;还原的NKA-CALB添加到mPEG-NH2的溶液中进行再氧化,最后用蒸馏水彻底洗涤得到固定化脂肪酶NKA-CALB-PEG。通过使用烧结的玻璃漏斗洗涤并干燥NKA-CALB-PEG,然后用于酶促反应。
1.4 NKA-CALB和NKA-CALB-PEG的表征
1.4.1 共聚焦激光扫描显微镜(CLSM)将NKA-CALB和NKA树脂分别在质量浓度为0.3 g/L的荧光胺/丙酮溶液中室温下孵育10 min,然后通过离心分离除去过量的荧光胺。通过共聚焦激光显微镜检测纯化样品的荧光信号。采用共聚焦激光扫描显微镜评估带有荧光胺标记的NKA和NKA-CALB。荧光胺和蛋白质结合后显示出荧光特性,可用于表征CALB是否成功固定在NKA树脂上。
1.4.2 红外光谱(FT-IR)将NKA-CALB和NKA-CALB-PEG分别按一定比例与溴化钾混合,制成薄片,然后采用FT-IR光谱进行结构表征,波数范围为4 000~500 cm-1。
1.5 酯化活性及稳定性
固定化脂肪酶的反应活性通过酯化活性来表示,定义为在试验条件下每小时消耗1 μmol月桂酸的固定化脂肪酶的量。将反应前CALB,NKA-CALB,NKA-CALB-PEG,Novozyme435的酯化活性设定为100%,计算反应后CALB,NKA-CALB,NKA-CALB-PEG,Novozyme435的剩余活性。稳定性试验通过考察固定化脂肪酶的剩余活性进行评价。
酯化活性试验:将0.5 mmol月桂酸、2 mmol辛醇,5 mL环己烷均匀混合,向其中加入10 mg的固定化脂肪酶,在温度为40 ℃下搅拌2 h。通过热乙醇法测定月桂酸的剩余量,计算得到固定化脂肪酶的酯化活性。
稳定性试验:采用间歇反应器,机械搅拌,反应温度为70 ℃,分别考察NKA-CALB,NKA-CALB-PEG,Novozyme435在乙酸乙酯与正丁醇酯交换反应中的稳定性,固定化脂肪酶重复使用6次,每次反应2 h。每次反应后通过离心、洗涤和干燥回收固定化脂肪酶,然后进行下一次反应。
1.6 动力学试验
在间歇反应釜中进行NKA-CALB-PEG催化乙酸乙酯与正丁醇酯交换反应的动力学试验,考察各反应因素对反应物转化率的影响,确定最佳的反应条件。采用水浴加热,冷却水冷凝。间隔1 h进行取样分析。
2 结果与讨论
2.1 NKA-CALB和NKA-CALB-PEG的表征
2.1.1 CLSM荧光胺标记的NKA和NKA-CALB的CLSM形貌如图1所示。由图1可以看出,NKA没有产生荧光信号,而NKA-CALB却显示出明显的荧光信号,这可以从宏观上表明CALB被成功吸附在NKA大孔吸附树脂上。

图1 荧光胺标记的NKA和NKA-CALB的CLSM形貌
2.1.2 FT-IRNKA-CALB和NKA-CALB-PEG的FT-IR谱如图2所示。由图2可以看出,波数1 120 cm-1处对应于C—N键的拉伸振动吸收峰,NKA-CALB-PEG的峰明显强于NKA-CALB的峰。甲氧基聚乙二醇胺中的氨基与葡萄糖醛中的醛基反应形成席夫碱,该席夫碱进一步还原成C—N键,证实NKA-CALB已成功地被聚乙二醇化。另外,由于蛋白质分子中存在伯胺基,因此在波数1 647 cm-1处有一个剪切状的振动吸收峰,具有弱的N—H键,表明CALB负载在NKA树脂中。

图2 NKA-CALB 和 NKA-CALB-PEG的FT-IR谱
2.2 稳定性试验
NKA-CALB,NKA-CALB-PEG,Novozyme435在乙酸乙酯与正丁醇酯交换反应中的稳定性试验结果如图3所示。由图3可以看出,与Novozyme435和NKA-CALB相比,NKA-CALB-PEG显示出最好的操作稳定性。在重复使用6次之后,Novozyme435的剩余活性为60.2%,NKA-CALB的剩余活性为78.6%,而NKA-CALB-PEG在重复使用6次后可以有效地将其剩余活性保持在92.4%,表明制备的NKA-CALB-PEG具备良好的稳定性,能够适应严峻的工业生产条件,同时其可重复利用度高,具有极大的经济优势。

图3 NKA-CALB,NKA-CALB-PEG,Novozyme435的稳定性试验结果■—NKA-CALB; ■—NKA-CALB-PEG; ■—Novozyme435
2.3 反应动力学试验
2.3.1 搅拌速率的影响搅拌速率对乙酸乙酯转化率的影响如图4所示。由图4可以看出,在反应时间相同的条件下,搅拌速率从200 r/min升至300 r/min时,乙酸乙酯转化率明显提高;当搅拌速率从300 r/min 升至400 r/min时,乙酸乙酯转化率提高幅度较小,因此可认为当搅拌速率大于300 r/min 时,外扩散作用已经消除,若继续增大转速,会对设备及催化剂带来较大磨损,同时耗能也大,因此综合考虑选定搅拌速率为300 r/min。
2.3.2 催化剂用量的影响催化剂的用量对反应的影响较大,用量过少会使反应速率减小,导致反应时间增长,催化剂过量又会造成资源浪费。催化剂用量以其与乙酸乙酯的质量比计,分别选取5%,10%,15%。催化剂用量对乙酸乙酯转化率的影响如图5所示。由图5可以看出:在反应时间相同的条件下,催化剂用量由5%增至10%时,乙酸乙酯转化率增加明显;继续增加催化剂用量至15%时,乙酸乙酯转化率并未有明显提升。因此催化剂用量选定为10%。

图4 搅拌速率对乙酸乙酯转化率的影响搅拌速率,r/min: ■—200; ●—300; ▲—400
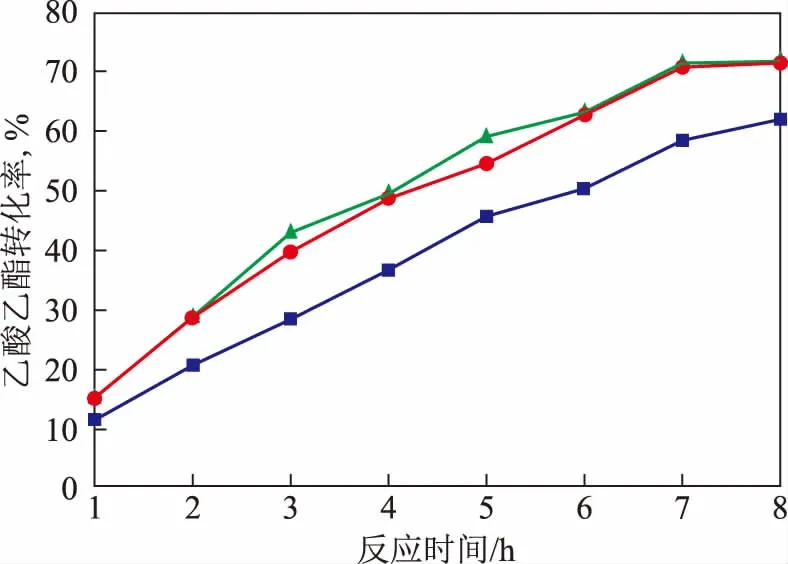
图5 催化剂用量对乙酸乙酯转化率的影响■—5%; ●—10%; ▲—15%
2.3.3 乙酸乙酯和正丁醇摩尔比的影响分别考察正丁醇过量和乙酸乙酯过量对反应物转化率的影响,结果见图6。由图6可以看出,在相同的乙酸乙酯和正丁醇摩尔比条件下,乙酸乙酯转化率或正丁醇转化率都是在反应进行到7 h时不再呈现上升趋势,即认为达到反应平衡。由图6(a)可知,在反应时间相同的条件下,随着反应物中正丁醇占比的增加,乙酸乙酯转化率总体呈现下降趋势。由图6(b)可知,在反应时间相同的条件下,反应进行到3 h后,正丁醇转化率随着乙酸乙酯加入量的增加才呈现下降趋势。综上所述,不论正丁醇过量或是乙酸乙酯过量,对固定化脂肪酶催化酯交换反应均产生了抑制作用。因此,选取乙酸乙酯与正丁醇摩尔比为1∶1时反应物的转化率最大。
2.3.4 反应温度的影响反应温度对乙酸乙酯转化率的影响如图7所示。由图7可以看出,在反应时间相同的条件下,反应温度为65 ℃时,乙酸乙酯转化率最高,为77.1%。在超过65 ℃时转化率反而降低,是因为固定化脂肪酶在65 ℃下酯化活性最高,超过此温度酶的酯化活性会下降。对可逆反应来说,温度对反应速率的影响是最大的,升高温度有利于加快反应速率,但是固定化脂肪酶长时间在高温条件下酯化活性容易受损。因此,选择65 ℃为反应的最适宜温度。

正丁醇/乙酸乙酯摩尔比: ■—1∶1; ●—1.25∶1; ▲—1.5∶1

乙酸乙酯/正丁醇摩尔比: ■—1∶1; ●—1.5∶1; ▲—2∶1图6 乙酸乙酯和正丁醇摩尔比对反应物转化率的影响
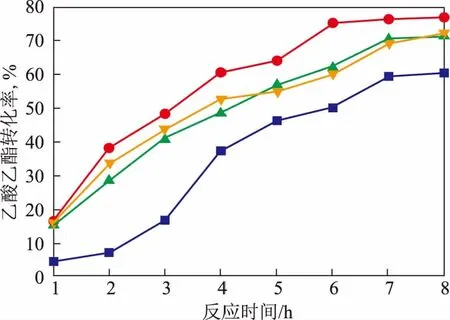
图7 反应温度对乙酸乙酯转化率的影响■—60 ℃; ●—65 ℃; ▲—70 ℃;
2.4 化学平衡常数的测定
化学平衡常数(K)可由平衡时混合物的组成得到,K由达到平衡时的混合物的活度表示,活度系数(α)由Wilson方程计算得到。K的计算公式见式(1)。
(1)
由反应温度为333.15,338.15,343.15,348.15 K下得到的反应数据,求得相应平衡常数K分别为0.145 4,0.169 9,0.208 3,0.239 3。平衡常数与反应温度(T)的关系曲线如图8所示。
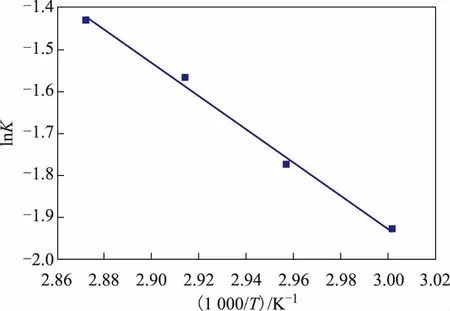
图8 平衡常数与反应温度的关系曲线
拟合出平衡常数与温度的关系,如式(2)所示。
(2)
式中,T为反应温度,K。
根据图8和Van’t Hoff方程计算反应焓变,可得标准反应焓变(ΔH)为32.74 kJ/mol,证明该反应为吸热反应。
2.5 动力学方程的拟合
乙酸乙酯与正丁醇酯交换反应为可逆二级反应[15],反应速率如式(3)所示。
r=k+c(EtAC)c(BuOH)-k-c(BuAC)c(EtOH)
=k+[c(EtAC)c(BuOH)-c(BuAC)c(EtOH)/K]
(3)
式中:r为反应速率,mol/(L·min);k为反应速率常数,L·mol/min;c为浓度,mol/L;下标+、-分别表示正、逆反应方向。
根据化学反应动力学模型,将试验数据进行线性回归拟合,如图9所示。由图9也可以看出,酯交换反应为吸热反应。
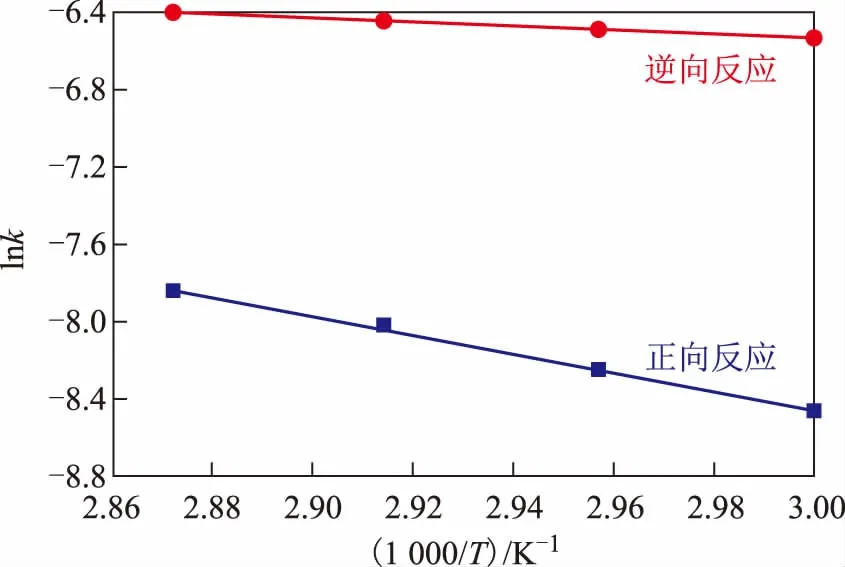
图9 反应速率常数与温度的关系
由此得到该酯交换反应的Arrhenius方程为:
(4)
(5)
根据Arrhenius 方程线性回归拟合得到相应的动力学参数,k+和k-分别为495.625 L·mol/min和0.025 L·mol/min,对应的反应活化能Ea+和Ea-分别为4.603×104kJ/mol和7.860×103kJ/mol。最终得到乙酸乙酯和正丁醇反应的动力学方程为:
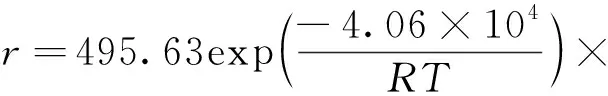
(6)
其中
(7)
式中,R为气体常数,J/(mol·K)。
3 结 论
(1) 通过聚合物涂层修饰固定化脂肪酶的策略制备新型固定化脂肪酶NKA-CALB-PEG,其重复使用6次后剩余活性为92.4%,与Novozyme435和NKA-CALB相比,NKA-CALB-PEG具有更好的稳定性。
(2) 通过乙酸乙酯和正丁醇酯交换反应动力学试验确定的最优工艺条件为:搅拌速率300 r/min、催化剂用量10%、反应温度65 ℃、乙酸乙酯/正丁醇摩尔比1∶1。
(3) 建立动力学模型,将动力学数据进行拟合,得到乙酸乙酯与正丁醇酯交换反应的动力学方程。比较试验值和计算值,结果表明此宏观动力学方程具备合理性,为该工艺进一步工业化提供了重要数据支撑。
