鸦胆子苦素D通过PI3K/Akt信号通路抑制人乳腺癌MDA-MB-231细胞的能量代谢研究
2020-06-28吉兆宁
王 雨,罗 璨,吉兆宁
乳腺癌的发病率很高,被认为是女性最常见的癌症之一[1]。其中,三阴性乳腺癌(TNBC)易于复发且死亡率高,被认为是最严重的乳腺癌亚型[2]。包括外科手术、化学疗法和放射疗法在内的多种疗法已被用于治疗乳腺癌。然而,乳腺癌仍然是临床治疗中最具挑战性的肿瘤之一。化学疗法是乳腺癌术后的标准治疗方法,但化疗药物通常会引起不良作用和耐药性。开发有效的天然抗肿瘤药物对于克服耐药性至关重要。鸦胆子的种子被用作传统中药,常用于治疗疟疾、痢疾和癌症[3]。鸦胆子苦素D是从鸦胆子的果实中提取的一种类胡萝卜素[4]。早期研究[5]表明,鸦胆子苦素D对胰腺癌、慢性粒细胞性白血病、肝细胞癌和骨肉瘤等具有抑制作用。能量代谢重组(EMR)是癌症的最关键标志之一[6]。最近的研究[7]表明,EMR可能是乳腺癌靶向治疗的潜在方向。目前尚无关于鸦胆子苦素D对肿瘤细胞能量代谢影响的研究。本研究探讨鸦胆子苦素D在TNBC MDA-MB-231细胞能量代谢中的作用及其分子机制。
1 材料与方法
1.1 材料 MDA-MB-231细胞购自江苏凯基生物科技有限公司(中国)。鸦胆子苦素D样品(纯度> 98%)(暨南大学中医药与天然产物研究所,中国),二甲基亚砜(DMSO)(久亿化学试剂有限公司,中国),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(Amresco,美国),RPMI-1640培养基和胎牛血清(Gibco,美国),青霉素/链霉素溶液、顺铂、BCA蛋白定量试剂盒、β-actin抗体和抗兔免疫球蛋白(凯基生物科技有限公司,中国),葡萄糖试剂盒、乳酸试剂盒、ATP试剂盒、己糖激酶(HK)试剂盒、磷酸果糖激酶(PFK)试剂盒、丙酮酸激酶(PK)试剂盒、乳酸脱氢酶(LDH)试剂盒(建成生物科技有限公司,中国),PI3K抗体(Affinity,美国),Akt和p-Akt抗体(武汉三鹰生物有限公司,中国)。CO2培养箱(Sanyo,日本),分光光度计(Thermo Fisher,美国),超声裂解仪(新芝生物科技股份有限公司,中国),高速冷冻离心机(Eppendorf,德国),生物倒置显微镜(Olympus,日本)。
1.2 细胞培养 将MDA-MB-231细胞培养于含10%胎牛血清、青霉素/链霉素溶液的RPMI-1640培养基中。置于在37 ℃、5%CO2的细胞培养箱中生长。每隔3 d传代1次,取对数生长期的细胞进行实验。
1.3 鸦胆子苦素D配制 将鸦胆子苦素D溶解在DMSO中,并储存在-20 ℃。使用前,用RPMI-1640培养基稀释至所需浓度。
1.4 MTT法测定细胞活力 将MDA-MB-231细胞接种到96孔板(5×103/孔)中并培养24 h,然后加入不同浓度的顺铂(1.56~25.00 μmol/L)和鸦胆子苦素D(1.56~25.00 μmol/L)培养24 h,设立不加药物的对照组。随后,每孔加入20 μL MTT溶液,4 h后,弃培养基并加入150 μL DMSO。最后,测量各组在490 nm处的吸光度(OD)值以评价细胞活力。细胞存活率=实验组OD值/对照组OD值×100%。
1.5 ATP浓度的测定 将细胞以1×105/mL的密度接种,并在37 ℃用不同浓度的鸦胆子苦素D(1、2、4 μmol/L)或0.1%DMSO(对照组)处理24 h。将细胞悬液以1 000 r/min离心5 min,并收集细胞沉淀。然后将细胞沉淀物用PBS洗涤,并用超声仪裂解5 min。将细胞裂解液在4 ℃以12 000 r/min离心15 min,取上清液储存在-80 ℃。使用ATP试剂盒测定细胞裂解液中的ATP含量,使用BCA蛋白质定量试剂盒对细胞裂解液进行定量。
1.6 葡萄糖消耗量和乳酸生成量测定 细胞以1×105/mL的密度接种。在37 ℃下用不同浓度的鸦胆子苦素D(1、2和4 μmol/L)或0.1%DMSO(对照组)处理24 h后收集培养基,并在-80 ℃保存。使用葡萄糖和乳酸试剂盒测定培养基中葡萄糖和乳酸的浓度。葡萄糖消耗量和乳酸生成量为24 h培养期开始和结束时培养基含量的改变量。
1.7 糖酵解关键酶活性测定 将细胞以1×105/mL的密度接种,并在37 ℃用不同浓度的鸦胆子苦素D(1、2、4 μmol/L)或0.1%DMSO(对照组)处理24 h。将细胞悬液以1 000 r/min离心5 min,然后收集细胞沉淀。然后将细胞沉淀用PBS洗涤,并用超声仪裂解5 min。将细胞裂解液在4 ℃ 以12 000 r/min离心15 min,收集上清液,并储存在-80 ℃。使用HK、PFK、PK和LDH试剂盒测定细胞裂解液中的HK、PFK、PK和LDH活性,使用BCA蛋白定量试剂盒测定细胞裂解液中的蛋白质浓度。
1.8 Western blotting分析蛋白表达 使用总蛋白提取试剂盒提取MDA-MB-231细胞的总蛋白。使用BCA蛋白定量试剂盒分析样品的总蛋白浓度。各组蛋白样品通过10%SDS-PAGE分离,然后转移到聚偏二氟乙烯膜上。在室温下将膜用5%脱脂奶粉封闭1 h,然后用TBST洗涤3次。随后,将膜与PI3K(1∶1 000)、Akt(1∶5 000)、p-Akt(1∶5 000)和β-actin(1∶400)抗体在4 ℃孵育过夜。然后将膜与抗兔IgG(1∶2 000)孵育1 h,用增强的化学发光法染色,使用G:BOX chemiXR5成像,并使用Gel-Pro32软件进行灰度分析。以β-actin作为内参。
1.9 统计学方法 采用方差分析和q检验。
2 结果
2.1 不同浓度鸦胆子苦素D抑制MDA-MB-231细胞活力的比较 鸦胆子苦素D处理MDA-MB-231细胞24 h的IC50值为(44.25±1.65)μmol/L。MTT结果表明,在1.56~25.00 μmol/L浓度范围内,鸦胆子苦素D均可浓度依赖性地抑制MDA-MB-231细胞的增殖活性(P<0.01)(见表1)。
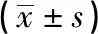
表1 各组细胞活力的比较
q检验:与对照组比较*P<0.05;与3.13 μmol/L组比较#P<0.05;与6.25 μmol/L组比较△P<0.05;与12.50 μmol/L组比较□P<0.05
2.2 鸦胆子苦素D对MDA-MB-231细胞中ATP含量的影响 与对照组相比,1、2、4 μmol/L鸦胆子苦素D均可降低MDA-MB-231细胞中ATP含量(P<0.05)(见表2)。
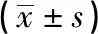
表2 各组细胞中ATP含量的比较
q检验:与对照组比较*P<0.05;与1 μmol/L鸦胆子苦素D组比较#P<0.05;与2 μmol/L鸦胆子苦素D组比较△P<0.05
2.3 不同浓度鸦胆子苦素D抑制MDA-MB-231细胞有氧糖酵解作用的比较 与对照组相比,1、2、4 μmol/L鸦胆子苦素D处理MDA-MB-231细胞的葡萄糖消耗量和乳酸生成量均减少(P<0.05)(见表3)。
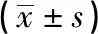
表3 各组细胞中葡萄糖消耗量和乳酸生成量比较
q检验:与对照组比较*P<0.05;与1 μmol/L鸦胆子苦素D组比较#P<0.05;与2 μmol/L鸦胆子苦素D组比较△P<0.05
2.4 鸦胆子苦素D对糖酵解关键酶活性的抑制作用 与对照组相比,1、2、4 μmol/L鸦胆子苦素D均可降低MDA-MB-231细胞中HK、PFK、PK和LDH的活性(P<0.05)(见表4)。
2.5 鸦胆子苦素D对MDA-MB-231细胞中PI3K、Akt和p-Akt蛋白的抑制作用 与对照组相比,2、4 μmol/L鸦胆子苦素D处理MDA-MB-231细胞24 h,均可抑制细胞中PI3K、p-Akt蛋白的表达(P<0.05)(见图1、表5)。
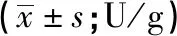
表4 各组细胞中HK、PFK、PK、LDH活性比较
q检验:与对照组比较*P<0.05;与1 μmol/L鸦胆子苦素D组比较#P<0.05;与2 μmol/L鸦胆子苦素D组比较△P<0.05
3 讨论
尽管多种治疗方法被应用于TNBC,但是TNBC依然缺乏特定的靶向治疗,预后较差。之前的研究[7]表明,乳腺癌的能量代谢过程可能作为潜在的靶向治疗目标。本研究初步探讨了鸦胆子苦素D对于TNBC细胞能量代谢的影响,并证实鸦胆子苦素D能明显抑制MDA-MB-231细胞的有氧糖酵解过程。
Warburg效应指出,肿瘤细胞倾向于利用有氧糖酵解来产生能量,而不是通过氧化磷酸化作用。这种现象存在于包括乳腺癌在内的多种癌症细胞内[8]。有氧糖酵解过程中1分子葡萄糖分解产生2分子ATP,而肿瘤细胞的生长和增殖需要ATP[9]。本研究结果表明,在鸦胆子苦素D处理后,MDA-MB-231细胞中ATP含量减少,可能出现供能不足。
有氧糖酵解是葡萄糖转变为丙酮酸,最终生成乳酸的过程[10]。葡萄糖作为有氧糖酵解底物,可以为机体提供能量,是细胞主要能量来源。乳酸是有氧糖酵解最终产物,同时在能量调节中发挥关键作用。用鸦胆子苦素D处理后,MDA-MB-231细胞葡萄糖消耗量和乳酸生成量都明显减少,提示MDA-MB-231细胞中有氧糖酵解过程被鸦胆子苦素D抑制。
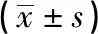

分组nPI3KAktp-Akt对照组30.19±0.020.23±0.030.21±0.021μmol/L鸦胆子苦素D30.16±0.01∗0.20±0.020.16±0.012μmol/L鸦胆子苦素D30.09±0.02∗#0.20±0.010.07±0.02∗#4μmol/L鸦胆子苦素D30.04±0.01∗#△0.19±0.020.02±0.01∗#△F—76.412.91132.12P—<0.01>0.05<0.01MS组内—0.0000.0000.000
q检验:与对照组比较*P<0.05;与1 μmol/L鸦胆子苦素D组比较#P<0.05;与2 μmol/L鸦胆子苦素D组比较△P<0.05
有氧糖酵解过程通过HK、PFK、PK、LDH 4种关键酶进行调节,它们在调节过程中发挥不同的作用[11]。糖酵解的第一步是将葡萄糖转化为6-磷酸葡萄糖,HK在其中起关键作用[12]。PFK催化糖酵解的另一个限速步骤,即6-磷酸葡萄糖转变为1,6-二磷酸果糖[13]。PK催化磷酸烯醇丙酮酸转化为丙酮酸,并在此过程中生成ATP[14]。LDH催化糖酵解途径中的最后一步,将丙酮酸转化为乳酸。在用鸦胆子苦素D处理后,MDA-MB-231细胞中的HK、PFK、PK、LDH活性均明显降低。
PI3K/Akt信号途径参与多种生物学过程,包括葡萄糖代谢、细胞周期、细胞凋亡和血管生成,在肿瘤的生长和增殖中起着重要的作用[15]。Akt被认为是Warburg激酶,被激活后发生磷酸化转变为p-Akt,通过刺激HK和PFK促进葡萄糖代谢。PI3K是一种脂质激酶,可以增强HK和PFK活性从而增加糖酵解通量[16]。研究[17]表明,PI3K/Akt信号通路还可以调节PK和LDH活性。本研究结果表明用鸦胆子苦素D处理后,MDA-MB-231细胞中的PI3K、p-Akt表达均降低,提示MDA-MB-231细胞中PI3K/Akt信号通路活性被鸦胆子苦素D所抑制。结合前面的实验结果,提示鸦胆子苦素D可通过抑制PI3K/Akt信号通路,进而降低有氧糖酵解关键酶活性并抑制有氧糖酵解,减少MDA-MB-231细胞能量供应。
综上所述,鸦胆子苦素D通过抑制MDA-MB-231细胞中PI3K/AKT信号通路,从而降低有氧糖酵解水平,减少细胞能量供应。本研究结果提示鸦胆子苦素D可能作为治疗TNBC的潜在抗肿瘤药物,为未来药物开发提供理论基础。
