8周有氧运动对小鼠骨骼肌microRNA表达的影响及其生物信息学分析
2020-06-27梅涛王建设张缨
梅涛 王建设 张缨


摘 要:目的:研究8周有氧运动对骨骼肌microRNA表达的影响,并对差异表达的miRNA进行生物信息学分析以发现其可能作用途径,为后续深入研究运动对骨骼肌产生影响的机制提供方向。研究方法:20只8周龄C57BL/6J小鼠随机分为安静组(C)和运动组(E)。运动组预适应训练一周后,采用坡度0°、12 m/min、60 min/天、5天/周、持续8周的有氧训练方案进行跑台训练。于训练48小时后采集小鼠腿部骨骼肌,并提取總RNA,采用miScript miRNA PCR Arrays检测骨骼肌miRNA的表达;采用DIANA-microT-CDS、TargetScan对差异表达的miRNA进行靶基因预测,Cytoscape Bingo工具对靶基因进行Gene Ontology分析(GO分析),mirPath v.3工具对差异表达的miRNA进行通路分析。研究结果:1)共发现58个有氧运动影响骨骼肌差异表达的miRNAs,其中上调表达的miRNAs有miR-411-5p、miR-340-5p、miR-148b-3p 等,共计44个;下调表达的miRNAs共有miR-709、miR-1947-3p、miR-667-5p 等14个。2)靶基因预测结果显示,上调表达的miRNA共有9 122个靶基因,下调表达的miRNAs共有3 636个靶基因。3)GO分析发现,上调表达的miRNA的靶基因GO功能富集主要包括核酸结合、蛋白质结合、DNA结合、调节基因表达、大分子代谢过程等;下调表达的miRNA的靶基因GO功能富集主要包括核酸结合、蛋白质结合、核酸代谢过程、转录过程等。4)miRNA 通路分析结果显示,上调表达的miRNA靶向的通路有MAPK信号通路、mTOR信号通路、破骨细胞分化等;下调表达的miRNA靶向的通路有糖胺聚糖生物合成 - 硫酸软骨素信号通路、Wnt信号通路、MAPK信号通路等。结论:有氧运动能够引起骨骼肌内miRNA的差异表达;差异表达
关键词:有氧运动;microRNA;骨骼肌;生物信息学分析
Abstract:Objective:To analyze the functions of miRNAs which were affected by 8-week aerobic exercise in skeletal muscle of mice. Methods:Twenty C57BL/6J mice were randomly divided into exercise (E) and control (C) groups. The E group were trained on a treadmill with a program of slope 0°, 12m/min, 60min/day, and 5 days/week. The C group lived normally without training. After 8-week of training, skeletal muscles were harvested for RNA extraction. Subsequently, miScript miRNA PCR Arrays was conducted to identify the differentially expressed miRNAs between two groups. Target gene prediction was performed by using TargetScan and microT-CDS tools. Gene Ontology analysis (GO) on the target gene was performed with Cytoscape Bingo. MirPath v.3 from the DIANA tools was used to execute the Kyoto Encyclopedia of Genes and Genomes (KEGG) analyses. Results: A total of 58 miRNAs affecting the differential expression of skeletal muscle were found. 44 miRNAs were upregulated (miR-411-5p, miR-340-5p, miR-148b-3p, etc.) and 14 miRNAs were downregulated (miR-709, miR-1947-3p, miR-667-5p, etc.) after the aerobic exercise. Prediction of target genes showed that there were a total of 9122 target genes for the up-regulated miRNAs, while 3636 target genes for the down-regulated miRNAs. GO analysis revealed that the differentially expressed miRNAs participated in a variety of molecular functions and biological processes including nucleic acid binding, protein binding, regulation of gene expression, macromolecule metabolic process and others. KEGG analysis showed that the up-regulated miRNAs were significantly enriched in MAPK, Wnt and mTOR signaling pathway. The down-regulated miRNAs were mainly enriched in MAPK, Wnt signaling pathway. Conclusion:Differential expression of miRNAs in skeletal muscle could be induced by Aerobic exercise. The physiological and biochemical processes may be regulated by the differentially expressed miRNAs in skeletal muscle by targeting MAPK signaling pathway, Wnt signaling pathway and mTOR signaling pathway, which provide directions for further research.
Key words: Aerobic Exercise; MicroRNA; Skeletal Muscle; Bioinformatics Analysis
骨骼肌是机体重要的动力源,微小RNA (microRNA, miRNA)参与对骨骼肌细胞增殖、分化、肌肉萎缩、骨骼肌重塑、骨骼肌血管再生等的多种生理功能的调节作用[1-3]。MiRNA是一類长度约22个核苷酸的单链非编码RNA,其主要的作用是通过抑制靶基因的转录后翻译或者降解其mRNA,进而负性调控动植物细胞内的基因表达[4]。新近研究发现,骨骼肌特异性miRNA(Muscle-specific microRNAs,myomiRs)对骨骼肌的生理功能的调控起着十分重要的作用[1]。“运动是良医”,一些文献已报道有氧运动影响增龄或病理性的骨骼肌萎缩、骨骼肌肥大等生理过程[5-7],也可影响骨骼肌中miRNA的表达水平[8]。然而,有规律的长期有氧运动会影响哪些miRNA表达,以及这些miRNA在有氧运动中主要介导哪些信号通路的变化,国内外未见报道。
因此,本研究以C57BL/6J雄性小鼠为研究对象,观察8周有氧运动后,小鼠骨骼肌中miRNA的表达变化,并对小鼠骨骼肌中差异表达的miRNA进行生物信息学的分析(包括靶基因预测、GO功能注释分析和通路分析),从miRNA角度探讨有氧运动影响骨骼肌生理过程的可能调控机制,以期为后续研究提供方向和生物信息学依据。
1 材料与方法
1.1 研究对象
健康 8 周龄C57BL/6J雄性小鼠(购于维通利华公司实验动物技术有限公司,动物合格证书:SCX-K(京)2009-0004)20 只,按体重随机分为两组:安静对照组(C组)和有氧运动组(E组),每组 10 只。小鼠体重(18.37±2.26)g,每笼 3~4 只饲养于北京体育大学动物房,动物房温度保持在 20℃~25℃,相对湿度保持在 50%~70%,每天光照 12 h(7:00-19:00),各组动物均自由进食和饮水。
1.2 干预方案
C组、E组小鼠正常笼中活动;E组小鼠首先进行1周适应性跑台训练,方案为:坡度0°,跑速12 m/min,持续时间15 min/天,运动频率5天/周。之后采用正式训练方案:坡度0°,跑速12 m/min(约75%最大摄氧量强度)[9],运动强度持续时间60 min/天,运动频率5天/周,共8周。
1.3 取材
所有小鼠取材均在8周最后一次运动后48 h进行。小鼠脱颈椎处死,立即取小鼠两侧腿部骨骼肌,迅速称量,用锡纸包裹,标记,立刻投入液氮中。然后转入-80℃冰箱,保存待用。
1.4 miRNA检测
取50 mg小腿骨骼肌组织,采用miRNeasy Mini Kit(Qiagen GmbH,德国)提取骨骼肌总RNA。采用Nanodrop 2000(Thermo Fisher Scientifc,美国)检测RNA提取质量和浓度。采用miScript II RT Kit(Qiagen GmbH,德国)进行反转录合成cDNA,反转录体系为:5× miScript HiSpec Buffer 4μL,10× miScript Nucleics Mix 2 μL,RNase-free water 10.5 μL,miScript Reverse Transcriptase Mix 2 μL,Template RNA 1.5 μL。采用miScript SYBR Green PCR Kit、miScript miRNA PCR Arrays(Qiagen GmbH,德国)对miRNA进行基于SYBR Green法的real-time qPCR分析。采用ABI7500荧光定量 PCR仪(Thermo Fisher Scientifc,美国)检测CT值。RT-PCR反应体系为2× QuantiTect SYBR Green Master Mix 12.5 μL, 10x miScript Universal Primer 2.5 μL,RNase-free water 9.8 μL,cDNA 模板 0.2 μL。RT-PCR反应条件为:激活 HotStart DNA Taq 酶95℃ 15 min;变性94℃ 15 s,融合55℃ 30 s,延伸70℃ 30 s,40个循环;添加溶解曲线。使用2-△△CT法计算实验组相对于对照组的表达差异倍数。
1.5 miRNA靶基因预测
采用DIANA-microT-CDS和TargetScan在线预测软件工具对差异表达的miRNA进行靶基因预测。分别预测运动上调miRNA的靶基因和运动下调miRNA的靶基因。由于不同的预测工具在算法上存在差异,为增加预测的准确性,选取能同时被这两个预测工具预测到的基因作为差异miRNA的靶基因。
1.6 Gene Ontology(GO)分析
本研究采用Cytoscape Bingo 插件对靶基因进行GO功能注释分析。GO是一个国际标准化基因功能分类体系,由基因本体联合会所建立,适用于对基因功能进行限定和描述。该体系包含基因分子功能(Molecular Function,MF)、细胞组分(Cellular Component,CC)、生物过程(Biological Process,BP)等内容。通过这三个方面描述miRNA靶基因及其产物具有的分子功能、参与的生物过程以及位于细胞中的位置。
1.7 miRNA通路分析
采用DIANA-mirPath v.3分析工具对差异表达的miRNA进行通路分析,预测miRNA能够影响的信号通路。该分析工具集成了主流的miRNA靶基因数据库,输入差异表达的miRNA,通过计算即可获得miRNA对应靶基因的信号通路,从而获知miRNA可能通过作用于哪些靶基因的信号通路而影响骨骼肌的生理过程。
1.8 统计学分析
miRNA差异表达采用Student t检验计算P值;GO 分析采用Cytoscape Bingo工具里的超几何分布方法计算P值,采用多重比较检验,确定功能注释的误判率(FDR),获得校正后P值;miRNA通路分析采用mirPath v.3分析工具里的Fisher 精确检验计算P值;各分析方法以P<0.05 為显著性阈值。
2 结果
2.1 8周有氧运动对骨骼肌miRNAs表达的影响
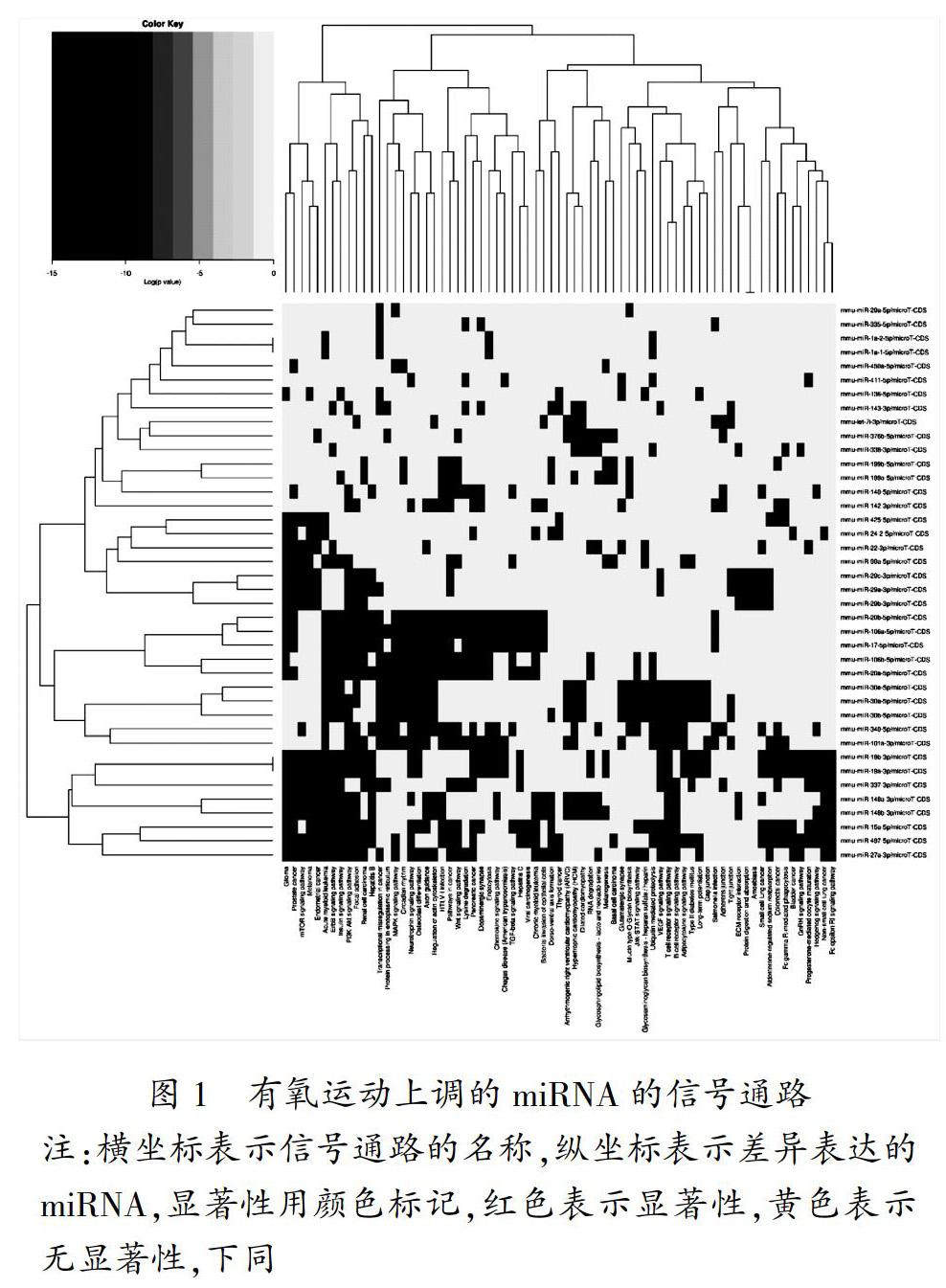
本研究选取差异表达倍数的绝对值≥2.0(|Fold Change|≥2.0),为差异表达的miRNAs。若Fold Change>0表示有氧运动上调的miRNA;若Fold Change<0则为有氧运动下调的miRNA,结果如表1。
由表1可知,共发现58个差异表达的miRNAs,其中上调表达的miRNAs有44个,下调表达的miRNAs共有14个。
2.2 miRNA靶基因预测结果
通过DIANA-microT-CDS和TargetScan软件分别预测每个差异表达的miRNA的靶基因,两个预测软件的结果取交集,其结果如表2和表3。
由表2和表3可知,通过DIANA-microT-CDS和TargetScan预测有氧运动上调、下调miRNA的靶基因有9 122和3 636个。
2.3 GO分析结果
采用Cytoscape Bingo 插件对靶基因进行GO功能注释分析,将得到的分子功能、生物过程和细胞组分注释结果,按P值从小到大排列,前5位结果如表4、表5。
从表4中可以看出,有氧运动上调miRNA的靶基因,其分子功能主要是与结合功能相关,如与核酸、蛋白质、锌离子结合等;靶基因参与的生物过程主要是基因表达和代谢过程的调控,如基因表达、大分子和初级代谢过程的调节等;靶基因编码的蛋白定位于的细胞组分的不同部位,如细胞内、细胞核、细胞器等。
从表5中可以看出,有氧运动下调miRNA的靶基因的分子功能与结合功能相关,如与核酸、蛋白质以及DNA的结合等;靶基因参与的生物过程主要是细胞内过程、基因表达过程以及核酸代谢过程等;靶基因编码的蛋白定位于细胞组分的不同部位,如细胞器等。
3.1 8周有氧运动对小鼠骨骼肌miRNA表达的影响
在本研究中,8周的有氧运动引起44个miRNA的表达水平升高,14个miRNA的表达水平降低。运动上调表达的miRNA中,miR-1的表达水平最高,为对照组的100.92倍。在C2C12细胞中,miR-1可通过靶向组蛋白去乙酰化酶4(HDAC 4)促进肌肉的发育[2]。肌肉活检实验发现,在人骨骼肌细胞分化的过程中,miR-1的表达水平显著升高,提示miR-1在人骨骼肌细胞的分化过程中发挥重要作用[10]。在急性有氧运动干预的实验中,Safdar等人发现,急性有氧运动可以上调小鼠骨骼肌内miR-1的表达水平[8]。Nielsen等人研究发现,人骨骼肌中的miR-1在急性有氧训练后的表达水平升高,但在12周高强度有氧运动后,miR-1的表达水平下调[11]。MiR-1是myomiRs中的一种,常见的myomiRs还包括miR-133、miR-206、miR-208以及miR-499等[1]。但本研究中未发现miR-133、 miR-206 和 miR-208的表达水平显著变化。除此外,本研究还首次发现有氧运动可引起小鼠骨骼肌中miR-17、miR-19、miR-27等非myomiRs的差异表达上调,表明这些miRNA在有氧运动介导的骨骼肌生理过程的调节中也起着重要作用。已有文献报道miR-17 、miR-19可调节C2C12细胞的增殖分化[12]。MiR-27a可以通过抑制PPARγ基因的表达而抑制骨骼肌的胰岛素抵抗[13],且MiR-27a还与骨骼肌肥大或糖脂代谢调节相关[14-15]。
在运动下调表达的miRNA中,仅有miR-744[16]、miR-486[17]和miR-425-3p[18]有报道与骨骼肌的增殖分化和肌肉肥大相关,它们都属于非myomiRs。
3.2 差异表达miRNA的靶基因预测及生物功能分析
MiRNA的靶基因预测及生物功能分析表明,无论是上调的miRNA还是下调的miRNA,在分子功能上都与大分子(核酸、蛋白质)或离子(金属离子、阳离子)的结合有关,进而可能会影响转录活性及激酶活性。已有研究发现运动可以增加肌细胞增强因子2A基因(MEF2A)与小鼠骨骼肌中肉毒碱棕榈酰基转移酶1b基因(Cpt1b)启动子的结合[19],MEF2A是肌生成过程中重要的转录因子,参与骨骼肌发育及再生。而Mef2a(编码MEF2A蛋白)正是本研究预测差异表达miR-101a-3p、miR-106a-5p、miR-17-5p、miR-190a-5p、miR-20b-5p等的共同靶基因。Cpt1b基因编码的CPT蛋白是骨骼肌线粒体脂肪酸β-氧化过程中重要的限速酶,提示在有氧运动中引起的这些差异表达的miRNAs可能参与了骨骼肌的能量代谢过程。另外,运动还可以影响MEF2A与葡萄糖转运体(Glut4)的结合,进而影响葡萄糖的转运[20]。
在运动影响激酶表达的研究中,已发现有氧运动可上调蛋白激酶B(PKB/Akt)的mRNA和蛋白表达,进而影响骨骼肌的生理过程[21]。本研究预测结果显示,miR-1187、miR-19b-3p、miR-744-5p等均靶向Akt基因,提示这些miRNAs可能参与了运动影响Akt表达的调控。
3.3 差异表达miRNA的调控通路分析
从本研究中可以看到,在有氧运动上/下调miRNA介导的信号通路中,丝裂原活化蛋白激酶(MAPK)和Wnt信号通路是共同的调节通路,这也是目前研究相对较多的与骨骼肌生长发育相关的通路。
MAPK信號通路是细胞内的一个蛋白链,可将信号传递至细胞核DNA,调控基因表达。MAPK在细胞增殖、分化、凋亡与存活中均发挥作用[22] 。运动能够激活MAPK通路,促进通路中的ERK1/2、p38、和JNK表达,被认为是运动对细胞的应激反应[23]。Sylvius等人采用生物信息学方法分析表明,肌营养不良患者骨骼肌中差异表达miRNA(miR-148a、miR-335和miR-136等)可能通过MAPK通路调节骨骼肌的修复[24]。然而,目前仍缺乏运动骨骼肌中miRNA对MAPK信号通路调节的研究。从本研究中差异表达的miRNA调控通路分析结果显示, miR-340-5p、miR-106a-5p、miR-29a-5p等14个miRNA可通过靶向Mapk、Sos2等基因对骨骼肌MAPK信号通路产生影响。有氧运动可能介导miRNA靶向MAPK信号通路,从而引起骨骼肌生理功能改变。运动-miRNA-MAPK通路可能是运动引起骨骼肌重塑的机制之一,但仍需要进一步的实验验证。
在目前已有的实验性研究中,miRNA对Wnt信号通路的调节多集中于癌症研究,如miR-340通过靶向Wnt途径抑制乳腺癌细胞的迁移、侵袭和转移[25]。miR-199a-5p通过靶向Wnt2信号通路调节平滑肌细胞的增殖和形态学改变 [26]。零星的数据显示,miRNA可通过Wnt信号通路发挥对骨骼肌细胞生长发育的调控作用。研究表明,miR-139-5p可通过抑制Wnt信号通路而促进C2C12细胞的生成[27],但在本研究中没有发现运动引起miR-139-5p的差异表达。另外,在我们的分析结果中发现,有氧运动引起了miR-199a-5p、miR-340-5p、miR-376b-5p、miR-106a-5p等miRNA的差异表达变化,并且发现这些miRNA均可靶向调控Wnt通路。
此外,雷帕霉素靶蛋白(mTOR)信号通路也可调控细胞的代谢、生长、增殖和存活[28],miRNA与mTOR信号通路的关系是目前研究miRNA的热点之一。Jia等人研究发现,在C2C12细胞分化阶段miR-199a呈现高表达,进而miR-199a可通过靶向IGF-1、mTOR等基因,发挥抑制肌细胞分化、促进肌细胞肥大的作用[29]。Wang在采用胍基乙酸诱导的骨骼肌增殖分化模型中发现,miR-133a-3p和 miR-1a-3p可以通过靶向Akt/mTOR/S6K信号通路促进成肌细胞分化和肌肉生长 [30]。运动通过mTOR信号通路调节小鼠骨骼肌蛋白质表达已被证实[31],并有研究发现mTOR信号通路参与了运动诱导的骨骼肌肥大[32],本研究的结果分析显示,有氧运动引起的差异表达miRNAs中有miR-340-5p、miR-148b-3p、miR-425-5p 等14个miRNAs可以调控mTOR信号通路,其中miR-486被实验验证可以通过mTOR信号通路调节骨骼肌纤维的大小[17]。然而,运动介导miRNA对mTOR信号通路的调节作用机制并不十分清楚。
除上述三个通路外,目前文献缺乏对本研究中列举的受差异表达miRNA调控的其他信号通路与这些miRNA关系的研究报道。揭示运动、miRNA与这些通路之间的关系,还有许多工作要做。
4 结论
8周有氧运动引起骨骼肌内miRNA的差异表达;差异表达miRNA的生物功能涵盖基因表达调控、代谢调控等众多生物功能;有氧运动引起差异表达miRNAs可能通过靶向MAPK信号通路、Wnt信号通路和mTOR信号通路等调控骨骼肌生长发育和生理生化过程。本研究可为后续研究有氧运动对骨骼肌生长发育和生理生化过程的影响机制提供方向。
参考文献:
[1]HORAK M, NOVAK J, BIENERTOVA-VASKU J. Muscle-specific microRNAs in skeletal muscle development[J]. Developmental biology, 2016, 410(1):1-13.
[2]Chen J F, MANDEL E M, THOMSON J M, et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nature genetics, 2006, 38(2):228-233.
[3]Dai Y, Wang Y M, Zhang W R, et al. The role of microRNA-1 and microRNA-206 in the proliferation and differentiation of bovine skeletal muscle satellite cells[J]. In vitro cellular & developmental biology Animal, 2016, 52(1):27-34.
[4]BARTEL D P. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[5]THEILEN N T, KUNKEL G H, TYAGI S C. The Role of Exercise and TFAM in Preventing Skeletal Muscle Atrophy[J]. Journal of cellular physiology, 2017, 232(9):2348-2358.
[6]SOUZA R W, PIEDADE W P, SOARES L C, et al. Aerobic exercise training prevents heart failure-induced skeletal muscle atrophy by anti-catabolic, but not anabolic actions[J]. PloS one, 2014, 9(10):e110020.
[7]MCGLORY C, PHILLIPS S M. Exercise and the Regulation of Skeletal Muscle Hypertrophy[J]. Progress in molecular biology and translational science, 2015(135):153-173.
[8]SAFDAR A, ABADI A, AKHTAR M, et al. miRNA in the regulation of skeletal muscle adaptation to acute endurance exercise in C57Bl/6J male mice[J]. PloS one, 2009, 4(5):e5610.
[9]Gong H,Xie J,Zhang N,et al.MEF2A binding to the Glut4 promoter occurs via an AMPKalpha2-dependent mechanism[J].Medicine and science in sports and exercise,2011,43(8):1441-1450.
[10]KOUTSOULIDOU A,MASTROYIANNOPOULOS N P,FURLING D,et al.Expression of miR-1, miR-133a, miR-133b and miR-206 increases during development of human skeletal muscle[J]. BMC developmental biology, 2011, 11(34):1-9.
[11]NIELSEN S, SCHEELE C, YFANTI C, et al. Muscle specific microRNAs are regulated by endurance exercise in human skeletal muscle[J]. The Journal of physiology, 2010, 588(Pt 20):4029-4037.
[12]Kong D, He M, Yang L, et al. MiR-17 and miR-19 cooperatively promote skeletal muscle cell differentiation[J]. Cellular and molecular life sciences :CMLS, 2019,
[13]Yu Y, Du H, Wei S, et al. Adipocyte-Derived Exosomal MiR-27a Induces Insulin Resistance in Skeletal Muscle Through Repression of PPARgamma[J]. Theranostics, 2018, 8(8):2171-2188.
[14]HERNANDEZ-TORRES F, ARANEGA A E, FRANCO D. Identification of regulatory elements directing miR-23a-miR-27a-miR-24-2 transcriptional regulation in response to muscle hypertrophic stimuli[J]. Biochimica et biophysica acta, 2014, 1839(9):885-897.
[15]CHEMELLO F, GRESPI F, ZULIAN A, et al. Transcriptomic Analysis of Single Isolated Myofibers Identifies miR-27a-3p and miR-142-3p as Regulators of Metabolism in Skeletal Muscle[J]. Cell reports, 2019, 26(13):3784-3797 e8.
[16]Peng S, Song C, Li H, et al. Circular RNA SNX29 Sponges miR-744 to Regulate Proliferation and Differentiation of Myoblasts by Activating the Wnt5a/Ca(2+) Signaling Pathway[J]. Molecular therapy Nucleic acids, 2019(16):481-493.
[17]HITACHI K, NAKATANI M, TSUCHIDA K. Myostatin signaling regulates Akt activity via the regulation of miR-486 expression[J]. The international journal of biochemistry & cell biology, 2014(47):93-103.
[18]JAVED R, Jing L, Yang J, et al. miRNA transcriptome of hypertrophic skeletal muscle with overexpressed myostatin propeptide[J]. BioMed research international, 2014(2014):328935.
[19]Yuan H, Niu Y, Liu X, et al. Exercise increases the binding of MEF2A to the Cpt1b promoter in mouse skeletal muscle[J]. Acta physiologica, 2014, 212(4):283-292.
[20]JOSEPH J S, AYELESO A O, MUKWEVHO E. Exercise increases hyper-acetylation of histones on the Cis-element of NRF-1 binding to the Mef2a promoter:Implications on type 2 diabetes[J]. Biochemical and biophysical research communications, 2017, 486(1):83-87.
[21]SUHR F, BRENIG J, MULLER R, et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway[J]. PloS one, 2012, 7(9):e45982.
[22]ARTHUR J S, LEY S C. Mitogen-activated protein kinases in innate immunity[J]. Nature reviews Immunology, 2013, 13(9):679-692.
[23]GOODYEAR L J, CHANG P Y, SHERWOOD D J, et al. Effects of exercise and insulin on mitogen-activated protein kinase signaling pathways in rat skeletal muscle[J]. The American journal of physiology, 1996, 271(2 Pt 1):E403-408.
[24]SYLVIUS N, BONNE G, STRAATMAN K, et al. MicroRNA expression profiling in patients with lamin A/C-associated muscular dystrophy[J]. FASEB journal :official publication of the Federation of American Societies for Experimental Biology, 2011, 25(11):3966-3978.
[25]Shi S, Chen X, Liu H, et al. LGR5 acts as a target of miR-340-5p in the suppression of cell progression and drug resistance in breast cancer via Wnt/beta-catenin pathway[J]. Gene, 2019,(683):47-53.
[26]HASHEMI GHEINANI A, BURKHARD F C, REHRAUER H, et al. MicroRNA MiR-199a-5p regulates smooth muscle cell proliferation and morphology by targeting WNT2 signaling pathway[J]. The Journal of biological chemistry, 2015, 290(11):7067-7086.
[27]Mi L, Li Y, Zhang Q, et al. MicroRNA-139-5p regulates C2C12 cell myogenesis through blocking Wnt/beta-catenin signaling pathway[J]. Biochemistry and cell biology = Biochimie et biologie cellulaire, 2015, 93(1):8-15.
[28]LAPLANTE M, SABATINI D M. mTOR signaling at a glance[J]. Journal of cell science, 2009, 122(Pt 20):3589-3594.
[29]Jia L, Li Y F, Wu G F, et al. MiRNA-199a-3p regulates C2C12 myoblast differentiation through IGF-1/AKT/mTOR signal pathway[J]. International journal of molecular sciences, 2013, 15(1):296-308.
[30]Wang Y, Ma J, Qiu W, et al. Guanidinoacetic Acid Regulates Myogenic Differentiation and Muscle Growth Through miR-133a-3p and miR-1a-3p Co-mediated Akt/mTOR/S6K Signaling Pathway[J]. International journal of molecular sciences, 2018, 19(9).
[31]WILLIAMSON D L, KUBICA N, KIMBALL S R, et al. Exercise-induced alterations in extracellular signal-regulated kinase 1/2 and mammalian target of rapamycin (mTOR) signalling to regulatory mechanisms of mRNA translation in mouse muscle[J]. The Journal of physiology, 2006, 573(Pt 2):497-510.
[32]Zeng F, Zhao H, Liao J. Androgen interacts with exercise through the mTOR pathway to induce skeletal muscle hypertrophy[J]. Biology of sport, 2017, 34(4):313-321.
