“冷分解—正浮选”5万t/a氯化钾的工艺技术研究
2020-06-26贾生学
贾生学
(青海盐湖工业股份有限公司,青海 格尔木 816099)
1 前言
我国作为农业大国,钾肥是农业三大肥料之一,对绝大多数作物都有增产效果。钾资源主要分布在青海省察尔汗盐湖,储量约占全国的97%,其表面储量约1.45亿t,工业储量达0.97亿t,大规模地开发该盐湖生产氯化钾,不但可以缓解国内钾肥市场的供需矛盾,同时可以节省大量外汇。目前,国内盐田生产氯化钾的主要方法有正浮选法、反浮选法及兑卤法。而“冷分解—正浮选—洗涤法”是其中的一种传统工艺。该法生产氯化钾的历史从20世纪30年代开始,因其工艺过程自始至终在常温下进行,工艺条件温和,所以几十年来得到了长足的发展。立足本国的钾盐资源,因地制宜,寻求好的氯化钾生产方法是很有意义的。
研究只考虑生产单一氯化钾产品,按照研究确定的生产工艺,5万t/a氯化钾,生产出的成品氯化钾质量大于93%。
2 研究原理
(1)光卤石(KCl·MgCl2·6H2O)是一种能稳定存在于很大温度范围内(-21 ℃~167.65 ℃)的复盐,其溶于水时的反应主要为:

不同温度下NaCl、KCl、MgCl2的溶解度见表1。
从表1可知,氯化镁在10 ℃低温下的溶解度为53.50%,在100℃的热水中为72.70%,而氯化钠在同温冷水中为35.70%,在同温热水中为39.20%;氯化钾在同温冷水中为31.30%,在同温热水中为56.20%。可见,常温下光卤石中氯化镁的溶解度随着温度升高而增大,且比氯化钠、氯化钾在同温度下的溶解度都大得多,氯化钠和氯化钾在冷水中的溶解度相近,在温度升高时氯化钾的溶解度急剧增加,氯化钠的溶解度则增加甚微。

表1 不同温度下KCl、NaCl与MgCl2的溶解度Tab.1 Solubility of KCl, NaCl and MgCl2 at different temperatures
因此,加工光卤石的原理基于以下两点:KCl与MgCl2的溶解度小得多;饱和光卤石的溶液中MgCl2/KCl (摩尔比)值远大于1。
(2)冷分解—正浮选。用淡水将光卤石矿冷分解,使氯化镁进入溶液,然后在高镁母液的介质中,以盐酸十八胺做捕收剂,二号油做起泡剂,对分解料浆进行浮选,得到的精矿过滤后,用少量淡水洗去氯化钠,所得产品纯度可达尾盐中的氯化钾含量小于3%。
(3)正浮选法生产氯化钾的主要优点:工艺可靠。由于该工艺的开发与研究较早,经过多年来的不断完善,工艺流程已趋于成熟;工艺流程简单。“冷分解—浮选法”工艺主要可以分两步:一是光卤石的冷分解;二是分解料浆的浮选。以盐酸十八胺作捕收剂,二号油作气泡剂浮选出氯化钾,实现氯化钾与氯化钠分离,所得粗钾产品再经洗涤、干燥即得氯化钾产品。
3 生产流程介绍
用“冷分解—正浮选”生产氯化钾可分为冷分解、浮选及分离、真空过滤、洗涤、离心分离、干燥及产品包装等六个工序。
经过相图分析(见图1),可以得到含钠光卤石为原料制取氯化钾的原则流程。运用相图知识以“冷分解—正浮选”制取氯化钾的生产过程进行分析。原料含钠光卤石组成见表2。

表2 原料含钠光卤石的组成Tab.2 Composition of carnallite containing sodium in raw material %
将原料含钠光卤石系统组成点标绘在图中为M(M0),显然从相图中可以知道原料M(M0)是由大量的含钠光卤石R(R′)固相与其共饱F(F′)的共饱液所组成,整个工艺流程可用相图分为七个阶段。

图1 冷分解—正浮选在该工艺中的相图分析—Na+、K+、Mg2+∥Cl-—H2O(25 ℃)四元水盐体系相图Fig.1 Phase diagram analysis of cold decompositive positive flotation in this process-phase diagram of Na+, K+,Mg2+∥Cl-—H2O(25 ℃)
第一阶段,原料M(M0)加水恰好完全分解(简称冷分解)。若对原料M(M0)加水使其中Car的恰好完全分解,则在干基图上,先是固相点从R运行到Q点,与之相对应的液相点从F运行到E点,系统点在M点不变;在水图上,先是固相点由R′运行到Q′,液相点由F′运行到E′,系统点由M0运行到点M1;继而固相点由Q′运行到H′,而液相点在E′不动,系统点由M1运行到点M2。
此阶段为第一次加水过程,加水量为恰好使原料M(M0)中的Car完全分解。
第二阶段,对钾石盐H(H′)进行浮选及对相应产物进行分离(简称浮选及分离)。经过第一阶段可以得到钾石盐H(H′)及与之对应的共饱液E(E′),若对其进行分离,理论上可以得到钾石盐H(H′),但是若对分离出来的钾石盐H(H′)在常温加水进行溶洗其中的NaCl,由相图分析可知,最终是得不到固相KCl,得到的是固相NaCl。又由相图分析可知,对钾石盐在常温下加水溶洗其中的NaCl可得到固相KCl。该钾石盐固相点不能处在之AD间,而只能处在BD之间,为达到此目的,使用浮选手段可以解决这个问题,浮选介质是第一阶段得到的高镁母液E(E′),浮选药剂是盐酸十八胺及二号油。经过浮选,固相钾石盐H(H′)变成了粗钾I(I′)及尾盐J(J′)。

第四阶段,将粗钾泡沫K(K′)中的固相粗钾I(I′)与其对应的共饱液E(E′)进行分离(简称真空过滤)。寻求一种固液分离设备如转筒真空过滤机,使其对粗钾泡沫K(K′)进行固液分离。若固液分离效率能达到100%,则对K(K′)进行固液分离之后,固相为粗钾(I′),则液相为与之对应的共饱液E(E′),但往往转筒过滤机的分离效率达不到100%,因此假如知道转筒过滤机的分离效率时,则依此效率可在相图上找到粗钾泡沫K(K′)分离后的滤饼点N(N0)及与之对应的共饱点E(E′),其中为K(K′)系统点。此阶段为第二次分离过程,使得滤饼N(N0)与其对应的共饱液E(E′)分离。
第五阶段,洗涤滤饼N(N0)中的NaCl (简称洗涤)。由相图分析可知,滤饼N(N0)是由粗钾I(I′)及与之对应的共饱液E(E′)所组成,当对其加适量水时,固相I(I′)则由运行至B(B′),而液相E(E′)则由运行至O(O′),在干基图上系统点在N0不变,在水图上系统点则由N0运行至N1。此阶段为第二次加水过程,加水量恰好使I(I′)中的NaCl溶洗尽,得到洗涤浆料N(N1) 。
第六阶段,将洗涤浆料N(N1)中的固相KClB(B′)与其对应的共饱液O(O′)进行分离(简称离心分离)。寻求一种固液分离设备如离心机,使其对洗涤浆料N(N1)进行固液分离,若是固液分离效率能达到100%,则对N(N1)进行固液分离后,固相为纯钾B(B′),则液相为与之对应的共饱液O(O′),但往往离心机的分离效率达不到100%,因此假如知道离心机的分离效率时,则依此效率可在相图上找到对洗涤浆料N(N1)分离后的固相精钾点P(P′)及与之对应的共饱液点O(O′),其中N(N1)为系统点。此阶段为第三次分离过程,使得精钾P(P′)与其对应的共饱液O(O′)分离。
第七阶段,精钾在干燥设备中除去所含水分,即得到成品产品(简称干燥)。
由相图分析可知,精钾P(P′)是由纯钾B(B′)与其对应的共饱液O(O′)所组成。由于该相图是25 ℃时的相图,干燥过程的温度很高,加之干燥过程的相图分析过程比较简单,所以略去干燥阶段的相图分析过程。经过相图分析,可得出由含钠光卤石生产氯化钾的原则流程,如图2。
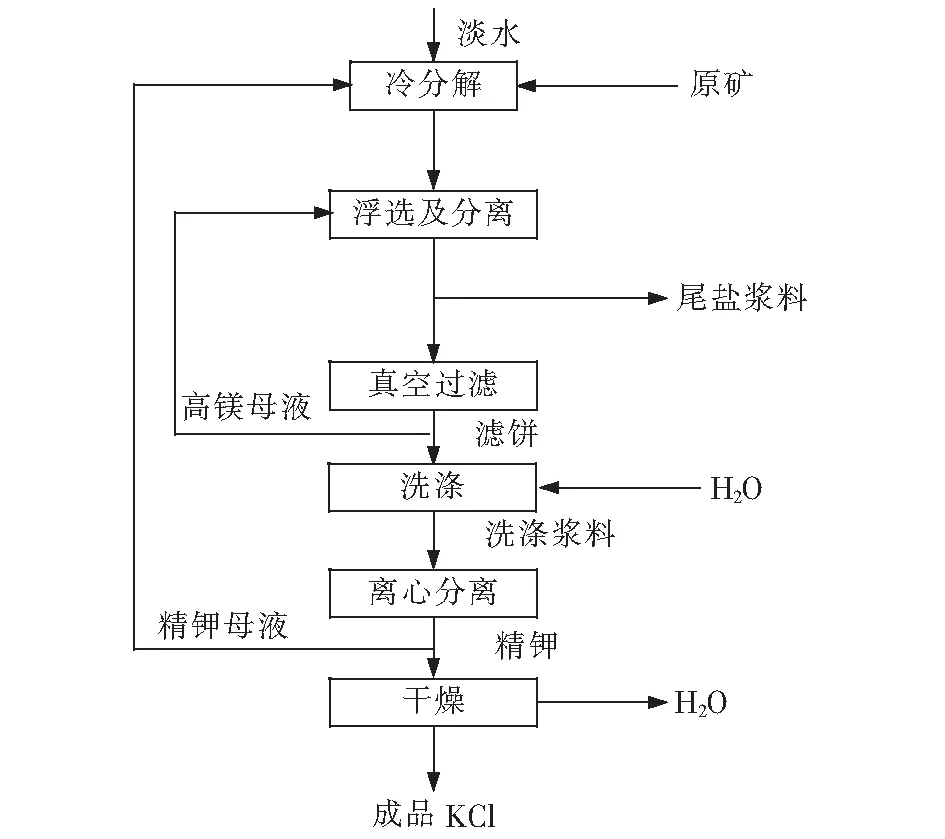
图2 含钠光卤石制取氯化钾的工艺流程Fig.2 Technological process of producing KCl from carnallite containing sodium
3 小结
通过研究发现,相图与流程图的对应关系,使得KCl制备的工艺流程通过相图获得,物料组成点在相图上可准确表达,进行物料衡算时直观快捷、结果准确。其次,含钠光卤石分解回收率最高,单位氯化钾产量分解耗水量相对较少,与其他光卤石相比,经济效益最好。
