早期肠内营养支持联合阿托伐他汀对缺血性脑卒中患者神经功能恢复及免疫功能的影响
2020-06-25韩刚刘娟娟李转霞
韩刚,刘娟娟,李转霞
延安大学附属医院心脑血管病医院神经重症医学科1、综合内科2,陕西 延安 716000
缺血性脑卒中(ischemic stroke)是致残率与致死率均较高的常见脑血管疾病,患者常伴有高血压、高血脂等慢性疾病,能够诱发脑血栓形成,使脑组织持续缺血,损伤局部脑组织或全脑功能[1]。该疾病具有起病急、发病快等特点,若不进行及时治疗,即使生命得以挽回,患者也常出现偏瘫、认知及语言功能障碍等后遗症,给家庭及社会带来沉重负担[2]。目前临床主要采用降血压、预防血栓形成等方法作为基础治疗手段,并结合脑组织功能康复干预[3]。脑卒中患者常具有进食障碍,易出现不同程度的营养不良及免疫功能低下,导致机体出现代谢、生理及病理变化,加重营养不良现象及免疫功能障碍[4]。肠内营养支持能够给予患者早期康复所需的营养,阿托伐他汀是治疗缺血性脑卒中的常用药物,安全性较高[5]。本研究联合应用早期肠内营养支持及阿托伐他汀治疗缺血性脑卒中,探究其对患者神经功能恢复及免疫功能的影响:
1 资料与方法
1.1 一般资料 选取 2018 年 2 月至 2019 年 2 月期间延安大学附属医院心脑血管病医院收治的缺血性脑卒中患者82例,采用随机数表法均分为观察组和对照组各41例。两组患者的性别、年龄、病程、TOSAT分型等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会批准,患者及其家属知情且签署知情同意书。
表1 两组患者的一般资料比较,例(%)]

表1 两组患者的一般资料比较,例(%)]
组别 例数 性别 年龄(岁)病程(d)TOSAT分型男 女观察组对照组Z/t/χ2值P值41 41 22(53.66)21(51.22)19(46.34)20(48.78)0.049 0.825 58.09±9.93 58.84±9.41 0.351 0.727 1.80±0.53 1.89±0.47 0.814 0.418大动脉粥样硬化型卒中14(34.15)13(31.71)小动脉闭塞性卒中16(39.02)15(36.59)心源性脑栓塞6(14.63)7(17.07)不明原因的缺血性卒中5(12.20)6(14.63)0.410 0.682
1.2 病例选择 纳入标准:①经过CT 及MRI 检测,符合缺血性脑卒中诊断标准[6]者;②首次发病者;③发病后3 d 之内就诊者。排除标准:①肝肾功能不全及凝血功能障碍者;②严重心脏病及及免疫缺陷者;③慢性炎症者;④对本研究所用药物过敏或具有过敏史者;⑤精神性疾病者。
1.3 治疗方法 所有患者均给予常规对症治疗,包括营养神经、降压、清除自由基、抗血小板、改善脑水肿等,所用药物包括阿司匹林、尼莫地平、甘露醇、维生素C及脑二磷胆碱。对照组同时给予服用阿托伐他汀(生产企业:辉瑞制药有限公司,规格:20 mg,国药准字:H20051408)20 mg/次,每晚1次;发病后3~5 d开始鼻饲流汁,逐渐过渡到正常饮食。观察组与对照组一样给予服用阿托伐他汀,同时依据病情、体重及营养状态给予肠内营养混悬液[生产企业:纽迪希亚制药(无锡)有限公司,规格:0.75 kcal/mL×500 mL,国药准字:H20103536]25~35 kcal/(kg·d)通过鼻饲管滴注,首次使用速率为40~60 mL/h,全天总量<2 000 mL。两组疗程均为14 d。
1.4 观察指标与检测方法 治疗前及治疗14 d后测定以下指标:①免疫功能:采用酶联免疫吸附(ELISA)法免疫球蛋白G(IgG)、IgM、IgA 水平。②炎症相关因子:采集患者清晨空腹静脉血,以3 200 r/min的速度离心10 min,取上清液,采用ELISA 法测定肿瘤坏死因子(TNF-α)、白细胞介素-6 (IL-6)、IL-8 水平。③卒中相关因子:采用ELISA 法测定S-100β、淀粉样蛋白A(SAA)、脂蛋白相关磷脂酶A2(Lp-PLA2)水平。④神经功能:采用美国国立卫生院卒中量表(NIHSS)[7]进行评价,该量表总分范围为0~42分,得分越高代表神经功能缺损越严重。
1.5 疗效评价标准 参照美国NIHSS 标准[7],治愈:治疗后NIHSS 评分较治疗前减少≥90%;显效:治疗后NIHSS 评分较治疗前减少46%~89%;有效:治疗后NIHSS 评分较治疗前减少16%~45%;无效:治疗后NIHSS 评分较治疗前减少≤15%。显效率=(治愈+显效)/总例数×100%。
1.6 统计学方法 应用SPSS19.0 软件分析数据,计数资料以率(%)表示,组间比较采用χ2检验,等级资料比较采用秩和检验,计量资料符合正态分布且方差齐性,以均数±标准差表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。P为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的治疗效果比较 治疗后,两组患者的治疗效果比较差异无统计学意义(P>0.05),见表2。

表2 两组患者的治疗效果比较[例(%)]
2.2 两组患者治疗前后的神经功能比较 治疗前,观察组患者的NIHSS 评分为(14.83±1.17)分,与对照组的(14.76±1.25)分比较差异无统计学意义(t=0.262,P=0.794>0.05)。治疗后,观察组患者的NIHSS评分为(8.43±0.83)分,对照组为(8.71±0.88)分,两组患者的NIHSS评分均较治疗前明显下降,差异均有统计学意义(t=40.980、36.375,P=0.000<0.05),但治疗后,两组患者的NIHSS 评分比较差异无统计学意义(t=1.482,P=0.142>0.05)。
2.3 两组患者治疗前后的免疫功能水平比较 治疗后,两组患者的IgG水平均较治疗前明显下降,且观察组明显低于对照组,IgM、IgA 水平均较治疗前明显上升,且观察组明显高于对照组,差异均有统计学意义(P<0.05),见表3。
2.4 两组患者治疗前后的炎症相关因子水平比较 治疗后,两组患者的血清TNF-α、IL-6、IL-8水平均较治疗前明显下降,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表3 两组患者治疗前后的IgG、IgM、IgA水平比较
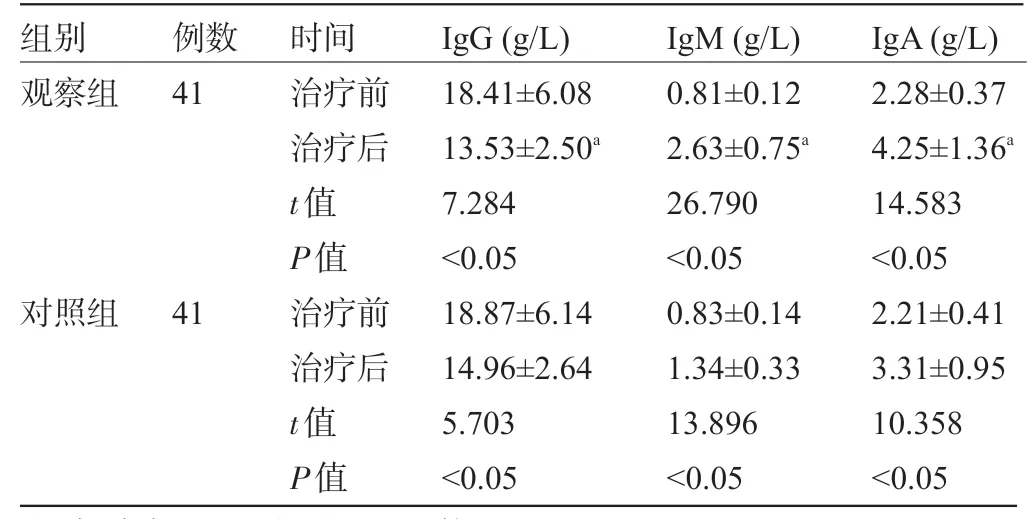
表3 两组患者治疗前后的IgG、IgM、IgA水平比较
注:与治疗14 d后的对照组比较,aP<0.05。
组别观察组例数41对照组41时间治疗前治疗后t值P值治疗前治疗后t值P值IgG(g/L)18.41±6.08 13.53±2.50a 7.284<0.05 18.87±6.14 14.96±2.64 5.703<0.05 IgM(g/L)0.81±0.12 2.63±0.75a 26.790<0.05 0.83±0.14 1.34±0.33 13.896<0.05 IgA(g/L)2.28±0.37 4.25±1.36a 14.583<0.05 2.21±0.41 3.31±0.95 10.358<0.05
表4 两组患者治疗前后的TNF-α、IL-6、IL-8水平比较
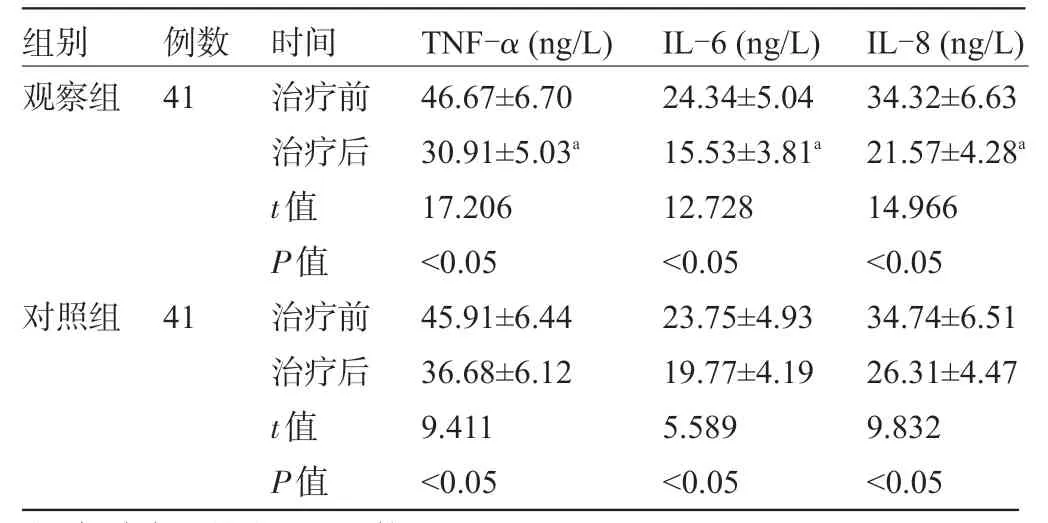
表4 两组患者治疗前后的TNF-α、IL-6、IL-8水平比较
注:与治疗后的对照组比较,aP<0.05。
组别观察组例数41对照组41时间治疗前治疗后t值P值治疗前治疗后t值P值TNF-α(ng/L)46.67±6.70 30.91±5.03a 17.206<0.05 45.91±6.44 36.68±6.12 9.411<0.05 IL-6(ng/L)24.34±5.04 15.53±3.81a 12.728<0.05 23.75±4.93 19.77±4.19 5.589<0.05 IL-8(ng/L)34.32±6.63 21.57±4.28a 14.966<0.05 34.74±6.51 26.31±4.47 9.832<0.05
2.5 两组患者治疗前后的卒中相关因子比较 治疗后,两组患者的S-100β、SAA、Lp-PLA2水平均较治疗前明显下降,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的S-100β、SAA、Lp-PLA2水平比较

表5 两组患者治疗前后的S-100β、SAA、Lp-PLA2水平比较
注:与治疗后的对照组比较,aP<0.05。
组别观察组例数41对照组41时间治疗前治疗后t值P值治疗前治疗后t值P值S-100β(ng/L)307.66±43.70 140.94±36.03a 26.779<0.05 315.81±42.48 206.68±41.16 16.709<0.05 SAA(mg/L)17.64±5.04 9.73±4.81a 10.284<0.05 17.75±5.13 13.88±5.19 4.802<0.05 Lp-PLA2(mg/L)165.62±10.93 142.07±5.88a 17.941<0.05 165.74±10.51 146.94±6.87 13.853<0.05
3 讨论
目前,缺血性脑卒中已成为威胁人类健康及生命的主要疾病之一,具有高发病率、高致残率及高致死率的特点[8]。对于病情较为危重的患者而言,脑部出血及梗死面积较大会导致机体多种机能的减退,往往并发营养不良等不良反应,影响临床恢复。因而采取相应措施改善缺血性脑卒中患者营养状态对其预后改善具有积极影响。
研究证实,他汀类药物是心脑血管疾病的一、二级预防药物,能够降低血脂,抑制炎症反应及动脉粥样硬化,恢复神经功能缺损,使患者预后得以改善[9]。阿托伐他汀作为常用的他汀类药物之一,不仅具有调脂作用,同时能够抑制平滑肌细胞增生,并促进其凋亡,改善局部脑血流循环障碍,减小不稳定斑块体积,调节不稳定斑块导致的炎症反应,以此达到稳定斑块、降低机体炎性反应的作用[10]。因此本研究中两组应用了阿托伐他汀的患者均取得显著疗效,其治疗后临床有效率及神经功能比较无明显差异,同时也可能是因为观察组应用的早期肠内营养支持只能间接影响神经功能康复,并不能直接对患者病情产生直观的较大影响。
以往有观点认为,脑卒中患者早期胃动力减退,鼻饲易发生反流或误吸,故早期营养支持大多主张肠外营养支持[11]。但近年研究表明,单纯的肠外营养支持会对胃肠道产生刺激,降低肠黏膜屏障作用,使其发生萎缩,进而导致全身炎性反应。并且肠外营养支持会加重患者静脉输液量负担,不利于脑水肿缓解[12]。而肠内营养支持具有改善胃肠道及肝脏血液循环等优点,促进消化道功能恢复,且不损害肠黏膜屏障。脑卒中患者大多具有免疫功能下降的现象,影响预后,本研究结果显示观察组治疗后炎症相关因子水平明显低于对照组,可能是因为肠道是机体最大的免疫调节器官,与机体免疫功能具有密切联系,而肠内营养制剂对患者肠道黏膜有免疫调节作用,维持肠黏膜屏障,激活肠道神经内分泌免疫轴,因此机体免疫功能较好。此外,肠内营养制剂各成分能够调节肠道菌群,增强肠道黏膜屏障功能,发挥抗炎效果。
S-100β是一种存在于中枢神经胶质细胞中的酸性钙结合蛋白,机体正常情况下血液循环中浓度非常低,但脑组织受到损伤时S-100β能够通过被损伤的血脑屏障进入外周血液循环中,因此可作为脑损伤的重要标志物[13]。有研究显示,作为急性炎症反应标志物的SAA参与粥样硬化斑块的形成及发展,且在急性缺血性脑卒中患者体内水平明显增高[14]。SAA 能够激活巨噬细胞及神经胶质细胞上的Toll 样受体-2、Toll样受体-4,活化巨噬细胞及神经胶质细胞,释放引起炎症反应及参与免疫调节的细胞因子,以此促进缺血性脑卒中的发展。Lp-PLA2 是一种丝氨酸蛋白酶,与动脉粥样硬化及缺血心脑血管疾病密切相关[15]。外周血中的Lp-PLA2主要与LDL结合,能够水解OX-LDL生成促进炎症发生的物质,同时促进单核细胞转化为泡沫细胞,泡沫细胞可聚集成为斑块,加速动脉硬化进展,并且这种斑块能够降解平滑肌细胞及基质,破坏不稳定斑块,形成血栓。本研究结果显示,观察组患者治疗后的S-100β、SAA、Lp-PLA2 水平下降幅度均较对照组大,可能是因为阿托伐他汀及肠内营养支持均可降低机体炎症反应,因此SAA 水平降低,存在于由SAA 激活的神经胶质细胞中的S-100β水平也随之降低;而阿托伐他汀具有良好降脂作用,减少Lp-PLA2与LDL结合,进而降低Lp-PLA2水平。
综上所述,早期肠内营养支持联合阿托伐他汀治疗缺血性脑卒中能够有效改善患者的神经功能及免疫功能,减轻机体炎症反应,临床应用效果显著。
