基于网络药理学探讨四妙丸治疗骨关节炎的作用机制
2020-06-24吴越刘维
吴越 刘维

摘要 目的:采用网络平台药理学的研究方法,对四妙丸(SMW)用于治疗骨关节炎(OA)的药理作用以及机制问题进行了研究和探讨。方法:主要通过在TCMSP网络平台对四妙丸进行活性药物成分的筛选、在DrugBank数据库的基础上进行了靶标的预测,应用Cytoscape 3.7.1软件构建了化合物-靶点数据分析网络;在TTD及DisGenet进行数据库的检索,获取了疾病的靶点;通过构建韦恩图,取得了疾病与活性药物作用靶点的交集,得到了四妙丸治疗OA的作用靶点;并对四妙丸进行了GO功能注释功能通路注释和KEGG通路富集分析;构建了四妙丸中药-成分-靶点-信号通路网络。结果:分析研究显示共挖掘到了四妙丸中64种共同作用成分及163个潜在共同作用靶点,OA疾病989个成分及相关共同作用靶点,得到四妙丸-疾病共同靶点18个,共同信号作用的靶点主要富集于34个生物过程和26条信号通路上。结论:四妙丸中药可能主要是通过调节PTGS2、TNF、AR等共同靶点,调控IL-17信号通路、TNF信号通路、松弛素、破骨细胞分化、松弛素等方式来抑制机体炎性反应,进一步调节机体免疫功能来治疗骨关节炎。
关键词 四妙丸;网络药理学;骨关节炎;靶点;信号通路
Mechanism of Simiao Pills in Treatment of Osteoarthritis Based on Network Pharmacology
WU Yue1,2,LIU Wei1,2
(1 First Teaching Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China; 2 Tianjin Key Laboratory of Traditional Chinese Medicine Formula and Syndrome Transformation Research,Tianjin 300193,China)
Abstract Objective:To study the mechanism of Simiao Pills in the treatment of osteoarthritis(OA),based on network pharmacology.Methods:By screening the active ingredients of Simiao Pills on TCMSP platform,the target in the database of drugbank was predicted.Cytoscape 3.7.1 software was used to construct the compound-target data analysis network; the database was searched in TTD and DisGenet to obtain the target of the disease; the Venn diagram was constructed to obtain the intersection of the target of the disease and the active drug.The target of Simiao Pill in the treatment of OA was obtained; GO function annotation functional pathway annotation and KEGG pathway enrichment analysis were performed on Simiao Pill; a network of Simiao Pill Chinese medicine-component-target-signaling pathway was constructed.Results:The research showed that 64 components and 163 potential targets in Simiao Pills,989 related targets in OA disease,and 18 common targets in Simiao Pills disease were obtained,which were mainly concentrated in 34 biological processes and 26 signal pathways.Conclusion:Simiao Pills may be used for the treatment of osteoarthritis by regulating PTGS2,TNF,AR and other targets,regulating IL-17 signaling pathway,TNF signaling pathway,relaxin,osteoclast differentiation and other pathways,so as to inhibit inflammatory response etc.
Keywords Simiao Pills; Network pharmacology; Osteoarthritis; Target; Signal pathway
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.23.012
骨关节炎(Osteoarthritis,OA)主要是以慢性软骨关节炎和软骨炎的局部病灶及慢性关节肌肉病变、软骨关节下骨肥厚和慢性关节局部边缘骨赘等为主要临床发病病理特征的慢性肢体关节疾病,常伴有局部肌肉疼痛或关节无力、韧带松弛、关节对线不良、轻度滑膜炎和关节半月板变性。2010年中国50岁以上的骨关节炎人口患病率达到25.3%[1],在60岁以上的骨关节炎人群中大约每年有5 000万人患有骨关节炎[2],预计随着亚洲人口年龄的进一步增长,亚洲骨关节炎患病率将进一步的上升,有相关研究人员预测,65岁以上人口的比例在未来30年将逐步翻番,从2008年的6.8%进一步上升甚至预计可能达到2040年的16.2%,使得社会的卫生保健以及教育事业的发展面临更严峻的挑战[3]。本病主要属于中医“痹症”“骨痹”范畴。现代的研究结果表明,本病的发生与代谢异常、机械功能损伤、肥胖、及基因遗传等一系列因素与有关[4-5]。我国现代医学对于OA的诊断和治疗主要目的是用于抗炎和调节骨代谢,常应用非甾体抗炎药、氨基葡萄糖、软骨素、局部注射皮质类固醇或透明质酸、外用制剂及手术等进行骨关节的治疗[6]。此外,关于骨关节炎的治疗,现代中医药不仅有传统辨证论治的特点,还有疗效独特且不良反应较小的优势。但目前四妙丸对于OA的具体药理作用和机制尚不明确,故严重限制了其临床有效应用和推广。
四妙丸源自《成方便读》,有清热利湿的作用和功效,方中以黄柏为君,苦寒沉降,善除下焦湿热。方中以苍术燥湿健脾和胃为臣。薏苡仁祛湿清热泻浊为佐。牛膝活血,亦可通调经络,善引药下行,为佐、使药。在OA中证属于湿热痹阻,临床中可根据病情灵活应用[7-8]。本研究基于网络药理学方法探讨四妙丸治疗OA的主要有效化合物、作用靶点、作用通路,从而进一步明确四妙丸治疗OA的具体作用机制,为OA的临床治疗提供可能的思路。
1 材料与方法
1.1 四妙丸的主要成分及作用靶点的筛选 通过中药系统药理学数据库(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)[9]检索出四妙丸中苍术、黄柏、牛膝、薏苡仁等4种中药的靶蛋白化合物。对靶蛋白化合物成分进行了筛选,其筛选的标准:中药口服生物利用度(OB)筛选的阈值为OB≥30,化合物类药性(DL)筛选的阈值为DL≥0.18。通过DrugBank(https://www.drugbank.ca/)[10]数据库对化合物进行靶点预测,剔除数据库不能预测到靶点的化合物,在Uniprot(https://www.uniprot.org/)[11]数据库中将预测出的作用靶蛋白名转换为作用靶点的简称,进行标准化的处理。
1.2 建立四妙丸化合物-靶点网络 对预测出的化合物名称进行编码以便于分析和作图。将化合物及其靶点数据输入至Cytoscape 3.7.1[12]中,从而建立了中药化合物—靶点网络;然后使用network analyzer工具进行网络分析,通过自由度(Degree)判定节点的重要性,越高则代表越重要。
1.3 获取骨关节炎疾病靶点 在Therapeutic Target Database(TTD)(https://db.idrblab.org/ttd/)[13]以及DisGenet(http://www.disgenet.org/web/DisGeNET/menu/search)[14]数据库中检索关键词“Osteoarthritis”,来获取骨关节炎疾病靶点。在Uniprot数据库中得到靶点的简称,从而对其进行了标准化,并构建骨关节炎疾病靶点的数据集。
1.4 筛选重要靶点及建立蛋白相互作用网络 运用Venny2.1作图平台(http://bioinfogp.cnb.csic.es/tools/venny/),通过映射四妙丸有效化合物的靶点和骨关节炎病靶来构建韦恩图。其共同靶点可能是四妙丸治疗骨关节炎的重要靶点。在STRING平台(https://string-db.org/)[15]导入所获取的共同靶点,构建蛋白-蛋白相互作用网络,生物种属选择“Homo sapiens”,网络参数设置为“molecular action”并将最低相互作用的阈值参数设置为“medium confidence”(>0.400),其他参数的设置保持默认。
1.5 重要靶点基因功能注释和通路富集分析 应用Cytoscape 3.7.1软件中的ClueGo插件[16]对共同靶点作GO功能注释和KEGG通路富集分析,取P≤0.05的结果进行可视化分析,从而得到四妙丸治疗骨关节炎可能的生物过程和信号通路。最后使用merge功能构建四妙丸化合物-靶点-信号通路网络。
2 结果
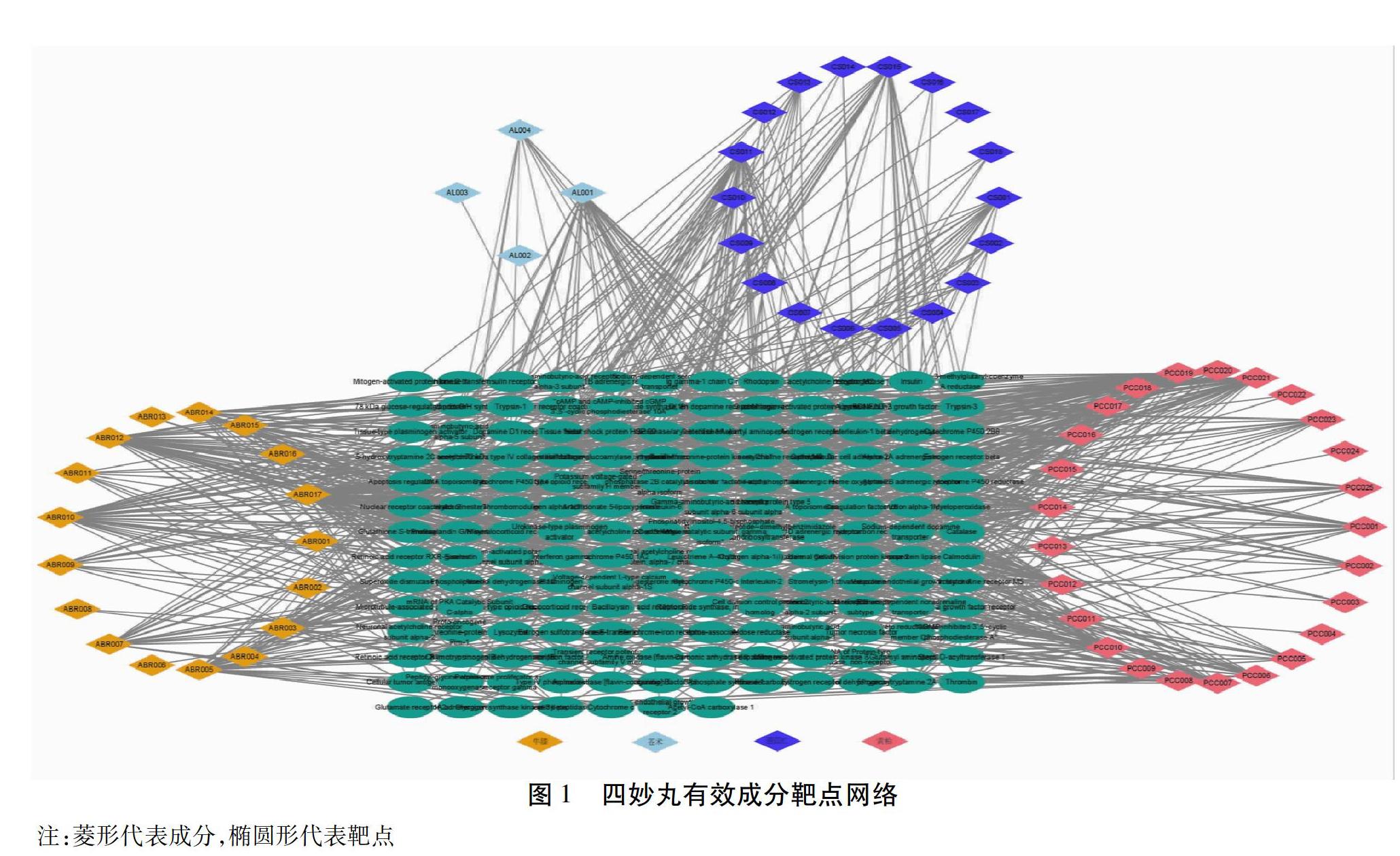
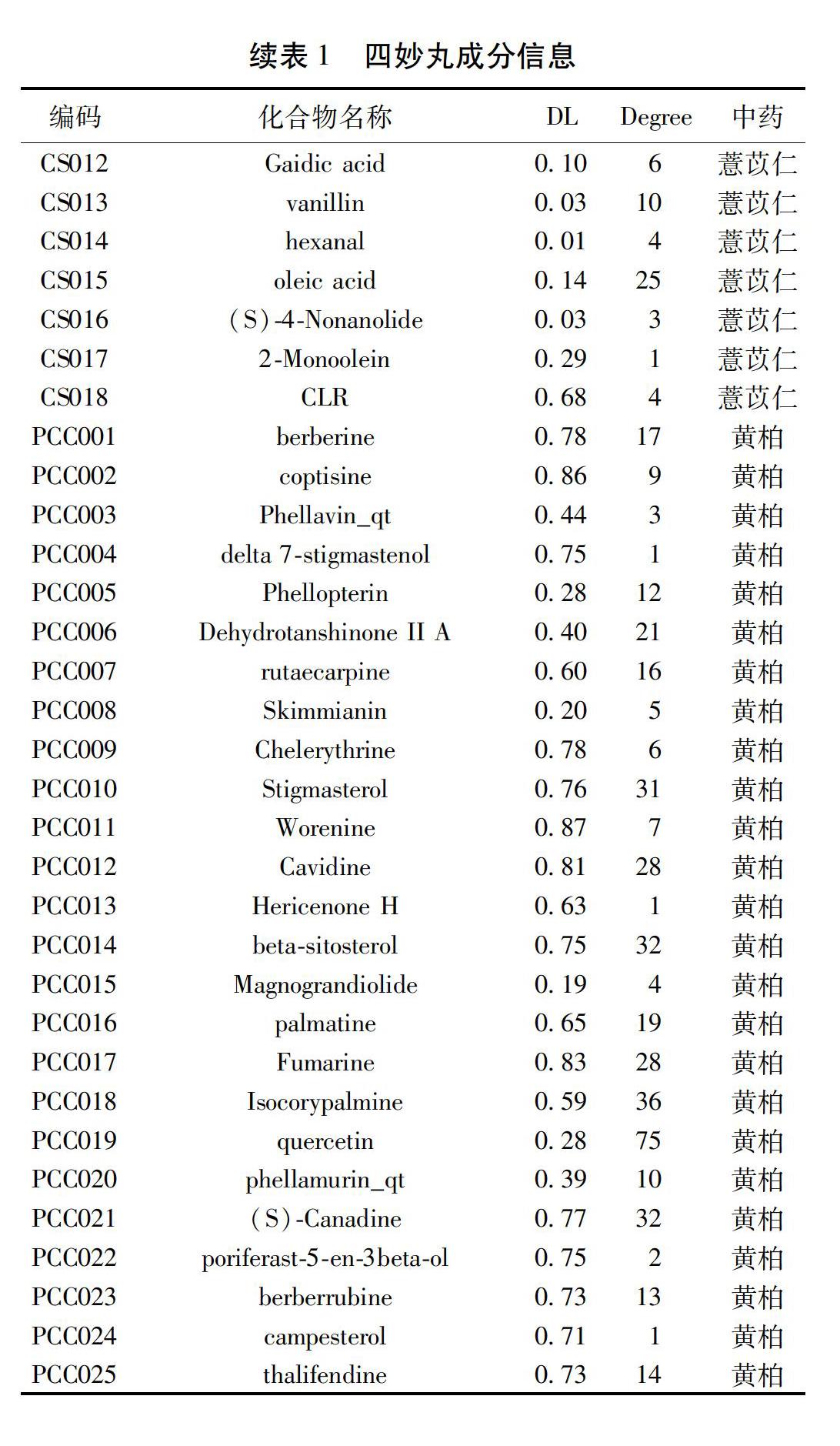
2.1 建立四妙丸化合物-靶点网络 本研究得到四妙丸四味中药的86种化合物,以及909个可能的相关靶点,靶点去重后有163个;其中有22个化合物没有找到相关靶点,故未参与分析。最终在四妙丸中得到64种化合物,苍术中有4种,黄柏中有25种,牛膝中有17种,薏苡仁中有18种。见表1。该网络中含有227个节点和908个相互关系(见图1)。“自由度”排名前三的化合物分别是槲皮素(Quercetin)(自由度值為75)、山柰酚(Kaempferol)(自由度值为44)、异延胡索单酚碱(Isocorypalmine)(自由度值为36)。
2.2 获取共同靶点及蛋白相互作用网络构建 将获取的骨关节炎989个疾病靶点与163个四妙丸化合物的作用靶点录入韦恩图在线绘制平台,二者取完交集后获得18个疾病-化合物共同靶点,该共同靶点在四妙丸治疗骨关节炎中具有重要意义。见图2。蛋白-蛋白相互作用网络共获得18个相互作用节点和108条相互作用关系。见图3。
2.3 GO功能注释 本研究通过对18个共同靶点进行GO功能注释,从而得到GO分析网络图。见图4。其共同靶点主要富集在参与蛋白质去乙酰化的调控(Regulation of Protein Deacetylation),细胞迁移参与新生血管生成(Cell Migration Involved in Sprouting Angiogenesis),急性炎性反应的调节(Regulation of Acute Inflammatory Response),一氧化氮代谢过程(Nitric Oxide Metabolic Process),血管平滑肌细胞增殖(Vascular Smooth Muscle Cell Proliferation),胶原分解的过程(Collagen Catabolic Process),等34个生物过程。这表明四妙丸对骨关节炎的治疗可能通过细胞因子分泌调节、抗氧化应激、蛋白降解、血管生成、组织重塑等。
2.4 KEGG通路富集分析 本研究对18个共同靶点进行KEGG通路分析,然后在omicshare(https://www.omicshare.com/)在线平台上对结果进行了可视化分析,得到KEGG分析气泡图。见图5。共同靶点主要富集于TNF信号通路、破骨细胞分化、IL-17信号通路、弓形虫病、恰加斯病(美国锥虫病)、利什曼病、流体剪切应力与动脉粥样硬化、糖尿病并发症的AGE-RAGE信号通路、松弛素信号通路、FcεRI信号通路等26条通路。
2.5 化合物-靶点-通路网络的构建 四妙丸中药化合物-共同靶点-信号通路网络关系图包含88个节点,235个相互作用关系。见图6。根据自由度高低可得出较为重要的化合物、靶点及通路。见表2。
3 讨论
四妙丸有清热利湿的药理作用和治疗功效,能够有效治疗湿热痹阻证骨关节炎。根据现代基础研究表明,苍术具有抗炎、抗过敏等作用[17],黄柏具有调节机体自身免疫、抗炎、抗细胞凋亡等作用[18-19],牛膝具有抗炎、扩张下肢血管、抗骨质疏松等作用[20],薏苡仁具有抗凝血、抗炎等作用[21]。
本研究发现在中药-主要成分-靶点-信号通路网络中槲皮素(Quercetin)、汉黄芩素(Wogonin)、山柰酚(Kaempferol)、巴马汀(Palmatine)、黄连碱(Coptisine)、黄芩素(Baicalein)等的自由度最高。其中槲皮素不仅对关节软骨基质具有优先的亲和力,还表明它可以通过抑制和减少活性氧种类(ROS)和下游因子(如MMP)来有效保护关节软骨。由于槲皮素本身是一种很强的抗氧化剂,它可以有效地通过抑制ROS的产生和NOX4的表达来提供潜在的软骨保护作用[22]。另外还有一些研究结果表明槲皮素具有与塞来昔布相当的抗氧化作用,可增加SOD的含量,下调软骨基质金属蛋白酶13(MMP-13)的表达并可以通过上调软骨细胞中TIMP-1的基因表达,减弱机体对氧化应激的反应,减轻关节软骨细胞外基质降解,从而有效改善骨关节炎表现[23]。另外还有一些研究结果指出汉黄芩素有效地抑制了兔关节软骨基质细胞中潜在的IL-1β诱导的基质金属蛋白酶1(MMP-1)、MMP-13和adamts-4的基因表达。同时它还恢复了IL-1β抑制的Ⅱ型胶原的基因表达。因此通过调节骨关节炎关节软骨破坏过程中不同蛋白酶的基因表达,以及在转录水平上促进II型胶原的基因转录表达,可有效支持汉黄芩素对软骨的保护作用[24]。汉黄芩素可通过插入机制较好地表现出与软骨细胞的DNA结合能力,其在细胞核内可以通过抑制IL-1β介导的ROS诱导、DNA的碎片化、外源性和内在性誘导的凋亡途径,体现出对骨关节炎软骨细胞的保护作用[25]。研究表明,山柰酚能显著地抑制炎性反应递质如诱导型一氧化氮合酶和环氧化酶2的白细胞介素(IL)1β诱导蛋白表达。并且山柰酚还抑制了由IL-1β诱导的常见基质降解酶,从而消除了胶原II的降解。山柰酚的抗炎作用是通过抑制丝裂原活化蛋白激酶相关的细胞外信号调节激酶和p38信号通路来介导的[26]。山柰酚的可以显著地阻止脂多糖引发的软骨细胞凋亡和炎性反应,其能显著下调MIR-146a,抑制了去整合素的表达,从而充分发挥对软骨的保护作用[27]。有研究已经证实了巴马汀对IL-1β刺激诱导的兔软骨细胞炎性反应具有保护作用,其对MMP的抑制作用可能与Wnt/β-连环蛋白和Hedgehog信号通路的抑制有关[28]。研究表明,黄连素通过抑制NF-kB信号通路从而抑制IL-1β诱导的炎性反应,其能显著抑制一氧化氮和前列腺素E2的产生,抑制IL-1β诱导的人OA软骨细胞中诱导型一氧化氮合酶和环氧化酶2的表达。同时也显著地抑制了MMP-3和MMP-13在IL-1β刺激的人OA软骨细胞中的表达,并且显著抑制了人OA软骨细胞中IL-1β诱导的NF-kB活化[29]。黄芩素的抗软骨细胞凋亡作用主要是由于抑制一氧化氮的产生和阻断Caspase下游的信号通路,其作用能显著地降低关节软骨细胞中MMP-3和MMP-13的分泌。黄芩素对小鼠关节软骨外植体的糖胺聚糖和Ⅱ型胶原沉积的恢复进一步证实了其抗分解代谢的重要作用[30]。故四妙丸治疗骨关节炎的过程中较为重要的成分可能是槲皮素(Quercetin)、汉黄芩素(Wogonin)、山柰酚(Kaempferol)、巴马汀(Palmatine)、黄连碱(Coptisine)、黄芩素(Baicalein)等。
在中药-化合物-靶点-信号通路网络中自由度最高的前6位靶点为前列腺素G/H合成酶2(PTGS2),丝裂原活化蛋白激酶1(MAPK1),丝裂原活化蛋白激酶14(MAPK14),丝裂原活化蛋白激酶8(MAPK8),肿瘤坏死因子(TNF),雄激素受体(AR)等。PTGS2是炎性反应性PG生物蛋白合成的一个重要关键酶,其可以作为炎性反应生物蛋白的标志物[31]。PTGS2在OA软骨和滑膜组织中过度的表达,损害蛋白聚糖的合成并增强了软骨中对软骨聚集蛋白聚糖和II型胶原的降解[32]。有更多的研究结果表明,阿片类药物诱导的对OA抗炎作用可能是由它们对MPGES和PTGS2表达的影响介导的[33]。TNF-α可与PGRN相互作用,诱导对软骨细胞降解蛋白酶的表达和软骨的丢失[34]。TNF-α可以通过激活NF-κB信号通路,上调各种MMP和ADAMT的水平,从而参与介导OA软骨的降解[35]。研究结果表明,TNF/TNFR的配体寡聚诱导了衔接蛋白的募集,如Fas相关死亡结构域蛋白和Tradd,这些衔接蛋白通过同源死亡结构域相互作用与受体胞质尾部结合,Procaspase-8通过同源死亡效应器结构域相互作用被衔接蛋白招募到复合物中,形成死亡诱导信号复合物,启动半胱天冬酶进而激活细胞并执行半胱天冬酶,其进而切割受体死亡底物,最终可能导致受体细胞凋亡[36],细胞凋亡被认为是导致OA软骨老化的一个关键因素[37]。睾酮的缺乏可诱导去势家兔细胞凋亡,减少软骨细胞的增殖和数量[38]。MA对雄性小鼠进行了体内研究(睾丸切除术与对照组),并确定完整小鼠表现出更严重的OA。此外,去势雄性小鼠补充了二氢睾酮后,与正常小鼠比较,出现了严重的OA[39]。MAPK1、MAPK14、MAPK8却少见相关报道。故四妙丸治疗骨关节炎的作用可能主要是通过调节PTGS2、TNF、AR等靶点来实现。
根据富集分析结果,四妙丸治疗骨关节炎主要涉及的通路可能是IL-17信号通路、流体剪切应力与动脉粥样硬化、糖尿病并发症的AGE-RAGE信号通路、松弛素信号通路、TNF信号通路、破骨细胞分化等。IL-17主要影响关节中的软骨细胞和成纤维细胞样滑膜细胞(FLS),其细胞表面表达IL-17受体[40]。IL-17已被证明能有效抑制关节中的软骨细胞合成蛋白聚糖,并且能促进软骨细胞基质金属蛋白酶的产生[41-43]。此外,IL-17影响其他对软骨有一定负面影响的细胞因子和化合物的分泌,如IL-1、TNF、IL-6、NO和PGE2[44-46]。患者的血清和滑液中IL-17水平明显升高,与OA病变的影像学和临床表现表现呈正相关[47]。TNF-α是导致关节软骨退变的关键炎性反应因子之一,参与关节滑膜炎症的反应、软骨细胞凋亡的启动、软骨损伤和修复之间的不平衡以及最终加速关节软骨退化[48]。松弛素已被证明能在各种情况下引起抗炎作用。在大鼠和豚鼠的炎性反应模型中,松弛素通过一氧化氮的产生介导抑制肥大细胞释放组胺[49]。松弛素还抑制中性粒细胞[50]和肥大细胞[51]等炎性反应细胞流入受损器官。研究结果表明,CD14-细胞促进破骨细胞的形成不仅发生在RA中,而且也发生在OA中,一种罕见的侵蚀性炎症性OA可发生在手指间关节[52]。而流体剪切应力与动脉粥样硬化,糖尿病并发症的AGE-RAGE信号通路相关报道较少。此外研究发现四妙丸治疗OA主要涉及蛋白质去乙酰化的调控,细胞迁移参与新生血管生成,急性炎性反应的调节,一氧化氮代谢过程,血管平滑肌细胞增殖,胶原分解过程等生物过程。由此可推测,四妙丸可能通过抑制炎性反应、调节免疫功能来治疗骨关节炎。
综上所述,本研究通过网络药理学挖掘到四妙丸中64种化合物及163个靶点,骨关节炎疾病靶点989个,其中四妙丸-骨关节炎疾病共同靶点18个,对共同靶点进行GO功能注释及KEGG信号通路富集分析,得出四妙丸可能是通过调节PTGS2、TNF、AR等靶点,调控IL-17信号通路、TNF信号通路、松弛素、破骨细胞分化等通路,从而抑制炎性反应、调节机体免疫功能来治疗骨关节炎。由于各种平台数据库、相关软件算法的限制,本研究的预测结果可为四妙丸的基础研究提供线索,为了提高结果的可靠性,其具体作用机制还需进一步的实验来验证。
参考文献
[1]Tang X,Wang S,Zhan S,et al.The Prevalence of Symptomatic Knee Osteoarthritis in China:Results From the China Health and Retirement Longitudinal Study[J].Arthritis & Rheumatology,2016,68(3):648-653.
[2]李宁华.中老年人群骨关节炎的流行病学特征[J].中国临床康复,2005,9(38):133-135.
[3]Fransen M,Bridgett L,March L,et al.The epidemiology of osteoarthritis in Asia[J].Int J Rheum Dis,2011,14(2):113-121.
[4]Ding C,Martel-Pelletier J,Pelletier J P,et al.Meniscal tear as an osteoarthritis risk factor in a largely non-osteoarthritic cohort:a cross-sectional study[J].J Rheumatol,2007,34(4):776-784.
[5]Hunter D J,Zhang Y Q,Niu J B,et al.The association of meniscal pathologic changes with cartilage loss in symptomatic knee osteoarthritis[J].Arthritis Rheum,2006,54(3):795-801.
[6]Schmidt T W.Approach to Osteoarthritis Management for the Primary Care Provider[J].Primary Care:Clinics in Office Practice,2018,45(2):361-378.
[7]肖玉蓮,马合肖,潘乐意.四妙丸加中药熏洗治疗膝骨性关节炎急性发作临床观察[J].中医学报,2011,26(6):735-736.
[8]蒋淑莲,陈保安,吴民祥,等.四妙丸治疗膝骨性关节炎倂积液临床疗效观察[J].内蒙古中医药,2014,33(35):24-25.
[9]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[10]Wishart D S,Knox C,Guo A C,et al.DrugBank:a knowledgebase for drugs,drug actions and drug targets[J].Nucleic Acids Res,2008,36(Database issue):D901-D906.
[11]UniProt:the universal protein knowledgebase[J].Nucleic Acids Res,2017,45(D1):D158-D169.
[12]Franz M,Lopes C T,Huck G,et al.Cytoscape.js:a graph theory library for visualisation and analysis[J].Bioinformatics,2016,32(2):309-311.
[13]Liu X,Zhu F,Ma X,et al.The Therapeutic Target Database:an internet resource for the primary targets of approved,clinical trial and experimental drugs[J].Expert Opin Ther Targets,2011,15(8):903-912.
[14]Pinero J,Queralt-Rosinach N,Bravo A,et al.DisGeNET:a discovery platform for the dynamical exploration of human diseases and their genes[J].Database(Oxford),2015,2015:v28.
[15]von Mering C,Huynen M,Jaeggi D,et al.STRING:a database of predicted functional associations between proteins[J].Nucleic Acids Res,2003,31(1):258-261.
[16]Bindea G,Mlecnik B,Hackl H,et al.ClueGO:a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks[J].Bioinformatics,2009,25(8):1091-1093.
[17]Jun X,Fu P,Lei Y,et al.Pharmacological effects of medicinal components of Atractylodes lancea(Thunb.)DC[J].Chin Med,2018,13:59.
[18]張冠英,董瑞娟,廉莲.川黄柏、关黄柏的化学成分及药理活性研究进展[J].沈阳药科大学学报,2012,29(10):812-821.
[19]李先宽,冯杉,郑艳超,等.黄柏与关黄柏的化学成分及生物活性研究进展[J].药物评价研究,2019,42(5):1033-1037.
[20]田硕,苗明三.牛膝的化学、药理及应用特点探讨[J].中医学报,2014,29(8):1186-1188.
[21]吴岩,原永芳.薏苡仁的化学成分和药理活性研究进展[J].华西药学杂志,2010,25(1):111-113.
[22]Mok S,Fu S,Cheuk Y,et al.Intra-Articular Delivery of Quercetin Using Thermosensitive Hydrogel Attenuate Cartilage Degradation in an Osteoarthritis Rat Model[J].CARTILAGE,2018:764875239.
[23]Wei B,Zhang Y,Tang L,et al.Protective effects of quercetin against inflammation and oxidative stress in a rabbit model of knee osteoarthritis[J].Drug Development Research,2019,80(3):360-367.
[24]Park J S,Lee H J,Lee D Y,et al.Chondroprotective Effects of Wogonin in Experimental Models of Osteoarthritis in vitro and in vivo[J].Biomol Ther(Seoul),2015,23(5):442-448.
[25]Khan N M,Ahmad I,Ansari M Y,et al.Wogonin,a natural flavonoid,intercalates with genomic DNA and exhibits protective effects in IL-1beta stimulated osteoarthritis chondrocytes[J].Chem Biol Interact,2017,274:13-23.
[26]Huang X,Pan Q,Mao Z,et al.Kaempferol inhibits interleukin-1β stimulated matrix metalloproteinases by suppressing the MAPK-associated ERK and P38 signaling pathways[J].Molecular Medicine Reports,2018,18(3):2697-2704.
[27]Jiang R,Hao P,Yu G,et al.Kaempferol protects chondrogenic ATDC5 cells against inflammatory injury triggered by lipopolysaccharide through down-regulating miR-146a[J].International Immunopharmacology,2019,69:373-381.
[28]Zhou X,Lin X,Xiong Y,et al.Chondroprotective effects of palmatine on osteoarthritis in vivo and in vitro:A possible mechanism of inhibiting the Wnt/β-catenin and Hedgehog signaling pathways[J].International Immunopharmacology,2016,34:129-138.
[29]Zhou K,Hu L,Liao W,et al.Coptisine Prevented IL-β-Induced Expression of Inflammatory Mediators in Chondrocytes[J].Inflammation,2016,39(4):1558-1565.
[30]Zhang X,Zhu Y,Chen X,et al.Baicalein ameliorates inflammatory-related apoptotic and catabolic phenotypes in human chondrocytes[J].International Immunopharmacology,2014,21(2):301-308.
[31]Benelli R,Vene R,Ferrari N.Prostaglandin-endoperoxide synthase 2(cyclooxygenase-2),a complex target for colorectal cancer prevention and therapy[J].Transl Res,2018,196:42-61.
[32]Attur M,Al-Mussawir H E,Patel J,et al.Prostaglandin E2 exerts catabolic effects in osteoarthritis cartilage:evidence for signaling via the EP4 receptor[J].J Immunol,2008,181(7):5082-5088.
[33]Schwarzbach S V,Melo C F,Xavier P,et al.Morphine,but not methadone,inhibits microsomal prostaglandin E synthase-1 and prostaglandin-endoperoxide synthase 2 in lipopolysaccharide-stimulated horse synoviocytes[J].Biochimie,2019,160:28-33.
[34]Zhao Y,Liu B,Tian Q,et al.Progranulin protects against osteoarthritis through interacting with TNF-α and β-Catenin signalling[J].Annals of the Rheumatic Diseases,2015,74(12):2244-2253.
[35]Kapoor M,Martel-Pelletier J,Lajeunesse D,et al.Role of proinflammatory cytokines in the pathophysiology of osteoarthritis[J].Nat Rev Rheumatol,2011,7(1):33-42.
[36]Aizawa T,Kon T,Einhorn T A,et al.Induction of apoptosis in chondrocytes by tumor necrosis factor-alpha[J].J Orthop Res,2001,19(5):785-796.
[37]Pelletier J P,Jovanovic D V,Lascau-Coman V,et al.Selective inhibition of inducible nitric oxide synthase reduces progression of experimental osteoarthritis in vivo:possible link with the reduction in chondrocyte apoptosis and caspase 3 level[J].Arthritis Rheum,2000,43(6):1290-1299.
[38]Irie T,Aizawa T,Kokubun S.The role of sex hormones in the kinetics of chondrocytes in the growth plate.A study in the rabbit[J].J Bone Joint Surg Br,2005,87(9):1278-1284.
[39]Ma H L,Blanchet T J,Peluso D,et al.Osteoarthritis severity is sex dependent in a surgical mouse model[J].Osteoarthritis Cartilage,2007,15(6):695-700.
[40]Honorati M C,Neri S,Cattini L,et al.Interleukin-17,a regulator of angiogenic factor release by synovial fibroblasts[J].Osteoarthritis Cartilage,2006,14(4):345-352.
[41]Benderdour M,Tardif G,Pelletier J P,et al.Interleukin 17(IL-17)induces collagenase-3 production in human osteoarthritic chondrocytes via AP-1 dependent activation:differential activation of AP-1 members by IL-17 and IL-1beta[J].J Rheumatol,2002,29(6):1262-1272.
[42]Martel-Pelletier J,Mineau F,Jovanovic D,et al.Mitogen-activated protein kinase and nuclear factor kappaB together regulate interleukin-17-induced nitric oxide production in human osteoarthritic chondrocytes:possible role of transactivating factor mitogen-activated protein kinase-activated proten kinase(MAPKAPK)[J].Arthritis Rheum,1999,42(11):2399-2409.
[43]Lubberts E,Joosten L A,van de Loo F A,et al.Reduction of interleukin-17-induced inhibition of chondrocyte proteoglycan synthesis in intact murine articular cartilage by interleukin-4[J].Arthritis Rheum,2000,43(6):1300-1306.
[44]Honorati M C,Bovara M,Cattini L,et al.Contribution of interleukin 17 to human cartilage degradation and synovial inflammation in osteoarthritis[J].Osteoarthritis Cartilage,2002,10(10):799-807.
[45]Legrand A,Fermor B,Fink C,et al.Interleukin-1,tumor necrosis factor alpha,and interleukin-17 synergistically up-regulate nitric oxide and prostaglandin E2 production in explants of human osteoarthritic knee menisci[J].Arthritis Rheum,2001,44(9):2078-2083.
[46]Attur M G,Patel R N,Abramson S B,et al.Interleukin-17 up-regulation of nitric oxide production in human osteoarthritis cartilage[J].Arthritis Rheum,1997,40(6):1050-1053.
[47]Chen B,Deng Y,Tan Y,et al.Association between severity of knee osteoarthritis and serum and synovial fluid interleukin 17 concentrations[J].J Int Med Res,2014,42(1):138-144.
[48]Urech D M,Feige U,Ewert S,et al.Anti-inflammatory and cartilage-protecting effects of an intra-articularly injected anti-TNF{alpha} single-chain Fv antibody(ESBA105)designed for local therapeutic use[J].Ann Rheum Dis,2010,69(2):443-449.
[49]Bani D,Ballati L,Masini E,et al.Relaxin counteracts asthma-like reaction induced by inhaled antigen in sensitized guinea pigs[J].Endocrinology,1997,138(5):1909-1915.
[50]Masini E,Nistri S,Vannacci A,et al.Relaxin inhibits the activation of human neutrophils:involvement of the nitric oxide pathway[J].Endocrinology,2004,145(3):1106-1112.
[51]Masini E,Bani D,Bigazzi M,et al.Effects of relaxin on mast cells.In vitro and in vivo studies in rats and guinea pigs[J].J Clin Invest,1994,94(5):1974-1980.
[52]Danks L,Sabokbar A,Gundle R,et al.Synovial macrophage-osteoclast differentiation in inflammatory arthritis[J].Ann Rheum Dis,2002,61(10):916-921.
(2019-12-04收稿 責任编辑:苍宁)
