微波消融联合经导管动脉化疗栓塞术治疗肝细胞癌生存预测
2020-06-24张学军石宝琪谭永胜朝鲁孟
徐 圣, 张学军, 石宝琪, 谭永胜, 朝鲁孟
根据巴塞罗那临床肝癌分期(BCLC),消融、外科切除、移植、TACE 和系统治疗是肝细胞癌(HCC)主要的治疗手段。 近年来,微波消融(MWA)的应用逐渐增多[1],适用于直径在3~5 cm 及病灶靠近血管或胆囊的HCC 患者[2]。 TACE 可通过对局部病灶化疗、阻断肿瘤供血血管、导致肿瘤坏死,达到抑制肿瘤生长并延长生存期的效果[3]。 尤其对于较大的病灶,单用TACE 或MWA 很难实现完全的坏死[4]。因此,TACE 联合MWA 已广泛应用于HCC 患者的治疗[5-9]。文献报道接受联合治疗的患者中位总生存期(mOS)为13.5~42.7 个月[5-6,10-12]。本研究旨在探讨影响MWA 联合TACE 治疗HCC 患者OS 的预测因素,并对患者的OS 进行准确预测,以指导临床实践。
1 材料与方法
1.1 材料
1.1.1 患者选择 回顾性分析2013 年1 月至2017年3 月于内蒙古自治区人民医院行MWA 联合TACE 治疗的HCC 患者,HCC 的诊断遵循原发性肝癌诊疗规范(2017 版)[13]。入组标准为:①MWA 序贯TACE 治疗;②年龄≥18 岁;③在联合治疗前未经过外科手术和/或其他消融治疗及系统治疗等;④肝功能Child-Pugh A 或B 级。 排除标准为:①肝功能Child-Pugh C 级;②治疗后接受外科手术的患者;③资料不全;④失访。 入组患者资料见表1。
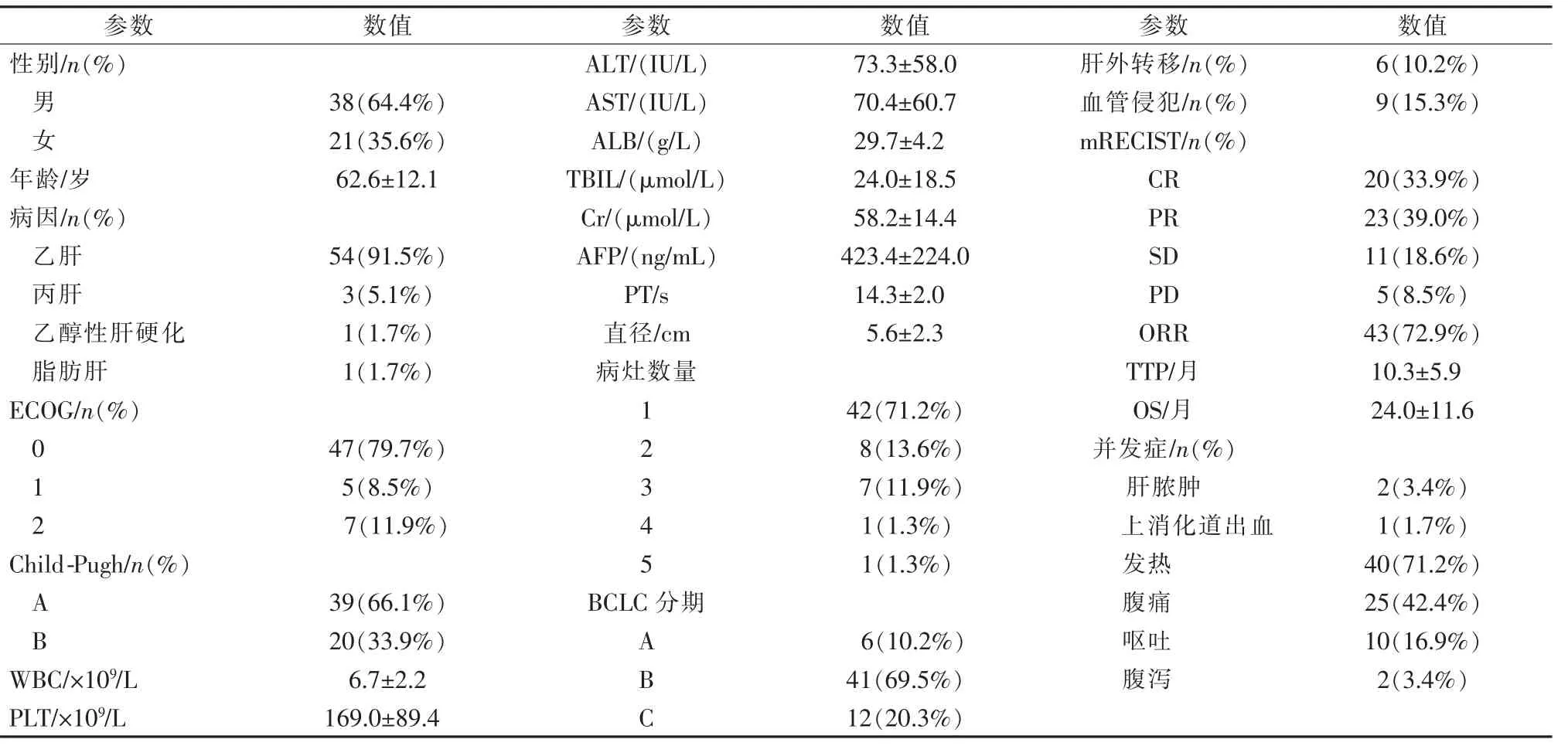
表1 59 例入组患者的基线特征及预后
1.1.2 器材 影像设备采用DSA(Philips,FD20),64 排螺旋CT(Philips)。 辅助材料:RH 导管(Cook)、泥鳅导丝(Cook)、微导管微导丝(朝日)、对比剂为碘海醇(300 mg I/mL),栓塞剂使用罂粟乙碘油(恒瑞)、 明胶海绵颗粒, 化疗药物选用吡柔比星60~100 mg、洛铂50~150 mg。微波消融治疗仪(康友),频率为2 450 MHz,微波辐射电极系硬质内水冷针,外径1.8 mm(14 F),长18~20 mm。
1.2 方法
1.2.1 治疗方法
1.2.1.1 TACE 本研究手术操作遵循美国介入放射学会的TACE 指南[14]。 采用Seldinger 穿刺法穿刺右侧股动脉,通过5 F 导管鞘引入5 F RH 导管,在DSA 引导下通过腹腔干选至肝动脉,通过造影评估肿瘤的位置、直径、数量、门静脉癌栓及肝内肝动脉门静脉瘘。 如果没有明确的肿瘤病灶供血,还可选取肠系膜上动脉、单侧膈下动脉动脉、胸廓内动脉及肾上腺动脉寻找供血血管,然后必要时引入微导管超选供血血管。 通过微导管注入碘化油及吡柔比星或洛铂的乳化液5~15 mL,必要时采取明胶海绵颗粒或微球栓塞肿瘤供血血管,门静脉分支显影时停止栓塞。 化疗药物的剂量根据患者的肝功能状况进行调整,乳化液的用量根据肿瘤大小及肿瘤供血血管血流状况决定。
1.2.1.2 MWA 在TACE 实施后1~2 周内序贯行CT 引导下MWA 治疗。取仰卧位,常规消毒、铺巾、麻醉,CT 引导下使用消融穿刺针穿入肿块内。 根据病灶大小选择不同的功率、 消融时间及消融针数,功率多为40~60 W,作用时间多为5~10 min,以损毁病灶及周围少量肝组织为主要操作目的。 (图1)。
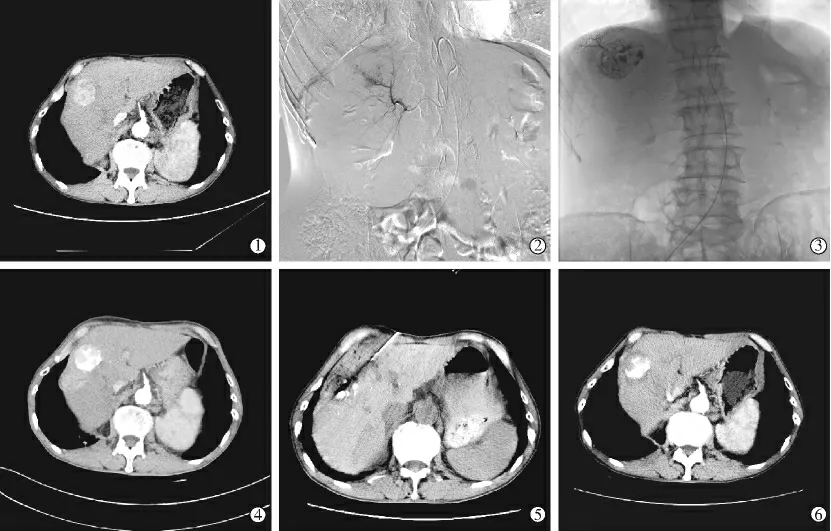
图1 典型病例图像
1.2.2 定义与随访 所有患者术前行动态增强CT或增强MRI、生化指标、AFP、血常规、凝血功能等检查,术后每2 个月复查相关指标。 所有病例均进行随访, 随访终点时间为2019 年3 月31 日。 术后2个月行mRECIST 评估。 本研究OS 的定义为在随访终点时间前,接受序贯治疗后的生存时间,①对于该日期前已死亡患者,计为死亡,其OS 为治疗开始至死亡的时间,作为截尾数据;②对于该日期时未死亡患者,记为生存,其OS 为治疗开始至该日期,作为截尾数据;③对于失访患者,记为失访,其OS为治疗开始至末次随访的时间,作为截尾数据。 本研究肿瘤进展时间(time to progression, TTP)的定义为治疗开始到观察到肿瘤进展的时间。
1.3 统计学方法
在OS 的基础上,采用Log-rank 检验对13 项潜在因素行单因素分析, 再将筛选出的因素进行Cox多因素回归分析。 所有检验均取P<0.05 为差异有统计学意义,并取其95%可信区间(CI)。 根据所得预测因素,绘制预后的列线图(nomogram),并采用Harrell’s C statistic 评价其准确性。所有的统计分析采用的统计软件是SPSS 19.0(IBM Corporation,Somers,NY,USA)。 nomogram 的绘制采用的统计软件是R(Version 3.0.2; R Package for Statistical Computing;www.r-project.org)。
2 结果
2.1 基线特征与预后结局
共有59 例患者纳入研究,其中男38 例,女21例。 基线资料见表1。 患者的mOS 为(24.0±11.6)个月,TTP 为(10.3±5.9)个月,总体缓解率为72.9%,1例患者出现肝脓肿,经经皮穿刺引流术后好转,另有1 例患者出现消化道出血,经内科治疗后症状改善。
2.2 单因素及多因素分析结果
单因素分析显示AST≥40 IU/L(P=0.007)、病灶数量≥2(P=0.001)、最大肿瘤直径≥7 cm(P<0.001)、PVTT(P<0.001)及AFP≥400 ng/mL(P<0.001)与OS 较短显著相关(见表2、3 及图2),多因素Cox 回归分析显示最大肿瘤直径≥7 cm(HR:2.518[95%CI]1.380~4.595,P=0.003)、PVTT(HR:4.443[95%CI]1.904~10.371,P=0.001)和AFP≥400 ng/mL(HR:2.216[95%CI]1.277~3.847,P=0.005)是影响OS 的预测因素。
2.3 预后nomogram
采用R(Version 3.0.2; R Package for Statistical Computing; www.r-project.org)软件绘制预后的计算图,计算得Harrell’s C statistic 为0.81,提示该模型对于OS 预测的准确度较高(图3)。
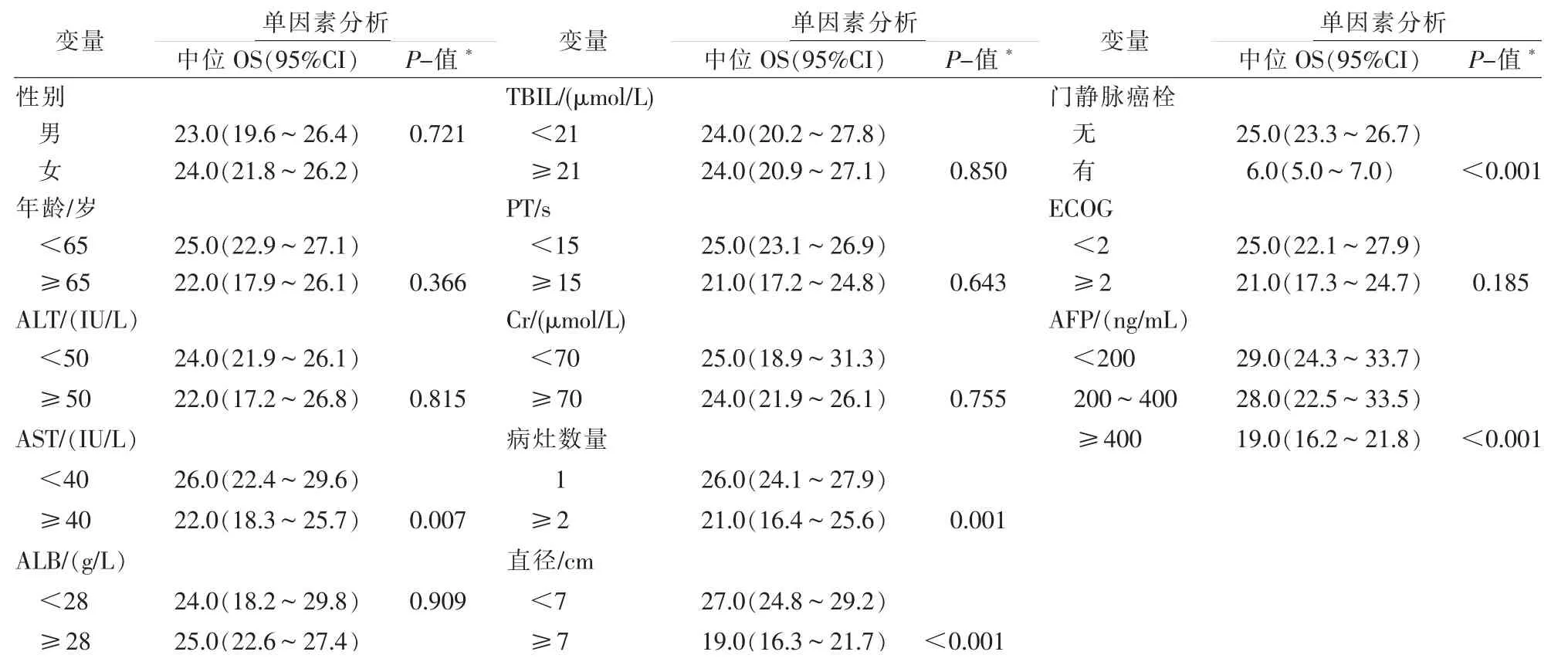
表2 MWA 联合TACE 治疗的HCC 患者OS 的单因素分析

表3 MWA 联合TACE 治疗的HCC 患者OS 的多因素分析
3 讨论
目前TACE 及消融治疗已成为HCC 患者有效的治疗方式。 MWA 主要机制是微波的热效应及肿瘤对于热反应的敏感性从而使肿瘤病灶凝固坏死[15]。 有研究表明TACE 可通过阻塞肿瘤血管床来减弱肝血流经过微波热凝固区域的降温效应[5],因此,MWA 联合TACE 相比MWA 或TACE 单独治疗的预后更佳[5,12,16]。然而,MWA 联合TACE 治疗HCC患者预后差异较大,缺乏有效的预测因素。 多项研究探讨相关因素,但部分仍存在争议。 本研究基于预测因素结果构建预后nomogram,从而对MWA 联合TACE 治疗HCC 的OS 进行有效预测,以指导临床决策。

图2 预测因素的Kaplan-Meier 分析
单用MWA 适用于直径3~5 cm 病灶[2],尤其对直径<3 cm 的病灶更易实现完全消融。而对于较大病灶,难以实现肿瘤边缘的完全消融,易导致病灶周边复发。本研究中,病灶直径≥7 cm 的患者,其OS 显著较小, 病灶直径是OS 的不良预后因素。Chen 等[17]采用倾向匹配得分比较联合治疗与单用TACE 治疗直径≤5 cmHCC 患者的预后,结果表明联合组的缓解率较单治疗组更长, 联用组TTP 也更高,而OS 无显著差异。 有研究对比联合治疗与单用TACE 治疗对于较大直径单发(肿瘤总体直径>10 cm)或多发HCC 患者的有效性,表明联合组可显著延长OS 及TTP, 肿瘤直径与数量是其预后因素[12]。联合治疗可改善预后的可能机制为:①肿瘤血供的减少可降低消融时局部病灶热量的消散; ②栓塞后的局部坏死可导致炎症水肿,从而加快热量传导,一定程度上增加消融的效果。Zhang 等[16]研究证实联合治疗对于病灶直径≤7 cm、 肿瘤数量≤5 的B期HCC 更有效。 同样,对于病灶直径≥10 cm 的巨大HCC 患者,联合治疗也可延长OS 并改善肝功能[18]。

图3 MWA 联合TACE 治疗HCC 患者的nomogram
PVTT 是BCLC C 期患者的主要特征。 无PVTT的患者OS 为24.4 个月, 而有PVTT 的患者OS 为2.7 个月[19]。本研究中9 例患者伴有PVTT,其OS 不随PVTT 的患者显著下降, 其中3 例在联合治疗后改用索拉菲尼+TACE 治疗。 作为常用的肿瘤标志物,AFP 对于HCC 患者的诊断、 治疗及预后评估具有重要作用。 Choi 等[20]表明RFA 术前的AFP 水平与患者的长期预后相关,术后AFP 水平较高提示病灶活性存在的可能。 本研究中,术前AFP≥400 ng/mL的患者超过60%,在统计分析中,其对OS 的影响显著。 而部分研究中AFP 并非OS 的预后因素,可能原因为病例中的其他特征与OS 相关性更强[18]。
本研究在预测因素的基础上, 构建预后nomogram, 可根据联合治疗前患者的临床特征,从而对患者的OS 进行预测, 可为术后治疗决策选择提供指导。 该nomogram 的准确性较高,可对患者的OS 进行准确预测。
然而,本研究仍存在如下不足:①本研究为单中心回顾性研究,病例数仍较少;②本研究排除了联合治疗前接受其他治疗方式的患者;③肝外转移的患者数量较少,无法进行有效的分析。 综上所述,PVTT、AFP≥400 ng/mL、最大肿瘤直径≥7 cm 是影响MWA 联合TACE 治疗HCC 患者OS 的预测因素, 以此为基础构建的预后nomogram 的准确度较高,但未来仍需进一步大样本的多中心研究来证实。
